Biosphäre

Die Biosphäre [] (von griechisch βίος bíos ‚Leben‘ und σφαίρα sphaira ‚Kugel‘) bezeichnet die Gesamtheit aller Räume eines Himmelskörpers, in denen Lebewesen vorkommen. Meist bezieht sich die Bezeichnung auf die Biosphäre der Erde. Der Begriff hat im Verlauf des vergangenen Jahrhunderts zwei Bedeutungswandlungen erfahren. Augenblicklich wird er innerhalb der Biowissenschaften vor allem in einer ökologischen Bedeutung verstanden. Dadurch wird Biosphäre synonym mit den Begriffen Biogeosphäre, Geobiosphäre und Ökosphäre verwendet.
Außer für die Erde wurde bisher für keinen anderen Planeten, Zwergplaneten, Planetoiden oder Mond das Vorhandensein von Lebewesen oder zumindest von Lebensspuren belegt. Nach derzeitigem Kenntnisstand scheint eine Biosphäre ein sehr seltenes Phänomen zu sein, das zumindest im hiesigen Sonnensystem die Erde einzigartig sein lässt.
Die Biosphäre wird als dünne Hülle (Sphäre) gedacht, die einen äußeren Bereich der Erde durchwirkt, und ist damit eine der Erdsphären. Sie reicht ungefähr von 5 km unter der Erdoberfläche bis 60 km über die Erdoberfläche, d. h. von der oberen Lithosphäre bis in den unteren Saum der Mesosphäre. Ihre äußeren Bereiche in der Tiefe und in der Höhe werden ausschließlich von Mikroorganismen bewohnt.
Wegen ihrer gewaltigen Ausdehnung und Komplexität ragen Aspekte der Biosphäre in die Forschungsfelder vieler verschiedener Naturwissenschaften hinein. Einen echten Forschungsschwerpunkt bildet die Biosphäre zumindest für jene Naturwissenschaften, die sich im Übergangsfeld zwischen Biologie und Geowissenschaften bewegen – Landschaftsökologie/Geoökologie und Geobiologie. Dazu tritt die Biogeochemie, die sich mit den Stoffkreisläufen innerhalb der Biosphäre auseinandersetzt. Und die Astrobiologie versucht herauszufinden, welche Bedingungen zur Entstehung einer Biosphäre führen und woran ihr Vorhandensein auf anderen Himmelskörpern erkannt werden könnte.
Die beiden Wissenschaftler Lynn Margulis und James Lovelock entwickelten Mitte der 1960er-Jahre die Gaia-Hypothese. Sie besagt, dass die irdische Biosphäre als ganzheitlicher Organismus betrachtet werden kann, der die Bedingungen schafft und erhält, die nicht nur Leben, sondern auch eine Evolution ermöglicht. Diese Theorie wird allerdings von vielen Wissenschaftlern abgelehnt, obwohl viele ihrer Vorhersagen bereits verifiziert wurden.
Seit der Entstehung menschlicher Zivilisationen wurde der anthropogene Einfluss auf die Naturräume der Erde immer größer. Der amerikanische Biologe Raymond Dasmann prägte 1976 die Begriffe „Ökosystem-Menschen und Biosphären-Menschen“. Die erstgenannten sind die naturnah lebenden Ethnien, die nur ein oder wenige Ökosysteme beeinflussen, während die zweitgenannten die modernen Gesellschaften sind, die aufgrund globaler Wirtschaftsverflechtungen Einfluss auf die unterschiedlichsten Lebensräume weltweit nehmen.[1] Da dieser Einfluss auf die Biosphäre spätestens seit dem Jahr 1800 zu einem wesentlichen Faktor geworden ist, wie die globalen Umweltveränderungen durch den Menschen zeigen, wird diskutiert, den Beginn eines neuen Erdzeitalters – genannt Anthropozän – auszurufen.[2] Eine große Zahl von Wissenschaftlern sieht die derzeitigen Trends für die Biosphäre allerdings mit großer Skepsis und Sorge.[3]
Begriff
[Bearbeiten | Quelltext bearbeiten]
Die irdische Biosphäre umschreibt den Raum des Planeten Erde, in dem Leben vorkommt.[4] Dabei ist Leben darauf angewiesen, mit seiner Umwelt zu wechselwirken. Um zu überleben, müssen die Lebewesen Stoffe und Energie mit ihrer unbelebten Umwelt und untereinander austauschen. Sie müssen sogenannte Ökosysteme bilden. Dies ist eine grundsätzliche Eigenschaft von Lebewesen.[5] Ohne ökosystemare Wechselwirkungen wäre Leben nicht möglich. Deshalb verändert das Leben zwingend die Ausstattung des Raums, in dem es sich ansiedelt. Da sich Lebewesen weltweit angesiedelt haben, kann die Biosphäre als der Raum eines weltumspannenden Ökosystems begriffen werden.
- Die irdische Biosphäre umschreibt den Raum des Planeten Erde, in dem Leben vorkommt: Der Raum zusammen mit der darin vorkommenden Gesamtheit der irdischen Organismen und ihrer unbelebten Umwelt und der Wechselwirkungen der Lebewesen untereinander und mit ihrer unbelebten Umwelt.
Das Vorhandensein eines globalen Ökosystems wurde das erste Mal vom russischen Geowissenschaftler Wladimir Wernadski erkannt. Um es zu benennen, verwendete er ein Wort, das zuvor vom österreichischen Geologen Eduard Suess erfunden worden war: Biosphäre.[6]
Die Biosphäre kann in drei große Untereinheiten gegliedert werden. Die Tiefe Biosphäre bezeichnet die Ökosysteme der Lithosphäre unterhalb von Erdoberfläche und Böden.[7] Die Hydrobiosphäre umschreibt die von Lebewesen besiedelten und beeinflussten Anteile der Gewässer.[8] Als dritte Untereinheit bezeichnet die Geobiosphäre die von Lebewesen besiedelten und beeinflussten Anteile der Festländer.[9][10] Weil mit dem gleichen Wort manchmal auch die gesamte Biosphäre benannt wird, birgt Geobiosphäre eine Missverständnismöglichkeit.[11]
Biosphäre der Mikroorganismen
[Bearbeiten | Quelltext bearbeiten]
Die Biosphäre reicht hinauf bis in den unteren Rand der Mesosphäre. Innerhalb des biosphärischen Raums können die Umweltbedingungen stark unterschiedlich ausfallen. Deshalb können nicht alle Bereiche der Biosphäre von allen Lebewesen gleich gut besiedelt werden.[14] Gerade vielzellige Organismen (Metabionta) können dauerhaft – und natürlich in Gesellschaft mit vielen Mikroorganismen – nur in Regionen gedeihen, in denen verhältnismäßig milde Temperaturen, Drücke, Strahlungswerte, pH-Werte und Ähnliches herrschen und in denen ausreichende Angebote an Wasser und Ernährungsmöglichkeiten bestehen.
Dementgegen werden in den biosphärischen Außenzonen die Umweltbedingungen zunehmend extremer. Dort können ausschließlich Mikroorganismen existieren. Bei noch harscheren Umweltbedingungen können selbst solche widerstandsfähigen Mikroben bloß in Dauerstadien bestehen. Die Dauerstadien markieren die Außengrenzen der Biosphäre.
- Die irdische Biosphäre umschreibt den Raum des Planeten Erde, in dem Mikroorganismen vorkommen.[15]
Biosphäre der Biome
[Bearbeiten | Quelltext bearbeiten]Lebewesen bilden miteinander Biozönosen (Lebensgemeinschaften). Unter den Mitgliedern einer Biozönose bestehen vielfältige wechselseitige Beziehungen, die als Biotische Ökofaktoren zusammengefasst werden.[16] Biozönosen bewohnen miteinander Physiotope (stoffliche Orte). Ein Physiotop ist ein kleiner Raumausschnitt mit einem homogenen Aussehen, der sich durch ein bestimmtes, einheitliches Physiosystem (Standort) auszeichnet.[17] Mit Physiosystem wird die Gesamtheit der in einem Physiotop ausgeprägten abiotischen Ökofaktoren bezeichnet.[18][19][20]

Die Mitglieder der Biozönose wechselwirken untereinander und mit ihrem Physiosystem.[21] Sie bilden ein gemeinsames Wirkungsgefüge.[5] Dieses Wirkungsgefüge heißt Ökosystem.[4][22]
Ein Ökosystem ist ein System, ein Verband aus miteinander wechselwirkenden Einheiten. Die Systemeinheiten des Ökosystems bestehen einerseits aus den Lebewesen der Biozönose und andererseits aus den unbelebten Dingen des Physiosystems.[23] Ein Ökosystem ist ein offenes System:[22] Stoffe und Energie dringen von Außen in das Ökosystem ein, zirkulieren für eine gewisse Zeit zwischen den Systemeinheiten und verlassen es schließlich wieder.[24]
Ein bestimmtes Physiosystem lässt nur eine bestimmte Biozönose aus solchen Lebensformen zu, die an es angepasst sind. Allerdings verändert die Biozönose allmählich die Ausprägung der abiotischen Ökofaktoren des Physiosystems.[17][25] Durch die Biozönose wandelt sich das Physiotop zum Ökotop.[26] Das Ökotop bezeichnet einen echten Ort im realen Raum. Es ist das stoffliche Pendant zum Ökosystem-Begriff, der selbst rein funktional-abstrakt gedacht wird.[27]
Ökotope bilden mit ähnlichen Nachbar-Ökotopen gemeinsame Ökochoren.[28] Ökochoren bilden mit ähnlichen Nachbar-Ökochoren gemeinsame Ökoregionen. Ökoregionen bilden mit ähnlichen Nachbar-Ökoregionen gemeinsame Ökozonen. Der WWF unterscheidet weltweit 825 terrestrische Ökoregionen, die sich auf 14 Haupt-Biome verteilen.[29] Dazu treten 426 Ökoregionen des Süßwassers[30] und 232 Ökoregionen der Meere.[31]

Jedes Lebewesen ist Teil einer Ökoregion. Das gilt auch, selbst wenn zum gegenwärtigen Zeitpunkt noch nicht die Ökoregionen für alle aquatischen und erst recht nicht für die rein mikrobiell besiedelten Bereiche der Biosphäre benannt worden sind. Nach der klassischen Definition formt die Biozönose einer Ökoregion ihr Biom.[33]
- Die irdische Biosphäre umschreibt die Gesamtheit aller Biome des Planeten Erde.[34]
| Fachwort | allgemeine Synonyme * : veraltet |
rein terrestrische Synonyme * : veraltet |
|---|---|---|
| Ökosphäre | Biosphäre,[35] Biogeosphäre / Geobiosphäre[11] | — |
| Ökozone | — | Zonobiom,[36] Hauptbiom,[37] Biomtyp,[38] Vegetationszone[39] |
| Ökoregion | Eu-Biom[40] | — |
| Ökochore | Ökotop-Gefüge[41] | — |
| Ökotop | Biotop[27] | Geoökotop,[42] Tesela[43] |
| Ökosystem | Holozön*,[44] Zön*[23] | Biogeozön* / Biogeozönose*,[45] Geoökosystem[42] |
| Biozönose | Biosystem[46] | — |
| Physiotop | — | Fliese*,[17] Geotop,[47][48] Landschaftszelle*,[48] Parzelle[43] |
| Physiosystem | Standort[49] | Geosystem[49] |
Ähnliche Begriffe
[Bearbeiten | Quelltext bearbeiten]Der Biosphäre-Begriff wird von verschiedenen naturwissenschaftlichen Disziplinen unterschiedlich verstanden. Innerhalb der Biowissenschaften konnte sich zwar der ökologische Biosphäre-Begriff inzwischen weitgehend durchsetzen, der von Wladimir Wernadski erfunden worden war. Das gelang ihm allerdings nicht bei den Geowissenschaften. Sie verwenden bis heute mehrheitlich einen Biosphäre-Begriff, der auf den französischen Jesuiten Pierre Teilhard de Chardin zurückgeht. Teilhard de Chardin verstand unter der Biosphäre ausschließlich die Gesamtheit der irdischen Organismen. Demzufolge prägte er einen rein biotischen Biosphäre-Begriff.
Weiterhin existieren neben dem ökologischen Biosphäre-Begriff eine Reihe ähnlicher Begriffe. Einige sind mit ihm inhaltlich deckungsgleich. Sie heißen Biogeosphäre, Geobiosphäre und Ökosphäre. Während die Ausdrücke Biogeosphäre und Geobiosphäre vergleichsweise selten vorkommen, wird das Wort Ökosphäre häufig verwendet. Tatsächlich wird Ökosphäre von einigen Autoren für geeigneter als Biosphäre gehalten, um den Raum des globalen Ökosystems zu bezeichnen.[50][51]
Darüber hinaus existiert eine weitere Gruppe von Begriffen im Umfeld des ökologischen Biosphäre-Begriffs. Sie sind jedoch inhaltlich mit ihm nicht vollkommen deckungsgleich. Stattdessen gehen sie über ihn hinaus, indem sie weitere Anteile der Erde mit einfassen. Es handelt sich um die Begriffe Gaia, System Erde und Bioplanet Erde.
Der Begriff Virosphäre bezeichnet analog die Gesamtheit aller Räume, in denen Viren (die nicht zu den Lebewesen, d. h. zellulären Organismen klassifiziert werden) vorkommen.

Grüner Rahmen: Biosphäre (Ökosphäre)
Orangefarbener Rahmen: System Erde
Erstreckung
[Bearbeiten | Quelltext bearbeiten]Die hüllenartige Biosphäre beginnt etwa 60 km über der Erdoberfläche und endet ungefähr 5 km unter der Erdoberfläche. Sie fängt an im unteren Saum der Mesosphäre, durchzieht die übrigen, darunter liegenden Schichten der Erdatmosphäre und die oberen Anteile der Hydrosphäre, durchwirkt die Pedosphäre und endet im oberen Abschnitt der Lithosphäre, nach wenigen Kilometern in der Erdkruste. Zumindest wenn auch auf Mikroorganismen geachtet wird, erstreckt sich die Biosphäre über die gesamte Erdoberfläche, die Meere und Meeresgründe.
Vertikale Erstreckung
[Bearbeiten | Quelltext bearbeiten]Gemäß dem derzeitigen Kenntnisstand befindet sich die obere Begrenzung der irdischen Biosphäre leicht oberhalb der Stratopause, in der untersten Mesosphäre bei 60 km Höhe.[52] Dort kommen noch immer bestimmte Mikroorganismen in Dauerstadien vor.[53][54][12] In diesen atmosphärischen Höhen trotzen sie den geringen Temperaturen, die von etwa −50 °C (untere Stratosphäre) bis ungefähr 0 °C (untere Mesosphäre) reichen,[55] sowie dem fast vollständigen Wassermangel[56] und der starken Ultraviolettstrahlung. Gegenwärtig wird davon ausgegangen, dass die gefundenen Mikroorganismen nicht ihren gesamten Lebenszyklus so fern von der Erdoberfläche durchlaufen. Stattdessen sollen sie nur auf verschiedenen Wegen aus der Erdoberflächennähe hinauf gewirbelt werden und dann einige Zeit in der Stratosphäre und untersten Mesosphäre verbleiben.[57]
Unterhalb der Stratosphäre befindet sich die Troposphäre, die dichteste und unterste Erdatmosphärenschicht. Hier besitzt die Luft dank des natürlichen Treibhauseffekts[58] höhere Lufttemperaturen und ist wegen der darüber liegenden, stratosphärischen Ozonschicht[59] verhältnismäßig strahlungsarm. Aus diesen Gründen befinden sich die Lebensräume der terrestrischen Lebewesen in der Troposphäre, temperaturbedingt meistens sogar bloß unterhalb der nivalen Höhenstufe.[60]
Unterhalb der Troposphäre schließen sich einerseits die Böden der Pedosphäre und andererseits die Gewässer der Hydrosphäre an. Die Böden werden von vielfältigen Bodenlebewesen bewohnt. Ihr Lebensraum wird nach unten hin begrenzt durch das Angebot von Bodenwasser und Bodenluft, wobei Mikroorganismen am tiefsten vordringen.[61] Intakte, aber eingefrorene Mikroorganismen finden sich selbst noch tief im Permafrost.[62][63] In den Gewässern existieren Lebensformen bis zum Grund und noch einmal viele Meter in den schlammigen Gewässergrund hinein.[64] Tatsächlich kommt ein größerer Anteil der Gesamtbiomasse der Erde in Form von Archaeen und Bakterien in Ozeansedimenten vor.[65] Die auffälligeren Mitglieder des Wasserlebens halten sich aber in den oberen und lichtdurchfluteten Wasserschichten des Epipelagial auf. Jenseits davon können die Arten- und Individuendichten sehr gering werden. Das gilt insbesondere für die Tiefsee. Ihre kalte Dunkelheit wird allerdings von Vulkaninseln und Atollen unterbrochen, die bis über die Wasseroberfläche aufragen. Unterseeisch bieten Guyots und Seamounts vielen Organismen Lebensräume,[66][67] einige dieser Unterseeberge können bis in das Epipelagial aufragen. Weltweit gesehen kommen Seamounts sehr häufig vor und nehmen insgesamt eine Fläche von der Größe Europas ein.[68] Zusammen genommen formen sie wahrscheinlich eines der größeren Hauptbiome.[69] Je nach Wassertiefe können sich an Vulkaninseln, Atollen, Seamounts und Guyots vielfältige Lebensgemeinschaften einfinden, die auf diese Weise das Wüstenhafte des tiefen Meeres unterbrechen.

Unterhalb der Böden und schlammigen Gewässergründe schließen sich die Gesteine der Lithosphäre an. Hier wurden in Höhlen einfache Höhlen-Ökosysteme gefunden, die aus Mikroorganismen und einigen mehrzelligen Organismen bestehen.[70][71] Alle anderen Lebensgemeinschaften der Lithosphäre bestehen ausschließlich aus Mikroorganismen. Einige leben in Erdöllagerstätten,[72][73][74][75][76] Kohleflözen,[77] Gashydraten,[78] in tiefen Aquiferen[79][80] oder in feinen Poren direkt im Festgestein. Weiterhin kommen zumindest bestimmte mikrobielle Dauerstadien auch in Salzstöcken vor.[81][82] Es kann angenommen werden, dass sich die Biosphäre in der Lithosphäre bis zu jener Tiefe hinab zieht, ab der die Umgebungstemperatur geothermisch über 150 °C steigt. Ab dieser Temperatur sollte es selbst für hyperthermophile Mikroben endgültig zu heiß werden.[83][84] Dabei wird als Faustregel angenommen, dass die Umgebungstemperatur um 3 °C pro 100 Meter Tiefe zunimmt. Demnach müsste die Biosphäre in ungefähr 5 km Lithosphärentiefe enden.[85] Allerdings gibt es von dieser Faustregel starke regionale Abweichungen.[86]
Mikrobielle Ökosysteme können sich auch in subglazialen Seen erhalten, die durch das überlagernde Gletschereis vollständig von der Umgebung abgeschottet wurden.[87] Mikroorganismen werden auch tief im Gletschereis selbst gefunden. Dabei bleibt bisher unklar, inwieweit sie dort nur überdauern oder aktive Lebensprozesse zeigen.[88] Forscher des Deep Carbon Observatory-Teams der Oregon State University schätzten 2018, dass rund 70 Prozent der Gesamtzahl der Bakterien und Archaeen der Erde in der Erdkruste leben.[89][90]
Horizontale Erstreckung
[Bearbeiten | Quelltext bearbeiten]Die Lebewesen verteilen sich nicht gleichmäßig über die Biosphäre. Zum einen gibt es Biome mit großen Arten- und Individuendichten. Dazu zählen zum Beispiel die Tropischen Regenwälder und Korallenriffe. Zum anderen gibt es aber auch Bereiche mit sehr spärlichem makroskopischen und eingeschränktem mikroskopischen Leben. Dazu zählen auf dem Land die Kältewüsten und Trockenwüsten und in den Meeren die Meeresböden der lichtlosen und kalten Tiefsee (Bathyal, Abyssal, Hadal). Allerdings sind innerhalb der wüsten Gebiete inselhafte Stellen höherer Biodiversität eingestreut: Wasseroasen in den Trockenwüsten, postvulkanische Erscheinungen (Thermalquellen, Solfataren, Fumarolen, Mofetten) in den Kältewüsten,[91] sowie Hydrothermalquellen (Black Smokers, White Smokers)[92][93][94] und Methanquellen (Cold Seeps)[95][96] auf den Meeresböden der Tiefsee.
Aufbau
[Bearbeiten | Quelltext bearbeiten]Bloß eine dünne Hülle der Erde ist Raum mit Leben. Gemessen am irdischen Gesamtvolumen besitzt die Biosphäre nur einen winzigen Rauminhalt. Denn irdische Organismen haben bestimmte Ansprüche an ihre abiotische Umwelt. Die meisten Bereiche der Erde können den Ansprüchen nicht genügen.
Die Ansprüche der Lebewesen beginnen beim Platzbedarf. Sie können sich nur an Orten aufhalten, die genügend Raum für ihre Körpergrößen bereitstellen. Wenn genügend Platz vorhanden ist, muss der Ort auch noch geeignete Möglichkeiten des Im-Raum-Aufhaltens bieten. Welche Möglichkeiten geeignet sind, unterscheidet sich von Lebensform zu Lebensform. So benötigen Bäume genügend Wurzelraum und Tang Anheftungsstellen am Meeresgrund, während Phytoplankter schon mit dem freien Wasserkörper auskommen. Die Ansprüche an den Aufenthaltsort können sich saisonal und lebensalterabhängig wandeln.
Beispiel: Erwachsene Königsalbatrosse brauchen einigen Platz für ihre drei Meter breiten Flügel. Sie durchstreifen die niedrigen Luftschichten über dem offenen Ozean. Dort erbeuten sie hauptsächlich Tintenschnecken, trinken Meerwasser, schlafen im Flug oder ruhen schwimmend auf der Meeresoberfläche. Erwachsene Königsalbatrosse benötigen keine feste Ansiedlungsmöglichkeit. Das ändert sich allerdings saisonal. Denn sie fliegen alle zwei Jahre das Festland an. Dort balzen sie, besetzen einen Brutplatz, bebrüten ihr eines Ei 79 Tage lang und beschützen die noch sehr wehrlosen Jungvögel in den ersten fünf Lebenswochen. Danach fliegen die Elternvögel wieder hinaus auf das Meer. Sie kehren jedoch in unregelmäßigen Abständen zum Brutplatz zurück, um die Jungvögel zu füttern. Die Jungvögel müssen an Land ausharren, bis sie nach 236 Tagen flügge werden und den Eltern nachfolgen: Die Ansprüche der Königsalbatrosse an ihren Aufenthaltsort in der Biosphäre wechseln saisonal und mit dem Lebensalter.[97]
Weiterhin müssen sich am Aufenthaltsort die abiotischen Ökofaktoren (Physiosystem, Standort) in Bandbreiten bewegen, die irdischen Lebensformen erträglich sind. Dies gilt in herausragender Weise für die Angebote von thermischer Energie und Flüssigwasser und nachgeordnet für die übrigen abiotischen Ökofaktoren. Darüber hinaus muss der Aufenthaltsort auch die Ernährung der Lebewesen gewährleisten. Autotrophe Organismen müssen ausreichend Baustoffe (Nährsalze) und heterotrophe Organismen ausreichend Nährstoffe vorfinden.
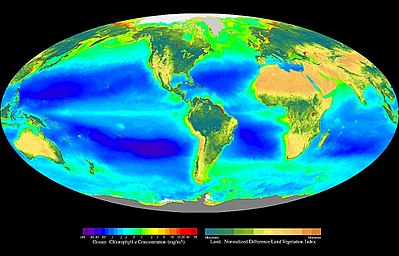
Im Lauf der Erdgeschichte haben die Lebensformen sehr unterschiedliche Körpergrößen, Ansiedlungsmethoden, Physiosystemansprüche und Ernährungsweisen evolviert. Nun herrschen innerhalb der Biosphäre nicht überall die gleichen Bedingungen. Deshalb kommt kein Lebewesen an allen Orten der Biosphäre vor. Lebensformen mit ähnlichen oder sich ergänzenden Angepasstheiten finden sich zusammen am gleichen Aufenthaltsort. Gemeinsam bilden sie Ökoregionen (Eu-Biome) und Ökozonen (Zonobiome).
Die Lage der Ökozonen des Festlands richtet sich nach dem Großklima.[38][98] Das Großklima ist abhängig vom Breitengrad (→ Beleuchtungszonen), von der Entfernung zum Meer (→ Ozeanität / Kontinentalität) und eventuell von hohen Gebirgen, die Niederschläge abhalten (→ Klimascheide). Insgesamt verlaufen die Ökozonen ungefähr breitenkreisparallel.[99]
Die Lage der Ökozonen der Ozeane (realms) richtet sich nach der oberflächennahen Wassertemperatur. Zudem ist zu berücksichtigen, dass für viele Meeresorganismen die Küsten der Kontinente oder die schiere Weite der Ozeane Barrieren darstellen, die sie in ihrer Ausbreitung einschränken. Weltweit werden insgesamt zwölf marine Ökozonen unterschieden. Innerhalb einer marinen Ökozöne befinden sich gleichsam wüstenhafte Ökoregionen neben Ökoregionen großer organismischer Fülle.[31] Das liegt daran, dass nicht überall in den Meeren die gleichen trophischen Bedingungen herrschen: Nur in den Meeresabschnitten mit reichem Baustoffangebot kann Phytoplankton umfangreich gedeihen. Das Phytoplankton steht an der Basis der marinen Nahrungsnetze. Folglich kommen dort auch die übrigen marinen Lebensformen besonders zahlreich vor. Meeresabschnitte mit hohen Baustoffkonzentrationen sind Gebiete des Upwelling, in denen baustoffreiches Tiefenwasser zur Wasseroberfläche aufsteigt.[100] Große Mengen Walkot können einen ähnlichen Effekt erzeugen (whale pump).[101]
Organismischer Aufbau
[Bearbeiten | Quelltext bearbeiten]Der Umfang der Biosphäre wird in erster Linie durch Mikroorganismen bestimmt. An den Außengrenzen der Biosphäre werden ausschließlich Dauerstadien von Mikroben gefunden, die gegen unwirtliche Bedingungen gefeit sind. Das gilt für Mesosphäre und Stratosphäre[52] genauso wie für Permafrostböden,[63][102] Salzstöcke[81] und tiefes Gletschereis.[88] Aber auch innerhalb der biosphärischen Grenzen können viele Ökosysteme gefunden werden, die ausschließlich aus Mikroorganismen bestehen. Dies gilt für alle Lebensgemeinschaften innerhalb der Lithosphäre, also für Lagerstätten von Erdöl,[76] Kohle[77] und Gashydrat[78] genauso wie für tiefe Aquifere,[80] tiefere Meeressedimentschichten[64] und für Ökosysteme im schlichten Festgestein.[85] Die Mikroorganismen halten zudem alle Räume besetzt, die auch von Vielzellern bewohnt werden. Sie leben sogar auf und in diesen Metabionten, auf Haut[103][104] und Rhizosphäre[105] genauso wie auf Blättern[106] und in Verdauungstrakten.[107][108] Die irdische Biosphäre erweist sich überall und gerade in ihren extremeren Bereichen als Sphäre der Mikroorganismen. Im Vergleich dazu erscheint das Habitat der Metabionten sehr eingeschränkt.
Trophischer Aufbau
[Bearbeiten | Quelltext bearbeiten]
Genau genommen besteht die Biosphäre aus vielen Ökosystemen, die mehr oder weniger eng miteinander verzahnt sind. In jedem Ökosystem erfüllen die Lebewesen eine von drei verschiedenen trophischen Funktionen: Primärproduzenten – auch Autotrophe genannt – bauen Biomasse aus energiearmen Baustoffen auf. Diese Biomasse wird daraufhin von Konsumenten gefressen. Während der Produktion und der Konsumation fällt umfangreich Bestandsabfall an. Der Bestandsabfall wird von Organismen der dritten trophischen Funktion, den Destruenten, abgebaut bis zurück zu den energiearmen Baustoffen. Die Baustoffe können anschließend wieder von den Primärproduzenten zum Aufbau neuer Biomasse verwendet werden.
Die Existenz der Konsumenten und Destruenten ist abhängig vom Vorhandensein der Primärproduzenten. Vollständige Ökosysteme können sich nur an Stellen ausbilden, an denen Primärproduzenten geeignete Lebensbedingungen finden. Das gilt letztlich für die gesamte Biosphäre. Ausdehnung und Existenz der gesamten Biosphäre ist raumzeitlich abhängig vom Vorhandensein der Primärproduzenten.
Die auffälligsten und wichtigsten Primärproduzenten der irdischen Biosphäre sind die photoautotrophen Organismen. Sie betreiben Photosynthese, um mit Hilfe von Licht ihre Biomasse aus energiearmen Baustoffen herzustellen. Zu den bekanntesten photoautotrophen Organismen gehören Landpflanzen und Algen (→ phototrophe Organismen), wobei mehr als 99 % der gesamten pflanzlichen Biomasse von Landpflanzen erarbeitet wird.[109] Die photoautotrophe Primärproduktion der Meere wird hauptsächlich durch nicht-kalkbildende Haptophyten und Cyanobakterien geleistet.[110]
Photoautotrophe Organismen stehen an der Basis vieler irdischer Ökosysteme. Die Biosphäre zeigt ihre art- und individuenreichsten Ökosysteme an Standorten, an denen Pflanzen oder andere photoautotrophe Lebensformen existieren können. Auf dem Land an Orten, zu denen Tageslicht gelangt, die aber außerhalb der Kältewüsten, außerhalb der Trockenwüsten und unterhalb der nivalen Höhenstufe liegen. Im Wasser in der euphotischen Zone des Epipelagials.

Jenseits der Bereiche mit Tageslicht können sich langfristig nur dann Lebensgemeinschaften etablieren, wenn sich ihre phototrophen Primärproduzenten allein mit dem spärlichen Glimmen aus vulkanischen Tätigkeiten begnügen[111] – oder wenn sie vollständig unabhängig von photoautotroph erzeugter Biomasse werden. An der Basis solcher völlig lichtunabhängigen Ökosysteme stehen dann chemoautotrophe Primärproduzenten. Chemoautotrophe Organismen bauen ihre Biomasse ebenfalls aus energiearmen Baustoffen. Sie gewinnen die dazu nötige Energie aber nicht aus Licht, sondern aus bestimmten chemischen Reaktionen. Zu den Ökosystemen, die auf chemoautotrophen Primärproduzenten bauen, gehören Hydrothermalquellen (Black Smokers, White Smokers), Methanquellen (Cold Seeps), subglaziale Seen, vollständig von der Außenwelt abgeschottete Höhlen[112][71] und verschiedene mikrobielle Ökosysteme tief im Festgestein (→ Endolithe).[113]
Zur Biosphäre zählen aber auch noch Räume, die nicht unmittelbar zu den photoautotroph oder chemoautotroph unterhaltenen Ökosystemen gehören. Sie liegen stattdessen zwischen und außerhalb von ihnen. Wegen ungünstiger Lebensbedingungen können die Räume nicht von Primärproduzenten besiedelt werden. Diese unwirtlichen Bereiche können allerdings zeitweilig von Konsumenten in Besitz genommen werden, die anschließend wieder in autotroph unterhaltene Ökosysteme zurückkehren.
Beispiel: Viele Zugvögel passieren auf ihren jährlichen Wanderungen Erdräume mit äußerst spärlichem autotrophen Leben. So durchfliegen Weißstörche die Trockenwüste Sahara.[114] Streifengänse überqueren den vegetationsfreien Hauptkamm des Himalaya.[115] Beide Vogelarten wählen ihre Winter- und Brutgebiete jedoch wieder in Lebensräumen, die von Pflanzen besiedelt sind. Sie bleiben also nur vorübergehend außerhalb photoautotroph unterhaltener Ökosysteme.
Dem jährlichen Vogelzug ähnelt die diel vertical migration: Tageszeitenabhängig wandern viele Wasserorganismen zwischen Epipelagial und den darunter liegenden, lichtarmen Wasserschichten hin und her. Einige Vertreter des Phytoplanktons wandern des Nachts abwärts, um sich Baustoffe in den tieferen Wasserschichten anzueignen. Zum Tagesanbruch kehren sie zur Wasseroberfläche zurück.[116][117] Gleichzeitig verläuft eine gegenläufige Bewegung von Zooplankton und einigen größeren Tieren. Sie schwimmen im Schutz der Dunkelheit gen Wasseroberfläche, um dort Beute zu machen, und kehren bei Tagesanbruch in die Tiefe zurück, um selbst vor größeren Beutegreifern sicher zu sein.[118][119]
Außerdem fließt ständig aus den autotroph unterhaltenen Ökosystemen Bestandsabfall ab. Der Bestandsabfall kann von Destruenten auch jenseits der eigentlichen Grenzen jener Ökosysteme noch verwertet werden. Auf diese Weise können Ökosysteme entstehen – und so die Biosphäre ausweiten – die nicht direkt auf anwesenden Primärproduzenten, sondern auf abgeflossenen Bestandsabfällen basieren. Typische Beispiele für solche Ökosysteme sind die Böden, auf die ständig vielfältige Bestandsabfälle terrestrischer Lebewesen fallen. Aber auch Gewässergründe und tiefere Wasserschichten unterhalb der euphotischen Zone gehören dazu, zu denen Bestandsabfall aus dem Epipelagial und von den Ufern herab rieselt.[120] Besonders erwähnenswert sind hierzu die whale falls: Tote Wale sinken hinab auf den Meeresgrund und liefern umfangreiche Mengen an verwertbarem Bestandsabfall für die Tiefseebewohner.[121][122] Die Walkadaver dienen dabei auch als Zwischenstationen für Tiefseeorganismen auf ihren Wanderungen zwischen den chemoautotroph basierten Ökosystemen der weit gestreuten Hydrothermalquellen (Smokers) und Methanquellen (Cold Seeps).[123] Der Abbau von Bestandsabfall im Meer geschieht in niedrigeren Raten selbst noch in den sauerstoffarmen Zonen (oxygen minimum zones) durch entsprechend angepasste Organismen.[124] Neben Böden und lichtfernen Gewässergründen zählen auch viele Höhlen zu den Bestandsabfall-basierten Ökosystemen, soweit sie nicht vollständig von der Außenwelt abgeschottet sind. In die Höhlen wird auf vielfältige Weise Bestandsabfall eingetragen, ein prominentes Beispiel ist Fledermausguano.[125]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- C. Beierkuhnlein: Biogeographie. Stuttgart 2007, ISBN 978-3-8252-8341-4.
- R. J. Huggett: Ecosphere, biosphere or Gaia? What to call the global ecosystem. In: Global Ecology and Biogeography. 8, 1999, S. 425–431. doi:10.1046/j.1365-2699.1999.00158.x [2] (PDF)
- B. Mason, C. B. Moor: Grundzüge der Geochemie. Stuttgart 1985, ISBN 3-8274-1262-5.
- U. Kattmann: Bioplanet Erde. In: Unterricht Biologie. 299, 2004, S. 4–13.
- V. Vernadsky: The Biosphere. Berlin / Heidelberg / New York 1998, ISBN 0-387-98268-X.
- H. Walter, S.-W. Breckle: Ökologie der Erde. Band 1: Grundlagen. Stuttgart 1991, ISBN 3-437-20454-8.
- P. Ward: Gaias böse Schwester. In: Spektrum der Wissenschaft 11, 2009, S. 84–88. (online).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Literatur von und über Biosphäre im Katalog der Deutschen Nationalbibliothek
- Biospheric Theory and Modelling
- Ökosystem Erde
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Raymond Dasmann: Toward a Biosphere Consciousness. In: Donald Worster (Hrsg.): The Ends of the Earth: Perspectives on Modern Environmental History. 2. Auflage. Cambridge University Press, New York 1989, ISBN 0-521-34365-8, S. 277–288, insbesondere 277–279.
- ↑ Sven Titz: Ausrufung des Anthropozäns: Ein gut gemeinter Mahnruf. In: Neue Zürcher Zeitung. 4. November 2016.
- ↑ William J. Ripple, Christopher Wolf, Thomas M. Newsome, Mauro Galetti, Mohammed Alamgir, Eileen Crist, Mahmoud I. Mahmoud, William F. Laurance und 15.364 Biowissenschaftler aus 184 Ländern: World Scientists’ Warning to Humanity: A Second Notice. In: BioScience. Band 67, Nr. 12, 2017, S. 1026–1028, doi:10.1093/biosci/bix125.
- ↑ a b H. Walter, S.-W. Breckle: Ökologie der Erde. Band 1, Stuttgart 1991, S. 1.
- ↑ a b A. Kratochwil, A. Schwabe: Ökologie der Lebensgemeinschaften. Stuttgart 2001, ISBN 3-8252-8199-X, S. 102.
- ↑ В. И. Вернадский: биосфера [Biosfera]. Leningrad 1926.
- ↑ T. Gold: The deep, hot Biosphere. In: PNAS. 89, 1992, S. 6045–6049 Archivierte Kopie ( vom 17. Juni 2012 im Internet Archive) (PDF)
- ↑ H. Walter, S.-W. Breckle: Ökologie der Erde. Band 1, Stuttgart 1991, S. 2.
- ↑ H. K. Walter: Die ökologischen Systeme der Kontinente (Biogeosphäre). Stuttgart 1976, ISBN 3-437-30234-5.
- ↑ S.-W. Breckle: Walter’s vegetation of the earth: the ecological systems of the geo-biosphere. New York 2002, ISBN 3-540-43315-5.
- ↑ a b H. Leser: Landschaftsökologie. Stuttgart 1997, ISBN 3-8252-0521-5, S. 222.
- ↑ a b Y. Yang, T. Itoh, S.-I.Yokobori, H. Shimada, S. Itahashi, K. Satoh, H. Ohba, I. Narumi, A. Yamagishi: Deinococcus aetherius sp. nov., isolated from the stratosphere. In: Int J Syst Evol Microbiol. 60, 2010, S. 776–779. doi:10.1099/ijs.0.010876-0
- ↑ M. J. Daly, E. K. Gaidamakova, V. Y. Matrosova, J. G. Kiang, R. Fukumoto, D.-Y. Lee, N. B. Wehr, G. A. Viteri, B. S. Berlett, R. L. Levine, M. Otto: Small-Molecule Antioxidant Proteome-Shields in Deinococcus radiodurans. In: PLoS. 5 (2010), S. e12570. doi:10.1371/journal.pone.0012570
- ↑ N. A. Campbell, J. B. Reece: Biologie. München 2009, ISBN 978-3-8273-7287-1, S. 1544, 1547/1548.
- ↑ G. A. Zavarzin: Microbial Biosphere. doi:10.1007/978-0-387-68656-1_2 In: N. L. Dobretsov, N. A. Kolchanov, A. Rozanov, G. A. Zavarzin (Hrsg.): Biosphere Origin and Evolution. New York 2008, ISBN 978-0-387-68655-4, S. 25–42.
- ↑ N. A. Campbell, J. B. Reece: Biologie. München 2009, ISBN 978-3-8273-7287-1, S. 1611–1619.
- ↑ a b c H.-J. Klink: Vegetationsgeographie. Braunschweig 1998, ISBN 3-14-160282-4, S. 103.
- ↑ J. Schmithüsen: Allgemeine Vegetationsgeographie. Berlin 1968, ISBN 3-11-006052-3, S. 126.
- ↑ L. Finke: Landschaftsökologie. Braunschweig 1994: 24, ISBN 3-14-160295-6.
- ↑ C. Beierkuhnlein: Biogeographie. Stuttgart 2009, ISBN 978-3-8252-8341-4, S. 389.
- ↑ C. Beierkuhnlein: Biogeographie. Stuttgart 2009, ISBN 978-3-8252-8341-4, S. 211.
- ↑ a b A. Kratochwil, A. Schwabe: Ökologie der Lebensgemeinschaften. Stuttgart 2001, ISBN 3-8252-8199-X, S. 18.
- ↑ a b J. Schmithüsen: Allgemeine Vegetationsgeographie. Berlin 1968, ISBN 3-11-006052-3, S. 128.
- ↑ F. Müller: Ökosystemare Modellvorstellungen und Ökosystemmodelle in der Angewandten Landschaftsökologie. In: R. Schneider-Sliwa, D. Schaub, G. Gerold (Hrsg.): Angewandte Landschaftsökologie. Heidelberg 1999, ISBN 3-540-65938-2, S. 30.
- ↑ M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 696.
- ↑ L. Finke: Landschaftsökologie. Braunschweig 1994, ISBN 3-14-160295-6, S. 24.
- ↑ a b H.-J. Klink: Vegetationsgeographie. Braunschweig 1998, ISBN 3-14-160282-4, S. 105.
- ↑ R. Böcker, H. Sukopp, H.-P. Blume, R. Grenzius, M. Horbert, A. Kirchgeorg, H.-J. Pachur, W. Ripl, A. v Stülpnagel: Ökologische Karten Berlins – Beispiel Tegel und Tegeler See. In: B. Hofmeister, H.-J. Pachur, C. Pape, G. Reindke (Hrsg.): Berlin – Beiträge zur Geographie eines Großstadtraums. Berlin 1986, S. 32.
- ↑ D. M. Olson, E. Dinerstein, E. Wikramanayake, N. Burgess, G. Powell, E. C. Underwood, J. d’Amico, I. Itoua, H. Strand, J. Morrison, C. Loucks, T. Allnutt, T. H. Ricketts, Y. Kura, W. Wettengel, K. Kassem: Terrestrial Ecoregions of the World: A New Map of Life on Earth. In: BioScience. 51, 2001, S. 933–938 doi:10.1641/0006-3568(2001)051[0933:TEOTWA]2.0.CO;2
- ↑ R. Abell, M. L. Thieme, C. Revenga, M. Bryer, M. Kottelat, N. Bogutskaya, B. Coad, N. Mandrak, S. Contreras Balderas, W. Bussing, M. L. J. Stiassny, P. Skelton, G. R. Allen, P. Unmack, A. Naseka, R. Ng, N. Sindorf, J. Robertson, E. Armijo, J. V. Higgins, T. J. Heibel, E. Wikramanayake, D. Olson, H. L. López, R. E. Reis, J. G. Lundberg, M. H. Sabaj Pérez, P. Petry: Freshwater Ecoregions of the World: A New Map of Biogeographic Units for Freshwater Biodiversity Conservation. In: BioScience. 58, 2008, S. 403–414. doi:10.1641/B580507 (pdf)
- ↑ a b M. D. Spalding, H. E. Fox, G. R. Allen, N. Davidson, Z. A. Ferdana, M. Finlayson, B. S. Halpern, M. A. Jorge, A. Lombana, S. A. Lourie, K. D. Martin, E. McManus, J. Molnar, C. A. Recchia, J. Robertson: Marine Ecoregions of the World: A Bioregionalization of Coastal and Shelf Areas. In: BioScience. 57, 2007, S. 573–583. doi:10.1641/B570707 [1] (PDF)
- ↑ A. Kratochwil, A. Schwabe: Ökologie der Lebensgemeinschaften. Stuttgart 2001, ISBN 3-8252-8199-X, S. 440.
- ↑ F. E. Clements: Chaper 2. In: F. E. Clements, V. E. Shelford: Bio-Ecology. New York 1939, S. 20.
- ↑ H. Walter, S.-W. Breckle: Ökologie der Erde. Band 1, Stuttgart 1991, S. 1–2.
- ↑ E. P. Odum: Ökologie. Stuttgart 1999, ISBN 3-13-382303-5, S. 3.
- ↑ D. M. Olson, E. Dinerstein, E. Wikramanayake, N. Burgess, G. Powell, E. C. Underwood, J. d’Amico, I. Itoua, H. Strand, J. Morrison, C. Loucks, T. Allnutt, T. H. Ricketts, Y. Kura, W. Wettengel, K. Kassem: Terrestrial Ecoregions of the World: A New Map of Life on Earth. In: BioScience. 51, 2001, S. 934 doi:10.1641/0006-3568(2001)051[0933:TEOTWA]2.0.CO;2
- ↑ E. P. Odum: Ökologie. Stuttgart 1999, ISBN 3-13-382303-5, S. 424.
- ↑ a b I. Kronberg: Ökologie der Naturräume. In: K. Munk (Hrsg.): Grundstudium Biologie. Biochemie, Zellbiologie, Ökologie, Evolution. Heidelberg / Berlin 2000, ISBN 3-8274-0910-1, S. 17–1.
- ↑ W. Frey, R. Lösch: Lehrbuch der Geobotanik. München 2004, ISBN 3-8274-1193-9, S. 348/349.
- ↑ H. Walter, S.-W. Breckle: Ökologie der Erde. Band 1, Stuttgart 1991, S. 27.
- ↑ H. Leser: Landschaftsökologie. Stuttgart 1997, ISBN 3-8252-0521-5, S. 199.
- ↑ a b H. Leser: Landschaftsökologie. Stuttgart 1997, ISBN 3-8252-0521-5, S. 141.
- ↑ a b W. Frey, R. Lösch: Lehrbuch der Geobotanik. München 2004, ISBN 3-8274-1193-9, S. 60.
- ↑ A. Kratochwil, A. Schwabe: Ökologie der Lebensgemeinschaften. Stuttgart 2001, ISBN 3-8252-8199-X, S. 90.
- ↑ H. Walter, S.-W. Breckle: Ökologie der Erde. Band 1, Stuttgart 1991, S. 28.
- ↑ H. Leser: Landschaftsökologie. Stuttgart 1997, ISBN 3-8252-0521-5, S. 163.
- ↑ H. Leser: Landschaftsökologie. Stuttgart 1997, ISBN 3-8252-0521-5, S. 149.
- ↑ a b A. Kratochwil, A. Schwabe: Ökologie der Lebensgemeinschaften. Stuttgart 2001, ISBN 3-8252-8199-X, S. 94.
- ↑ a b H. Leser: Landschaftsökologie. Stuttgart 1997, ISBN 3-8252-0521-5, S. 148.
- ↑ R. J. Huggett: Ecosphere, biosphere or Gaia? What to call the global ecosystem. In: Global Ecology and Biogeography. 8, 1999, S. 425–431. doi:10.1046/j.1365-2699.1999.00158.xPDF
- ↑ J. T. Trevors, M. H. Saier Jr.: We Live and We Die. In: Water, Air, & Soil Pollution. 205, 2010, S. 57/58. doi:10.1007/s11270-008-9662-7
- ↑ a b A. A. Imshenetsky, S. V. Lysenko, G. A. Kasakov, N. V. Ramkova: Resistance of stratospheric and mesospheric micro-organisms to extreme factors. In: Life Sci Space Res. 15, 1977, S. 37–39. PMID 12596803.
- ↑ D. J. Smith, D. W. Griffin, A. C. Schuerger: Stratospheric microbiology at 20 km over the Pacific Ocean. In: Aerobiologia. 26, 2010, S. 35–46. doi:10.1007/s10453-009-9141-7
- ↑ S. Shivaji, P. Chaturvedi, Z. Begum, P. K. Pindi, R. Manorama, D. A. Padmanaban, Y. S. Shouche, S. Pawar, P. Vaishampayan, C. B. S. Dutt, G. N. Datta, R. K. Manchanda, U. R. Rao, P. M. Bhargava, J. V. Narlikar: Janibacter hoylei sp. nov., Bacillus isronensis sp. nov. and Bacillus aryabhattai sp. nov., isolated from cryotubes used for collecting air from the upper atmosphere. In: International Journal of Systematic and Evolutionary Microbiology. 59, 2009, S. 2977–2986. doi:10.1099/ijs.0.002527-0
- ↑ W. Lauer: Klimatologie. Braunschweig 1995, ISBN 3-14-160284-0, S. 15.
- ↑ W. Lauer: Klimatologie. Braunschweig 1995, ISBN 3-14-160284-0, S. 13, 66.
- ↑ M. Wainwright, S. Alharbi, N. C. Wickramasinghe: How do microorganisms reach the stratosphere? In: International Journal of Astrobiology. 5, 2006, S. 13–15. doi:10.1017/S1473550406002825 (pdf)
- ↑ W. Lauer: Klimatologie. Braunschweig 1995, ISBN 3-14-160284-0, S. 27.
- ↑ W. Lauer: Klimatologie. Braunschweig 1995, ISBN 3-14-160284-0, S. 13.
- ↑ F. Ehrendorfer: Geobotanik. In: Strasburger Lehrbuch der Botanik. Stuttgart / Jena / Lübeck / Ulm 1998, ISBN 3-8274-0779-6, S. 881.
- ↑ M. T. Madigan, J. M. Martinko: Brock Mikrobiologie. München 2006, ISBN 3-8273-7187-2, S. 704.
- ↑ E. Vorobyova, V. Soina, M. Gorlenko, N. Minkovskaya, N. Zalinova, A. Mamukelashvili, D. Gilichinsky, E. Rivkina, T. Vishnivetskaya: The deep cold biosphere: facts and hypothesis. In: FEMS Microbiology Reviews. 20, 2006, S. 277–290.
- ↑ a b D. A. Gilichinsky, G. S. Wilson, E. I. Friedmann, C. P. McKay, R. S. Sletten, E. M. Rivkina, T. A. Vishnivetskaya, L. G. Erokhina, N. E. Ivanushkina, G. A. Kochkina, V. A. Shcherbakova, V. S. Soina, E. V. Spirina, E. A. Vorobyova, D. G. Fyodorov-Davydov, B. Hallet, S. M. Ozerskaya, V. A. Sorokovikov, K. S. Laurinavichyus, A. V. Shatilovich, J. P. Chanton, V. E. Ostroumov, J. M. Tiedje: Microbial populations in Antarctic permafrost: biodiversity, state, age, and implication for astrobiology. In: Astrobiology. 7, 2007, S. 275–311. doi:10.1089/ast.2006.0012
- ↑ a b J. F. Biddle, S. Fitz-Gibbon, S. C. Schuster, J. E. Brenchley, C. H. House: Metagenomic signatures of the Peru Margin subseafloor biosphere show a genetically distinct environment. In: PNAS. 105, 2008, S. 10583–10588. doi:10.1073/pnas.0709942105
- ↑ J. P. Fischer, T. G. Ferdelman: Vierzig Tage in der Wasserwüste. In: Spektrum der Wissenschaft. 03, 2010, S. 16–18. (Artikel)
- ↑ C. R. McClain, L. Lundsten, M. Ream, J. P. Barry, A. DeVogelaere: Endemicity, biogeography, composition, and community structure on a Northeast Pacific Seamount. In: PLOS ONE. 4, 2009, S. e4141. doi:10.1371/journal.pone.0004141
- ↑ L. Lundsten, J. P. Barry, G. M. Cailliet, D. A. Clague, A. DeVogelaere, J. B. Geller: Benthic invertebrate communities on three seamounts off southern and central California. In: Marine Ecology Progress Series. 374, 2009, S. 23–32. doi:10.3354/meps07745
- ↑ P. Wessel, D. T. Sandwell, S. S. Kim: The Global Seamount Census. In: Oceanography. 23, 2010, S. 24–33 (pdf)
- ↑ P. J. Etnoyer, J. Wood, T. C. Shirley: How Large Is the Seamount Biome? In: Oceanography. 23, 2010, S. 206–209 (pdf)
- ↑ F. D. Por: Ophel: a groundwater biome based on chemoautotrophic resources. The global significance of the Ayyalon cave finds, Israel. In: Hydrobiologia. 592, 2007, S. 1–10. doi:10.1007/s10750-007-0795-2
- ↑ a b M. L. Porter, A. S. Engel, T. C. Kane, B. K. Kinkle: Productivity-Diversity Relationships from Chemolithoautotrophically Based Sulfidic Karst Systems. In: International Journal of Speleology. 38, 2009, S. 27–40 (pdf)
- ↑ T. Kato, M. Haruki, T. Imanaka, M. Morikawa, S. Kanaya: Isolation and characterization of psychotrophic bacteria from oil-reservoir water and oil sands. In: Applied Microbiology and Biotechnology. 55, 2001, S. 794–800. PMID 11525631.
- ↑ E. Miranda-Tello, M. L. Fardeau, J. Sepúlveda, L. Fernandez, J. L. Cayol, P. Thomas, B. Ollivier: Garciella nitratireducens gen. nov., sp. nov., an anaerobic, thermophilic, nitrate- and thiosulfate-reducing bacterium isolated from an iolfield separator in the Gulf of Mexico. In: IJSEM. 53, 2003, S. 1509–1514. doi:10.1099/ijs.0.02662-0
- ↑ M. Bonilla, M. L. Fardeau, J. L. Cayol, L. Casalot, B. Patel, P. Thomas, J. L. Garcia, B. Ollivier: Petrobacter succinatimandens gen. nov., sp. nov., a moderately thermophilic, nitrate-reducing bacterium isolated from an Australian oil well. In: IJSEM. 54, 2004, S. 645–649. doi:10.1099/ijs.0.02732-0
- ↑ A. Tabatabaee, Mazaheri Assadi M, A. A. Noohi, V. A. Sajadian: Isolation of Biosurfactant Producing Bacteria from Oil Reservoirs. In: Iranian J Env Health Sci Eng. 2, 2005, S. 6–12. doi:10.1002/abio.370110405
- ↑ a b S. Yuehui, Z. Beiwen, Z. Fan, W. Zhengliang, S. Fuchang, Z. Lingge, X. Tingsheng, Y. Longjiang: Analysis on the Microbial Diversity of Qinghai High Salt Content Oil Reservoirs. In: ICBBE. (2008), S. 780–783. doi:10.1109/ICBBE.2008.190
- ↑ a b J. C. Fry, B. Horsfield, R. Sykes, B. A. Cragg, C. Heywood, G. T. Kim, K. Mangelsdorf, D. C. Mildenhall, J. Rinna, A. Vieth, K. G. Zink, H. Sass, A. J. Weightman, R. J. Parkes: Prokaryotic populations and activities in an interbedded coal deposit, including a previously buried section (1.6 - 2.3 km) above ~150 Ma basement rock. In: Geomicrobiology Journal. 26, 2009, S. 163–178. doi:10.1080/01490450902724832
- ↑ a b B. A. Cragg, R. J. Parkes, J. C. Fry, A. J. Weightman, P. A. Rochelle, J. R. Maxwell: Bacterial populations and processes in sediments containing gas hydrates (ODP Leg 146: Cascadia Margin). In: Earth and Planetary Science Letters. 139, 1996, S. 497–507. doi:10.1016/0012-821X(95)00246-9
- ↑ K. Haraa, T. Kakegawab, K. Yamashiroa, A. Maruyamac, J.-I. Ishibashid, K. Marumoe, T. Urabef, A. Yamagishia: Analysis of the archaeal sub-seafloor community at Suiyo Seamount on the Izu-Bonin Arc. In: Advances in Space Research. 35, 2005, S. 1634–1642. doi:10.1016/j.asr.2005.04.111
- ↑ a b G. J. Olson, W. S. Dockins, G. A. McFeters, W. P. Iverson: Sulfate-reducing and methanogenic bacteria from deep aquifers in montana. In: Geomicrobiology Journal. 2, 1981, S. 327–340. doi:10.1080/01490458109377772
- ↑ a b D. Graur, T. Pupko: The Permian Bacterium that Isn't. In: Molecular Biology and Evolution. 18, 2001, S. 1143–1146 (pdf)
- ↑ B. A. Schubert, T. K. Lowenstein, M. N. Timofeeff, M. A. Parker: How do prokaryotes survive in fluid inclusions in halite for 30 k.y.? In: Geology. 37, 2009, S. 1059–1062. doi:10.1130/G30448A.1
- ↑ M. Kurr, R. Huber, H. Konig, H. W. Jannasch, H. Fricke, A. Trincone, J. K. Kristjansson, Karl O. Stetter: Methanopyrus kandleri, gen. and sp. nov. represents a novel group of hyperthermophilic methanogens, growing at 110 °C. In: Arch. Microbiol. 156, 1991, S. 239–247. doi:10.1007/BF00262992
- ↑ K. Kashefi, D. R. Lovley: Extending the Upper Temperature Limit for Life. In: Science. 301, 2003, S. 934. doi:10.1126/science.1086823
- ↑ a b H. L. Ehrlich, D. K. Newman: Geomicrobiology. Boca Raton 2009, ISBN 978-0-8493-7906-2, S. 50.
- ↑ W. Zeil: Brinkmanns Abriß der Geologie, erster Band: Allgemeine Geologie. Stuttgart 1980, ISBN 3-432-80594-2, S. 217.
- ↑ J. A. Mikucki, A. Pearson, D. T. Johnston, A. V. Turchyn, J. Farquhar, D. P. Schrag, A. D. Anbar, J. C. Priscu, P. A. Lee: A Contemporary Microbially Maintained Subglacial Ferrous „Ocean“. In: Science. 324, 2009, S. 397–400. doi:10.1126/science.1167350
- ↑ a b J. Loveland-Curtze, V. Miteva, J. Brenchley: Novel ultramicrobacterial isolates from a deep Greenland ice core represent a proposed new species, Chryseobacterium greenlandense sp. nov. In: Extremophiles. 14, 2010, S. 61–69. doi:10.1007/s00792-009-0287-6.
- ↑ Life Deep Underground Is Twice the Volume of the Oceans: Study. Abgerufen am 2. April 2019 (englisch).
- ↑ Life Thrives Within the Earth’s Crust. Abgerufen am 2. April 2019 (englisch).
- ↑ M. Bright, C. Arndt, H. Keckeisa, H. Felbeck: A temperature-tolerant interstitial worm with associated epibiotic bacteria from the shallow water fumaroles of Deception Island, Antarctica. In: Deep Sea Research Part II: Topical Studies in Oceanography. 50, 2003, S. 1859–1871. doi:10.1016/S0967-0645(03)00095-X
- ↑ J. Imhoff, M. Hügler: Life at Deep Sea Hydrothermal Vents - Oases Under Water. In: The International Journal of Marine and Coastal Law. 24, 2009, S. 201–208. doi:10.1163/157180809X421789
- ↑ C. M. Santelli, B. N. Orcutt, E. Banning, W. Bach, C. L. Moyer, M. L. Sogin, H. Staudigel, K. J. Edwards: Abundance and diversity of microbial life in ocean crust. In: Nature. 453, 2008, S. 653–656. doi:10.1038/nature06899
- ↑ J. Sander: Artenvielfalt der Biofilme in Lost City. In: Naturwissenschaftliche Rundschau. 4, 2010, S. 202/203.
- ↑ K. Knittel, T. Lösekann, A. Boetius, R. Kort, R. Amann: Diversity and Distribution of Methanotrophic Archaea at Cold Seeps. In: Applied and Environmental Microbiology. 71, 2005, S. 467–479. doi:10.1128/AEM.71.1.467-479.2005
- ↑ L. S. Mullineaux, D. K. Adams, S. W. Mills, S. T. Beaulieu: Larvae from afar colonize deep-sea hydrothermal vents after a catastrophic eruption. In: PNAS. 107, 2010, S. 7829–7834. doi:10.1073/pnas.0913187107
- ↑ J. Warham: Familie Albatrosse. In: B. Grzimek (Hrsg.): Grzimeks Tierleben VII Vögel 1. Zürich 1968, S. 136, 139.
- ↑ C. Körner: Populations- und Vegetationsökologie. In: Strasburger Lehrbuch der Botanik. Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 1087.
- ↑ W. Frey, R. Lösch: Lehrbuch der Geobotanik. München 2004, ISBN 3-8274-1193-9, S. 267/268.
- ↑ H. U. Sverdrup, M. W. Johnson, R. H. Fleming: The Oceans. New York 1942, S. 628,786 (Text)
- ↑ J. Roman, J. J. McCarthy: The Whale Pump: Marine Mammals Enhance Primary Productivity in a Coastal Basin. In: PLoS ONE. 5 (2010), S. e13255. doi:10.1371/journal.pone.0013255 (Volltext)
- ↑ G. Drews: Bakterien in den antarktischen Trockentälern. In: Naturwissenschaftliche Rundschau. 3, 2010, S. 143/144.
- ↑ D. A. Somerville, W. C. Noble: Microcolony Size of Microbes on Human Skin. In: J Med Microbiol. 6, 1973, S. 323–328. doi:10.1099/00222615-6-3-323
- ↑ R. N. Harris, R. M. Brucker, J. B. Walke, M. H. Becker, C. R. Schwantes, D. C. Flaherty, B. A. Lam, D. C. Woodhams, C. J. Briggs, V. T. Vredenburg, K. P. C. Minbiole: Skin microbes on frogs prevent morbidity and mortality caused by a lethal skin fungus. In: ISME Journal. 3, 2009, S. 818–824. doi:10.1038/ismej.2009.27
- ↑ J. A. W. Morgan, G. D. Bending, P. J. White: Biological costs and benefits to plant–microbe interactions in the rhizosphere. In: Journal of Experimental Botany. 56, 2005, S. 1729–1739. doi:10.1093/jxb/eri205
- ↑ S. E. Lindow, M. T. Brandl: Microbiology of the Phyllosphere. In: Applied and Environmental Microbiology. 69, 2003, S. 1875–1883. doi:10.1128/AEM.69.4.1875-1883.2003
- ↑ G. L. Simon, S. L. Gorbach: Intestinal flora in health and disease. In: Gastroenterology. 86, 1984, S. 174–193. PMID 6357937.
- ↑ F. Guarner: Gut flora in health and disease. In: The Lancet. 361, 2003, S. 512–519. doi:10.1016/S0140-6736(03)12489-0
- ↑ U. Sonnewald: Physiologie. In: Strasburger Lehrbuch der Botanik. Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 274.
- ↑ H. Liua, I. Proberta, J. Uitzc, H. Claustred, S. Aris-Brosoue, M. Fradab, F. Nota, C. de Vargasa: Extreme diversity in noncalcifying haptophytes explains a major pigment paradox in open oceans. In: PNAS. 106, 2009, S. 12803–12808. doi:10.1073/pnas.0905841106
- ↑ J. T. Beatty, J. Overmann, M. T. Lince, A. K. Manske, A. S. Lang, R. E. Blankenship, C. L. Van Dover, T. A. Martinson, F. G. Plumley: An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent. In: PNAS. 102, 2005, S. 9306–9310. doi:10.1073/pnas.0503674102 (pdf)
- ↑ F. D. Por: Ophel: a groundwater biome based on chemoautotrophic resources. The global significance of the Ayyalon cave finds, Israel. In: Hydrobiologia. 592, 2007, S. 1–10. doi:10.1007/s10750-007-0795-2
- ↑ W. S. Fyfe: The Biosphere Is Going Deep. In: Science. 273, 1996, S. 448–450. doi:10.1126/science.273.5274.448
- ↑ B. Grzimek, E. Schüz: Der Weißstorch. In: B. Grzimek (Hrsg.): Grzimeks Tierleben VII Vögel 1. Zürich 1968, S. 211.
- ↑ H. G. Klös, K. Klös: Die übrigen Gänse. In: B. Grzimek (Hrsg.): Grzimeks Tierleben VII Vögel 1. Zürich 1968, S. 287.
- ↑ J. J. Cullen: Diel vertical migration by dinoflagellates: roles of carbohydrate metabolism and behavioral flexibility. In: Contr. Mar. Sci. 27, 1985, S. 135–152 (pdf)
- ↑ E. P. Odum: Ökologie. Stuttgart 1999, ISBN 3-13-382303-5, S. 185.
- ↑ W. Lampert: The adaptive significance of diel vertical migration of zooplankton. In: Functional Ecology. 3, 1989, S. 21–27. doi:10.2307/2389671
- ↑ M. D. Scheuerell, D. E. Schindler: Diel vertical migration by juvenile sockeye salmon: Empirical evidence for the antipredation window. In: Ecology. 84, 2003, S. 1713–1720 doi:10.1890/0012-9658(2003)084[1713:DVMBJS]2.0.CO;2
- ↑ M. M. Yakimov, V. La Cono, R. Denaro, D'Auria G, F. Decembrini, K. N. Timmis, P. N. Golyshin, L. Giuliano: Primary producing prokaryotic communities of brine, interface and seawater above the halocline of deep anoxic lake L'Atalante, Eastern Mediterranean Sea. In: ISME J. 1, 2007, S. 743–755. doi:10.1038/ismej.2007.83
- ↑ C. A. Butman, J. T. Carlton, S. R. Palumbi: Whaling effects on deep-sea biodiversity. In: Conservation Biology. 9, 1995, S. 462–464. doi:10.1046/j.1523-1739.1995.9020462.x
- ↑ C. R. Smith, A. R. Baco: Ecology of whale falls at the deep-sea floor. In: Oceanography and Marine Biology Annual Review. 41, 2003, S. 311–354 (pdf)
- ↑ C. T. S. Little: Oasen der Tiefsee. In: Spektrum der Wissenschaft. 03, 2011, S. 74–79 (link)
- ↑ A. J. Gooday, B. J. Bett, E. Escobar, B. Ingole, L. A. Levin, C. Neira, A. V. Raman, J. Sellanes: Habitat heterogeneity and its influence on benthic biodiversity in oxygen minimum zones. In: Marine Ecology. 31, 2010, S. 125–147. doi:10.1111/j.1439-0485.2009.00348.x
- ↑ S. Negrea, V. Boitan: An ecological and biogeographycal overwiew of the terrestrial and aquatic subterranean environments from Romania. In: Travaux du Muskum National d'Histoire Naturelle. 43, 2001, S. 396–397, 401.