Estrogenrezeptor
| Estrogen-Rezeptor, α-Untereinheit | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 595 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, Heterodimer | |
| Isoformen | Long, Short | |
| Bezeichner | ||
| Gen-Name | ESR1 | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | mehrzellige Tiere | |
| Estrogen-Rezeptor, β-Untereinheit | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 530 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, Heterodimer | |
| Isoformen | 8 | |
| Bezeichner | ||
| Gen-Name | ESR2 | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Säugetiere | |
Estrogenrezeptoren (ER), auch Östrogenrezeptoren, sind Steroidrezeptoren, die zur Superfamilie der nukleären Rezeptoren NR3I (nuclear receptor subfamily 3, group I) zählen und durch das Steroidhormon Estrogen aktiviert werden.[1] Die wichtigste Funktion des Estrogenrezeptor ist ein DNA-bindender Transkriptionsfaktor, der die Genexpression des Zielgens reguliert. Der Estrogenrezeptor hat jedoch noch zusätzliche Funktionen unabhängig von der DNA-Bindung.[2]
Struktur und Bindung
[Bearbeiten | Quelltext bearbeiten]Zwei humane Rezeptorsubtypen konnten identifiziert werden, die beide die gleiche Grundstruktur besitzen:
- Estrogenrezeptor-α (ERα, NR3A1)
- Estrogenrezeptor-β (ERβ, NR3A2)
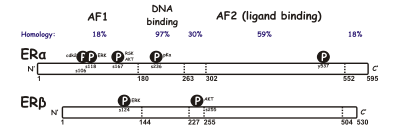
Beide Rezeptoren besitzen sechs Domänen (A–F):
- A/B-Domäne: Enthält eine ligandenunabhängige transkriptionelle Aktivierungsfunktion (AF-1).
- C-Domäne: DNA-Bindungsdomäne (DBD). Sie enthält zwei Zinkfingermotive.
- D-Domäne: Dimerisierungsregion.
- E/F-Domäne: Enthält die Ligandenbindungsdomäne (LBD) und eine sogenannte Transaktivierungsregion am C-Terminus (AF-2).
Da beide Subtypen in vielen Zellen gleichzeitig exprimiert werden, kommt es bei der hormonaktivierten Rezeptordimerisierung zur Bildung von ERα (αα) bzw. ERβ (ββ) Homodimeren oder ERαβ (αβ) Heterodimeren.
Unterschiedliche Liganden können sich in ihrer Affinität hinsichtlich der beiden Rezeptorisoformen unterscheiden:[3]
- Estradiol und Coumestrol bindet an beide Rezeptoren
- Estron und Raloxifen binden vorzugsweise an ERα
- Estriol und Genistein binden an ERβ
Selektive Estrogenrezeptormodulatoren binden vorzugsweise entweder an den α- oder β-Subtyp des Rezeptors.
Die Überlebensrate von Brustkrebspatientinnen korreliert stärker mit den Ergebnissen der immunhistochemischen Färbung des Estrogenrezeptors als mit dem Nachweis der mRNA des Estrogenrezeptors.[4] Patientengruppen mit Tumoren, die den Estrogenrezeptor β, aber nicht den Estrogenrezeptor α aufweisen, haben größere Überlebensraten.[4]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Jennifer McDowall/Interpro: Protein Of The Month: Oestrogen receptors. (engl.)
- Eintrag zu Östrogen-Resistenz-Syndrom. In: Orphanet (Datenbank für seltene Krankheiten)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dahlman-Wright, K. et al. (2006): International Union of Pharmacology. LXIV. Estrogen receptors. In: Pharmacol Rev. 58(4):773-781. PMID 17132854 PDF
- ↑ Levin, E.R. (2005): Integration of the extranuclear and nuclear actions of estrogen. In: Mol Endocrinol. 19(8):1951-1959. PMID 15705661 doi:10.1210/me.2004-0390
- ↑ Morito K, Aomori T, Hirose T, et al: Interaction of phytoestrogens with estrogen receptors alpha and beta (II). In: Biol Pharm Bull. 25. Jahrgang, Nr. 1, Januar 2002, S. 48–52, doi:10.1248/bpb.25.48, PMID 11824555 (englisch).
- ↑ a b W. Tan, Q. Li, K. Chen, F. Su, E. Song, C. Gong: Estrogen receptor beta as a prognostic factor in breast cancer patients: A systematic review and meta-analysis. In: Oncotarget. [elektronische Veröffentlichung vor dem Druck] Februar 2016, doi:10.18632/oncotarget.7219, PMID 26863572.