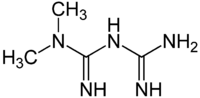
Metformin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Metformin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H11N5 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 129,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Metformin ist ein Arzneistoff aus der Gruppe der Biguanide, der in der Regel bei nicht insulinabhängiger Zuckerkrankheit (Diabetes mellitus Typ 2) und insbesondere bei leichtem Übergewicht (Präadipositas) und krankhaftem Übergewicht (Adipositas) eingesetzt wird. Es ist das am längsten und am häufigsten verabreichte orale Antidiabetikum.[3] Studien zufolge verringert es das Auftreten von kardiovaskulären Ereignissen bei Typ-2-Diabetes.[4]
Wirkprinzip
[Bearbeiten | Quelltext bearbeiten]Metformin gehört chemisch zu den Biguaniden. Ihr Wirkprinzip ist nach wie vor nicht vollständig geklärt. Die Wirkung von Metformin beruht vermutlich auf drei Mechanismen: So hemmt es zum einen die Glucose-Neubildung (Gluconeogenese) in der Leber.[5] Experimentelle Studien ergaben, dass Metformin die mitochondriale Glycerin-3-phosphat-Dehydrogenase hemmt. In Folge stehen im Cytosol weniger Metabolite für die Glucose-Neubildung zur Verfügung (siehe auch Glycerin-3-phosphat-Shuttle), und es fällt vermehrt Laktat an. Die seltene Nebenwirkung der Laktatazidose bei Überdosierung kann damit erklärt werden.[6] Neben der Aufnahme von Zucker (Glucose) mit der Nahrung stellt dieser Stoffwechselweg, mit dem Glucose aus dem Umbau von Aminosäuren und anderen Stoffwechselprodukten gewonnen wird, eine wichtige Einflussgröße des Blutzuckerspiegels dar. Daneben soll Metformin die Resorption von Glucose im Darm hemmen und ferner die Insulinresistenz verringern, wodurch die Aufnahme in die Muskelzellen verbessert wird.[5] Jedoch sind beide Effekte bislang nicht sicher nachgewiesen.[7]
Ferner ist bekannt, dass der Komplex I der Atmungskette ebenfalls einen Angriffspunkt von Metformin darstellt.[8] Der Mechanismus beruht darauf, dass aufgrund des durch die Mitochondrien aufgebauten elektrischen Membranpotentials es für die positivgeladenen Ionen (wie Metformin beim physiologischen pH-Wert) leicht ist, im Mitochondrium zu akkumulieren. Der IC50-Wert für Metformin in HepG2-Zellen beträgt 330 µM.[9] Durch neueste EM-Studien wird vermutet, dass der primäre inhibitorische Wirkort des Metformins am Ubichinon-Bindungskanal des Komplex I liegt, während eine weitere Bindestelle sich an der ND5-Untereinheit befindet.[10] Durch die inhibitorische Wirkung von Metformin am Komplex I kann auch die antidiabetische Wirkung und der durch Metformin ausgelöste moderate Gewichtsverlust erklärt werden.[11]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Diabetes
[Bearbeiten | Quelltext bearbeiten]Metformin ist angezeigt bei Patienten, bei denen durch Diät und körperliche Bewegung keine ausreichende Einstellung des Blutzuckerspiegels erreicht werden kann.[12] Metformin soll entsprechend der Nationalen Versorgungsleitlinie zum Typ-2-Diabetes (Stand 2021) als Mittel der ersten Wahl eingesetzt werden – abhängig von individuellen Risikofaktoren entweder als Monotherapie oder in Kombination mit einem SGLT-2-Hemmer (SGLT2i) oder einem GLP-1-Rezeptoragonisten (GLP-1-RA). Sofern damit das individuelle Therapieziel des jeweiligen Patienten innerhalb von 3 bis 6 Monaten nicht erreicht wird, soll ein zusätzliches oder ggf. alternatives Medikament eingesetzt werden. Infrage kommen hierzu neben den bereits genannten SGLT2i und GLP-1-RA auch Sulfonylharnstoffe, Dipeptidyl-Peptidase-4-Inhibitoren (DPP4-Hemmer) sowie Insulin.[13]
Metformin steht in Wirkstärken von 500 mg, 850 mg und 1000 mg für die orale Gabe zur Verfügung, um eine individuelle Blutzuckereinstellung vornehmen zu können. Die Tabletten werden zu oder nach den Mahlzeiten verabreicht. Nach einer Initialphase von circa 14 Tagen, in der man niedrig beziehungsweise mittelstark dosiert einsteigt, ist meist eine Dosisanpassung anhand der Blutglucosespiegel notwendig. Bei eingeschränkter Nierenfunktion ist eine Reduktion der Dosis erforderlich. Metformin hat positive und protektive Eigenschaften bei Lebererkrankungen. Es sollte aber, da die hepatische Laktatelimination eingeschränkt sein kann, bei fortgeschrittener Leberzirrhose oder Alkoholintoxikation nicht mehr eingesetzt werden.[14]
Zur Erhöhung der Therapietreue der Patienten (Compliance) und zur Verringerung der Anzahl der einzunehmenden Tabletten kann Metformin mit einem Insulin-Sensitizer wie Pioglitazon, einem DPP4-Hemmer wie Vildagliptin oder einem SGLT-2-Hemmer wie Dapagliflozin kombiniert werden; entsprechende fixe Kombinationen gibt es im Handel.
Polyzystisches Ovar-Syndrom (Off-Label)
[Bearbeiten | Quelltext bearbeiten]Metformin wird seit Jahren außerhalb der zugelassenen Anwendungsgebiete (d. h. im Off-Label-Use) bei der Behandlung des Polyzystischen Ovarialsyndroms (PCOS) verwendet und durch internationale Leitlinien empfohlen, insbesondere bei übergewichtigen Patientinnen.[15] Tierversuche deuten darauf hin, dass Metformin die beim PCOS oft krankhaft gesteigerte Produktion des männlichen Geschlechtshormons Testosteron blockiert.[16] Es soll am Polyzystischen Ovarialsyndrom erkrankten Frauen eine Möglichkeit eröffnen, dennoch schwanger zu werden. In diesem Fall werden die Kosten nicht durch die gesetzlichen Krankenversicherung übernommen.
Weitere Verwendungen
[Bearbeiten | Quelltext bearbeiten]Kraftsport
[Bearbeiten | Quelltext bearbeiten]Im Umfeld der Bodybuilding-Szene wird Metformin zum Fettabbau verwendet.[17][18][19][20]
Übergewicht
[Bearbeiten | Quelltext bearbeiten]Aufgrund der günstigen Wirkung auf das Körpergewicht bei Erwachsenen wurde versucht, Metformin auch bei übergewichtigen Kindern einzusetzen – jedoch ohne den gewünschten Effekt.[21]
Vorbeugung vor verschiedenen Erkrankungen
[Bearbeiten | Quelltext bearbeiten]In mehreren Studien wurde untersucht, ob Metformin das Krebsrisiko bei Typ-2-Diabetikern verringern kann. Anlass hierfür war ein wachstumshemmender Effekt Metformins in Tierstudien mit Würmern: Als Signalmolekül soll es das Zellwachstum stoppen, wodurch unkontrolliertes Zellwachstum verhindert wird. Die Ergebnisse in Humanstudien sind aber widersprüchlich und wenig aussagekräftig.[22] So ist beispielsweise nicht klar, ob die erfolgreiche Behandlung gegen Diabetes selbst nicht das Krebsrisiko senkt. Für einen protektiven Effekt bei Gesunden fehlen Studien.
Die US-Arzneimittelbehörde FDA genehmigte im Herbst 2015 eine Studie mit 3.000 Probanden. An der im Jahr 2019 beginnenden Studie[23] sollten Personen zwischen 70 und 80 Jahren teilnehmen, die an Krebs, Herz-Kreislauf-Erkrankungen oder Kognitionsstörungen (z. B. Demenz) litten bzw. ein erhöhtes Risiko dafür hatten. Es sollte untersucht werden, ob die Lebenserwartung der Probanden durch Metformin verlängert werden kann und ob der Verlauf bereits bestehender Erkrankungen positiv beeinflusst wurde. Die Entscheidung der FDA erregte besondere Aufmerksamkeit, da sie zum ersten Mal eine Studie genehmigt, deren Ziel nicht unmittelbar die Verhinderung, Behandlung oder Heilung einer Erkrankung ist, sondern die Verlangsamung des Alterungsprozesses.[24]
Laut einer 2019 veröffentlichten Studie mit Tierversuchen kann Metformin in Mäusen Hirnschäden nach einem Schlaganfall teilweise reparieren, allerdings nur in weiblichen Mäusen: Estrogen förderte diese Wirkung, Testosteron aber hemmte sie.[25]
Gegenanzeigen und Anwendungsbeschränkungen
[Bearbeiten | Quelltext bearbeiten]Bei einer diabetischen Ketoazidose[26] oder dem diabetischen Koma ist Metformin kontraindiziert.
Metformin darf außerdem nicht bei schwerer Niereninsuffizienz, Leberinsuffizienz, Alkoholismus oder solchen Begleitumständen eingesetzt werden, die eine Übersäuerung durch Milchsäure begünstigen können.[26] Hierzu zählt die instabile Herzinsuffizienz oder etwa ein Fasten. Herzinfarkt, Schock oder schwere Infektionen verbieten seine Anwendung. Der Verdacht, dass Patienten mit Lungenemphysem oder COPD III erhöhtes Risiko für die metformininduzierte Laktatazidose tragen, wurde durch einen Cochrane-Report ausgeräumt.[27]
Hinweise auf eine fruchtschädigende (teratogene) Wirkung konnten bisher (Stand 2015) in allen Studien nicht gefunden werden. Auch in Tierversuchen konnte keine schädliche Wirkung auf die vorgeburtliche Entwicklung festgestellt werden. Bei Patientinnen, die schwanger sind oder werden möchten, wird dennoch empfohlen, den Diabetes vorsichtshalber nicht mit Metformin zu behandeln, sondern eine Normalisierung des Blutzuckerspiegels mit Insulin herbeizuführen.[28] Metformin ist plazentagängig und geht in die Muttermilch über. Es sollte während der Schwangerschaft und bei stillenden Müttern nur in begründeten Fällen in Form eines sogenannten Therapieversuches eingesetzt werden, z. B. wenn die notwendigen Insulindosierungen sehr hoch sind.
Vor Operationen, Anästhesien, Untersuchungen mit intravaskulärer Verabreichung (über das Blut) von Kontrastmitteln oder intensivmedizinischer Betreuung soll Metformin 24 bis 48 Stunden[29] vor dem Ereignis aufgrund des Risikos einer Übersäuerung (Azidose) des Blutes (Laktatazidose) abgesetzt werden.
Kortison bzw. Glukokortikoide, Asthma-Medikamente und Entwässerungsmittel können Wechselwirkungen verursachen. Dadurch wird die blutzuckersenkende Wirkung verringert. Bei der Einnahme von Herz-Kreislauf-Medikamenten, die der ACE-Hemmer-Gruppe zugehörig sind, kann es zu einer unerwünschten, verstärkten Senkung des Blutzuckerspiegels kommen.
Während der Stillzeit darf Metformin nicht eingenommen werden.[30]
Das Risiko einer Laktatazidose wird durch die gleichzeitige Einnahme von Metformin und einer größeren Menge Alkohol erhöht. Bei alkoholabhängigen Patienten ist Metformin daher kontraindiziert. Bei Metformin ist das Risiko für eine Laktatazidose allerdings wesentlich geringer als bei Phenformin, welches aufgrund dieses Risikos in Deutschland nicht mehr im Handel ist.[31] Daher gilt für Patienten, die Metformin einnehmen, eine gelegentliche moderate Alkoholaufnahme mit einer kohlenhydrathaltigen Mahlzeit verbunden als unbedenklich. Dies bedeutet, dass Frauen ein Glas Wein, Sekt (etwa 100 ml) oder Bier (etwa 250 ml) und Männer entsprechend das Doppelte (Frauen bis 10 g Alkohol/Tag, Männer bis 20 g Alkohol/Tag) zu einer Mahlzeit konsumieren können. Kohlenhydratreiche alkoholische Getränke sollten dabei vermieden werden.[32]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Als Nebenwirkung treten häufig und meist nur zu Behandlungsbeginn gastrointestinale Beschwerden auf wie Durchfall, Übelkeit und Erbrechen, die durch langsame, einschleichende Dosierung über 2–3 Wochen oft umgangen werden können.
Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) berichtet im März 2013 über die „Zunahme von Spontanberichten über Metformin-assoziierte Laktatazidosen“ („Aus der UAW-Datenbank“).[33]
Bei Infektionen mit massivem Erbrechen und anhaltendem, schwerem Durchfall ist Metformin aufgrund der Gefahr einer Übersäuerung des Organismus abzusetzen. Vor allem bei niereninsuffizienten Patienten und im Zusammenhang mit Narkosen können lebensbedrohliche Laktatazidosen auftreten. Metformin sollte daher 48 Stunden vor und nach operativen Eingriffen abgesetzt werden.[34]
Eine Unterzuckerung (Hypoglykämie) tritt unter der alleinigen Therapie mit Metformin nicht auf, kann jedoch nach Alkoholexzess vorkommen, da Alkohol selbst den Blutzuckerspiegel senkt.[35]
Ein Vitamin-B12-Mangel tritt häufig als Nebenwirkung von Metformin auf, insbesondere bei langfristiger Einnahme, hoher Dosierung oder weiteren Risikofaktoren (u. a. höheres Alter, vegetarische/vegane Ernährung, Einnahme von Protonenpumpenhemmern oder chronisch-entzündliche Darmerkrankungen wie Morbus Crohn). Mögliche Symptome eines Vitamin-B12-Mangels sind Anämie oder Polyneuropathie, die sich im Fall der Anämie u. a. durch starke Erschöpfung und blasse oder gelbliche Haut sowie im Fall der Polyneuropathie u. a. durch Missempfindungen wie Kribbeln oder Taubheitsgefühl an Händen und Füßen äußern können. Diese Symptome eines Vitamin-B12-Mangels können fälschlich als Diabetes- oder altersbedingt gedeutet werden. Daher empfiehlt die AkdÄ, bei Verdacht auf einen Mangel den Vitamin-B12-Spiegel im Blut zu untersuchen. Bei Risikofaktoren für einen Mangel könnte eine regelmäßige Überwachung der Patienten erforderlich sein. Ein Vitamin-B12-Mangel kann u. a. durch Supplementierung behandelt werden, wobei die Behandlung mit Metformin gleichzeitig fortgesetzt werden kann.[36][37]
Anhand von Daten aus landesweiten dänischen Registern, die mehr als 1,1 Millionen Neugeborene einschließen, stellten Forschende einen Zusammenhang zwischen der väterlichen Einnahme von Metformin vor der Zeugung und einer erhöhten Wahrscheinlichkeit von Fehlbildungen bei Kindern fest. Es ist noch nicht absehbar, welchen Einfluss die Daten auf die weitere Behandlung von Männern mit Diabetes und Kinderwunsch haben.[38]
Analytik
[Bearbeiten | Quelltext bearbeiten]Zur zuverlässigen qualitativen und quantitativen Bestimmung von Metformin kommt nach angemessener Probenvorbereitung die Kopplung der HPLC mit der Massenspektrometrie zum Einsatz. Das gilt für die Analytik von Serum oder Plasmaproben.[39][40] Diese Methodik eignet sich ebenfalls zur sicheren Bestimmung von Metformin in Abwasserproben.[41] Bei rechtsmedizinischen Fragestellungen im Falle einer Laktazidose wurde diese analytische Vorgehensweise ebenfalls erfolgreich eingesetzt.[42]
Umweltaspekte
[Bearbeiten | Quelltext bearbeiten]Metformin und sein Haupttransformationsprodukt Guanylharnstoff wurden regelmäßig in Klärwerkabflüssen und Oberflächengewässern nachgewiesen. Dabei wurde Guanylharnstoff in Konzentrationen über 200 Mikrogramm pro Liter im Fluss Erpe bei Berlin gemessen. Diese Werte liegen im Bereich der höchsten Nachweiskonzentrationen von Arzneimittel-Transformationsprodukten in der aquatischen Umwelt.[43] Beide Stoffe sind persistent. Bei ökotoxokologischen Tests konnte ein negativer Einfluss von Metformin auf Lemna minor, Daphnia Similis und Danio rerio nachgewiesen werden. Ebenso zeigte Metformin signifikante endokrine Effekte bei männlichen Danio rerio in Richtung Feminisierung bei Konzentrationen, die bereits in deutschen Flüssen gefunden wurden. Auch hinsichtlich des Gesundheitlichen Orientierungswertes (GOW im Trinkwasser = 1,0 μg/L) wurde dieser in den Oberflächenwässern bereits oft überschritten.[44] Der Rhein bei Basel trägt über ein ganzes Jahr betrachtet rund 13 Tonnen des Antidiabetikums in Richtung Nordsee.[45]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate
Biocos (D), Diabesin (D), Diabetase (D), Diabetex (A), Espa formin (D), Glucobon Biomo (D), Glucophage (D, A, CH), Juformin (D), Mediabet (D), Meglucon (A), Mescorit (D), Met (D), Metfin (CH), Metfogamma (D), Metformin-CT (D), Siofor (D) und andere
Kombinationspräparate
Avandamet (D, A, CH), Competact (D, A, CH), Efficib (A), Eucreas (D, A), Janumet (D, A, CH), Komboglyze (D), Pioglitazone/Metforminhydrochloride (A), Synjardy (EU), Velmetia (D, A), Vildagliptin/Metformin hydrochlorid (A), Xigduo (D), Zomarist (A)
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die heilende Wirkung der Geißraute (Galega officinalis), die das Alkaloid Galegin (Isoamylenguanidin, ein Abkömmling[46] der starken Base Guanidin) enthält, war schon länger bekannt. Seit dem Mittelalter wurde Geißraute unter anderem bei Diabetes bzw. dessen Symptomen verwendet (J. Hill, 1777). Die blutzuckersenkende Wirkung von Guanidin wurde 1918 durch C. K. Watanabe gezeigt. Jedoch ist Guanidin zu toxisch, um als Heilmittel verwendet zu werden. 1879 synthetisierte Bernhard Rathke das Biguanid, die Leitstruktur der Biguanide, 1922[47] erfolgte in Dublin die Synthese von Metformin durch E. A. Werner und J. Bell. Die blutzuckersenkende Wirkung von Metformin und anderen Biguaniden wurde 1929 gezeigt (G. Hesse und G. Taubmann, Karl Slotta und R. Tschesche). Die Verwendung der anderen Biguanide bei Diabetes wurde aber in den 1920er und 1930er Jahren wegen ihrer Toxizität und wegen des Aufkommens von Insulin aufgegeben. Erst 1957 wurde durch den französischen Arzt Jean Sterne (1909–1997), damals an den Aron Laboratories in Suresnes westlich Paris, die blutzuckersenkende Wirkung von Metformin (damals Glucophage genannt, für Glucose-Esser) neu entdeckt.[48] Damals untersuchte er mit der Pharmakologin Denise Duval mehrere Guanidin-basierte Substanzen an Tieren und fand Metformin besonders vielversprechend, was er in klinischen Studien testete. Zunächst wurden aber in der Therapie andere Biguanide bevorzugt, insbesondere Phenformin (besonders in den USA, vermarktet von Ciba-Geigy) und Buformin (besonders in Deutschland). Sie waren potenter als Metformin, wurden aber schließlich wegen höheren Risikos der Laktatazidose in den 1970er Jahren aufgegeben. Metformin, das zunächst nur eine untergeordnete Rolle spielte, wurde 1958 in Großbritannien und Frankreich und 1972 in Kanada zugelassen (Ende der 1960er Jahre war es in über 40 Ländern zugelassen, mit Ausnahme von Nordamerika und Osteuropa)[49] und erhielt 1994 eine FDA-Zulassung in den USA, so dass es 1995 in den USA auf den Markt kam (durch Bristol Myers Squibb). Trotz deutlichen Unterschieden litt die Verbreitung am Misstrauen gegen die anderen Biguanide. 1998 wurde eine positive kardiovaskuläre Langzeitwirkung von Metformin in der UK Prospective Diabetes Study (UKPDS) festgestellt.[50]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Clifford J. Bailey: Metformin: historical overview. In: Diabetologia. 2017, Nr. 60, S. 1566–1576, doi:10.1007/s00125-017-4318-z.
- Clifford J. Bailey, I. W. Campbell, J. C. N. Chan u. a. (Hrsg.): Metformin, the Gold Standard. A Scientific Handbook. Erstausgabe, John Wiley & Sons, Chichester (UK) 2007, ISBN 978-0-470-72541-2.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Metformin. In: The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 0-911910-00-X, S. 1025.
- ↑ a b Datenblatt Metformin hydrochloride bei Sigma-Aldrich, abgerufen am 5. November 2016 (PDF).
- ↑ S. Naveed, A. Shafiq u. a.: Degradation Study of Available Brands of Metformin in Karachi Using UV Spectrophotometer. In: Journal of Diabetes and Metabolism. Nr. 5, 2014, S. 328, doi:10.4172/2155-6156.1000328.
- ↑ Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. In: The Lancet. Band 352. Jahrgang, Nr. 9131, 1998, S. 854–865, PMID 9742977.
- ↑ a b H. Mehnert: Diabetologie in Klinik und Praxis. 5. Auflage. Georg Thieme Verlag, 2003, ISBN 3-13-512805-9, S. 219 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ele Ferrannini: The Target of Metformin in Type 2 Diabetes. In: New England Journal of Medicine. 2014, Band 371, S. 1547–1548. doi:10.1056/NEJMcibr1409796
Madiraju et al. Metformin suppresses gluconeogenesis by inhibiting mitochondrial glycerophosphate dehydrogenase. Nature 2014;510:542–546. doi:10.1038/nature13270 - ↑ A. Natali, E. Ferrannini: Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes: a systematic review. In: Diabetologia. Band 49, Nr. 3, März 2006, S. 434–441, doi:10.1007/s00125-006-0141-7. PMID 16477438. (Review).
- ↑ Eric Fontaine: Metformin-Induced Mitochondrial Complex I Inhibition: Facts, Uncertainties, and Consequences. In: Frontiers in Endocrinology. Band 9, 2018, doi:10.3389/fendo.2018.00753, PMID 30619086, PMC 6304344 (freier Volltext).
- ↑ Hannah R. Bridges, Andrew J. Y. Jones, Michael N. Pollak, Judy Hirst: Effects of metformin and other biguanides on oxidative phosphorylation in mitochondria. In: Biochemical Journal. Band 462, Nr. 3, 15. September 2014, S. 475–487, doi:10.1042/BJ20140620, PMID 25017630, PMC 4148174 (freier Volltext).
- ↑ Hannah R. Bridges, James N. Blaza, Zhan Yin, Injae Chung, Michael N. Pollak, Judy Hirst: Structural basis of mammalian respiratory complex I inhibition by medicinal biguanides. In: Science. Band 379, Nr. 6630, 27. Januar 2023, S. 351–357, doi:10.1126/science.ade3332, PMID 36701435, PMC 7614227 (freier Volltext).
- ↑ Roman Abrosimov, Marius W. Baeken, Samuel Hauf, Ilka Wittig, Parvana Hajieva, Carmen E. Perrone, Bernd Moosmann: Mitochondrial complex I inhibition triggers NAD+-independent glucose oxidation via successive NADPH formation, “futile” fatty acid cycling, and FADH2 oxidation. In: GeroScience. 25. Januar 2024, doi:10.1007/s11357-023-01059-y.
- ↑ Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 157 f. (zitiert).
- ↑ Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF): Nationale VersorgungsLeitlinie Typ-2-Diabetes – Teilpublikation der Langfassung, 2. Auflage, Version 1. 2021, doi:10.6101/AZQ/000475 (leitlinien.de [abgerufen am 30. Mai 2022]).
- ↑ P. Schweikert-Wehner: Diabetes bei Leberinsuffizienz: Zielgerichtete Auswahl und Dosierung der Antidiabetika. In: Ärzte Zeitung (Hrsg.): Perspektiven der Diabetologie. Nr. 115/41. Ärzte Verlag, Berlin 2018.
- ↑ Helena Teede, Marie Misso, Michael Costello et al. im Auftrag des International PCOS Network: International evidence-based guideline for the assessment and management of polycystic ovary syndrome. 2018, ISBN 978-0-646-98332-5 (monash.edu [abgerufen am 30. Mai 2022]).
- ↑ T. Misugi, K. Ozaki u. a.: Insulin-lowering agents inhibit synthesis of testosterone in ovaries of DHEA-induced PCOS rats. In: Gynecologic and obstetric investigation. Band 61, Nr. 4, 2006, S. 208–215, doi:10.1159/000091496. PMID 16479139.
- ↑ Sonja Kastillan: Pille statt Wille. In: Frankfurter Allgemeine Sonntagszeitung. Nr. 32 vom 10. August 2008, S. 57.
- ↑ Edgar Gärtner: Metformin ist keine Wunderdroge. In: europeanscientist.com. 8. Januar 2020, abgerufen am 6. Oktober 2021.
- ↑ Khaled Hamlaoui, Dario Furnari: Metformin and Exercise; the Effects of Metformin in the Body Building to Minimize the Effects of the Use of Anabolics: Case Report for a Randomized Controlled Trial. (PDF; 1,1 MB) In: Archives of Health Science. Band 4, Nr. 1, 2020, S. 1–9. doi:10.31829/2641-7456/ahs2020-4(1)-118
- ↑ Rick Collins: Legal Muscle: Anabolics in America. Legal Muscle Publication, 2002, ISBN 0-9726384-0-7, S. 420 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. S. McDonagh, S. Selph u. a.: Systematic review of the benefits and risks of metformin in treating obesity in children aged 18 years and younger. In: JAMA Pediatrics. Band 168, Nr. 2, Februar 2014, S. 178–184, doi:10.1001/jamapediatrics.2013.4200. PMID 24343296. (Review).
- ↑ Jana Meixner: Schützt Metformin vor Krebs? In: Medizin transparent. 23. April 2024, abgerufen am 24. Juni 2024.
- ↑ Medikament gegen Alterung: Können wir bald alle über 100 werden? In: Spiegel Online. Abgerufen am 15. Februar 2019.
- ↑ Altersbedingte Krankheiten aufhalten und das Leben verlängern: Metformin-Studie geplant. Pressemitteilung der Deutschen Gesellschaft für Endokrinologie (DGE), 29. Juni 2015, abgerufen am 2. Mai 2017.
Maren Emmerich: Medikamente gegen das Älterwerden? Buchkritik zu „Das Geheimnis des menschlichen Alterns“. In: Spektrum der Wissenschaft, 30. Juli 2015, abgerufen am 2. Mai 2017.
Ernst Mauritz: Studie genehmigt: Anti-Diabetesmittel könnte bald offizielle Anti-Aging-Pille sein. In: Kurier, 2. Dezember 2015; abgerufen am 2. Mai 2017. - ↑ Joachim Czichos: Medikament repariert Hirnschäden – aber nur im weiblichen Gehirn. In: Wissenschaft aktuell. 12. September 2019, abgerufen am 13. September 2019.
- ↑ a b Merck Serono GmbH: Fachinformation Glucophage® 500/850/1000 mg Filmtabletten. Stand April 2017.
- ↑ SR. Salpeter, E. Greyber et al.: Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Library, 14. April 2010; abgerufen am 4. Mai 2016.
- ↑ Metformin. ( vom 21. Juli 2016 im Internet Archive) embryotox.de, aktualisiert am 24. September 2013, abgerufen am 2. Mai 2017.
- ↑ Präoperative Evaluation erwachsener Patienten vor elektiven, nicht herz-thoraxchirurgischen Eingriffen. Gemeinsame Empfehlung der DGAI, DGCH und DGIM. In: Anästhesiologie und Intensivmedizin. Band 58, 2017, S. 349–364, DOI: 10.19224/ai2017.349.
- ↑ Welche Nebenwirkungen von Metformin können auftreten?. Auf: medilico.com; Abruf am 24. August 2017.
- ↑ Ivan H. Stockley, Karen Baxter: Stockley’s Drug Interactions. Electronic version, 7. edition, Pharmaceutical Press, London 2006, ISBN 0-85369-754-X, S. 483 (Volltext der 8. Ausgabe als PDF).
- ↑ J. Mann, D. De Leeuw, K. Hermansen et al.: Evidenz-basierte Ernährungsempfehlungen zur Behandlung und Prävention des Diabetes mellitus. Autorisierte deutsche Version nach M. Toeller: Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). In: Diabetes und Stoffwechsel. 2005, Nr. 14, S. 75–94.
- ↑ Zunahme von Spontanberichten über Metformin-assoziierte Laktatazidosen. (PDF; 224 kB) Aus der UAW-Datenbank der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), 8. März 2013; abgerufen am 2. Mai 2017.
- ↑ Sven Siebenand: Operationen: Trotz Dauermedikation unters Messer. In: Pharmazeutische Zeitung. 21/2009, abgerufen am 2. Mai 2017 (Abschnitt Der Fall Metformin).
- ↑ Martin Bischof, Bernhard Ludvik, Martin Kraupp, Christian Nanoff, Anton Luger: Diabetes mellitus. In: Bernhard Ludvik, Martin Bischof, Martin Kraupp, Anton Luger (Hrsg.): Endokrinologie und Stoffwechsel (= MCW-Block. Nr. 10). 6. Auflage, Facultas.wuv, Wien 2012, ISBN 978-3-7089-0814-4, S. 136.
- ↑ Information der britischen Arzneimittelbehörde zu Metformin: Verminderte Vitamin-B12-Spiegel – Empfehlungen für die Überwachung von Risikopatienten. Arzneimittelkommission der deutschen Ärzteschaft (AKdÄ), 25. August 2022, abgerufen am 26. August 2022.
- ↑ Metformin and reduced vitamin B12 levels: new advice for monitoring patients at risk. Medicines and Healthcare products Regulatory Agency (MHRA), 20. Juni 2022, abgerufen am 26. August 2022.
- ↑ Ärzteblatt: Väterliche Einnahme von Metformin könnte Risiko für Fehlbildungen bei Kindern erhöhen. 30. März 2022, abgerufen am 31. März 2022.
- ↑ AM. Strugaru, J. Kazakova, E. Butnaru, IC. Caba, Bello-López MÁ, R. Fernández-Torres: Simultaneous determination of metformin and glimepiride in human serum by ultra high performance liquid chromatography quadrupole time of flight mass spectrometry detection. In: Journal of Pharmaceutical and Biomedical Analysis. 20. Februar 2019, Band 20, Nr. 165, S. 276–283, PMID 30572192.
- ↑ N. Antonopoulos, G. Machairas, G. Migias, A. Vonaparti, V. Brakoulia, C. Pistos, D. Gennimata, I. Panderi: Hydrophilic Interaction Liquid Chromatography-Electrospray Ionization Mass Spectrometry for Therapeutic Drug Monitoring of Metformin and Rosuvastatin in Human Plasma. In: Molecules. 27. Juni 2018, Band 23, Nr. 7, PMID 29954074.
- ↑ R. Oertel, J. Baldauf, J. Rossmann: Development and validation of a hydrophilic interaction liquid chromatography-tandem mass spectrometry method for the quantification of the antidiabetic drug metformin and six others pharmaceuticals in wastewater. In: Journal of Chromatography A. 29. Juni 2018, Band 1556, S. 73–80, PMID 29748091.
- ↑ C. Hess, M. Unger, B. Madea, B. Stratmann, D. Tschoepe: Range of therapeutic metformin concentrations in clinical blood samples and comparison to a forensic case with death due to lactic acidosis. In: Forensic Science International. Mai 2018, Band 286, S. 106–112, PMID 29574345.
- ↑ M. Posselt, A. Jaeger, JL. Schaper, M. Radke, JP. Benskin: Determination of polar organic micropollutants in surface and pore water by high-resolution sampling-direct injection-ultra high performance liquid chromatography-tandem mass spectrometry. In: Environmental Sciences Proceedings, Impacts. Band 20. Jahrgang, Dezember 2018, S. 1716–1727, doi:10.1039/C8EM00390D, PMID 30350841.
- ↑ Umweltbundesamt - Kurzdossier Spurenstoffe von Metformin, Seite 6, Stand Mai 2024, abgerufen am 7. Juli 2024
- ↑ Andri Bryner: Flüsse sauber halten ist Vorsorge fürs Trinkwasser. Auf: eawag.ch, 9. September 2014; abgerufen am 15. März 2020.
- ↑ Theo Dingermann, Karl Hiller, Georg Schneider, Ilse Zündorf: Schneider Arzneidrogen. 5. Auflage. Elsevier, München 2004, S. 58. ISBN 3-8274-1481-4.
- ↑ Emil Alphonse Werner, James Bell: CCXIV.—The preparation of methylguanidine, and of ββ-dimethylguanidine by the interaction of dicyanodiamide, and methylammonium and dimethylammonium chlorides respectively. In: Journal of the Chemical Society, Transactions. Band 121, Nr. 0, 1. Januar 1922, S. 1790–1794, doi:10.1039/CT9222101790.
- ↑ J. Sterne: Du nouveaux dans les antidiabetiques. La NN dimethylamine guanyl guanidine (N.N.D.G.). In: Maroc médical. Band 36, 1957, S. 1295–1296.
- ↑ Courtney Cavaliere: GLUCOPHAGE: Diabetic Drug Based on Traditional Herb Celebrates 50 Years of Use. In: Herbalgram. Nr. 76, S. 44–49.
- ↑ Clifford Bailey: Metformin: historical overview. In: Diabetologia. Band 60, 2017, S. 1566–1576, PMID 28776081.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]