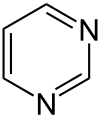
Pyrimidin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pyrimidin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H4N2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis orangefarbene Verbindung[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest bis flüssig | |||||||||||||||
| Dichte |
1,016 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
123–124 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert |
1,23 (20 °C, konjugierte Säure)[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,504 (20 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
145,9 kJ·mol−1 (flüssig)[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Pyrimidin (Y[7]) ist ein sechsgliedriges heterocyclisches aromatisches Amin mit zwei Stickstoffatomen, das nach der systematischen Nomenklatur auch als 1,3-Diazin bezeichnet wird. Der Name leitet sich von gr. pyr = Hitze, Feuer (wegen der Verwandtschaft mit Pyridin) und der Stoffklasse der Amidine ab. Pyrimidin ist der Grundkörper der Stoffgruppe der Pyrimidine.
Struktur
[Bearbeiten | Quelltext bearbeiten]Pyrimidin zählt als ein Aza-Analoges (Azalog) des Pyridins zu den heteroaromatischen Diazinen.

Herstellung
[Bearbeiten | Quelltext bearbeiten]Pyrimidin wurde Ende des 19. Jahrhunderts erstmals von Siegmund Gabriel und James Colman aus Barbitursäure synthetisiert. Diese wurde mit Phosphoroxychlorid umgesetzt, wobei 2,4,6-Trichlorpyrimidin erhalten wurde. Enthalogenierung mit Zinkpulver führte zur Zielverbindung.[8] Enthalogenierungen wurden auch mit 2,4-Dichlorpyrimidin und Tetrachlorpyrimidin durchgeführt.[9]

Über 50 Jahre nach Gabriels Entdeckung wurde im Arbeitskreis um Hellmut Bredereck eine Synthese aus C3-Bausteinen und Formamid entwickelt. Als Substitut für den instabilen Malondialdehyd (Propandial) wurden dessen Tetraacetal, 1-Methoxy-1,3,3-triethoxypropan, der Enolether 1,3,3-Triethoxypropen und das Enamin 3-Diethylaminopropenal eingesetzt.[10][11]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Pyrimidin bildet farblose, charakteristisch riechende Kristalle, die schon oberhalb von 20–22 °C schmelzen.[2] Oberhalb des Schmelzpunktes liegt eine farblose Flüssigkeit mit einem Normaldrucksiedepunkt bei 124 °C vor.[12] Die molare Verdampfungsenthalpie beträgt 49,89 kJ·mol−1.[13] Die Verbrennungsenthalpie wurde mit −2288,9 kJ·mol−1, die Bildungsenthalpie mit 143,2 kJ·mol−1 bestimmt.[13] Die Verbindung ist in Wasser leicht löslich.[2] Mit Säuren bildet sie Salze.[2]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Brockhaus ABC Chemie, F.A. Brockhaus Verlag Leipzig 1971.
- J. A. Joule, G. F. Smith, Heterocyclic Chemistry, Second Edition, Van Nostrand Reinhold Company, London, 1978, ISBN 0-442-30212-6.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu Pyrimidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Pyrimidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2014.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-96.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1374.
- ↑ Datenblatt Pyrimidine bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ Carl R. Woese: Bacterial evolution. In: Microbiological Reviews. Band 51, Nr. 2, Juni 1987, S. 221–271, doi:10.1128/mr.51.2.221-271.1987, PMID 2439888, PMC 373105 (freier Volltext) – (Tbl. 1).
- ↑ S. Gabriel, James Colman, Über das Pyrimidin, Berichte der deutschen chemischen Gesellschaft, 32: 1525–1538 (1899); doi:10.1002/cber.18990320231.
- ↑ The Merck Index, 11th Edition, Merck and Co., Rahway, USA, 1989, S. 1270.
- ↑ H. Bredereck, R. Gompper, G. Morlock: Formamid-Reaktionen, VIII. Eine Neue Pyrimidin-Synthese, Chemische Berichte 90, 942–952 (1957); doi:10.1002/cber.19570900613.
- ↑ H. Bredereck, R. Gompper, H. Herlinger: Formamid-Reaktionen, XI. Darstellung, Eigenschaften und Umsetzungen des Pyrimidins, Chemische Berichte, 91, 2832–2849 (1958); doi:10.1002/cber.19580911240.
- ↑ CRC Handbook of Data on Organic Compounds, 2nd Edition, Weast,R.C and Grasselli, J.G., ed(s)., CRC Press, Inc., Boca Raton, FL, 1989, 1.
- ↑ a b Nabavian, P.M.; Sabbah, R.; Chastel, R.; Laffitte, M., Thermodynamique de composes azotes. II. Etude thermochimique des acides aminobenzoiques, de la pyrimidine, de l'uracile et de la thymine., J. Chim. Phys., 1977, 74, S. 115–126.

