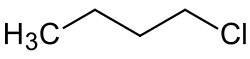
1-Chlorbutan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 1-Chlorbutan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H9Cl | |||||||||||||||||||||
| Kurzbeschreibung |
leicht flüchtige, farblose Flüssigkeit mit chloroformartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 92,57 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||||||||
| Dichte |
0,89 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (0,87 g·l−1 bei 25 °C)[1] | |||||||||||||||||||||
| Brechungsindex |
1,4018 (20 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
1-Chlorbutan ist eine chemische Verbindung aus den Gruppen der gesättigten, aliphatischen Halogenkohlenwasserstoffe und der organischen Chlorverbindungen.
Synthese
[Bearbeiten | Quelltext bearbeiten]Eine technische Synthese erfolgt durch thermische Chlorierung von Butan über Aluminiumoxid bei 200 °C. Hierbei entsteht in gleichem Maße 2-Chlorbutan und in geringen Anteilen Dichlorbutane. Diese Synthese gelingt auch photochemisch bei 15–20 °C, wobei die Produktverteilung ähnlich ist. Eine weitere Möglichkeit ist die Umsetzung von 1-Butanol mit Chlorwasserstoff bei 100 °C.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1-Chlorbutan ist eine farblose und leicht flüchtige Flüssigkeit mit einem für halogenierte Kohlenwasserstoffe typischen Geruch. Unter Normaldruck siedet die Verbindung bei 78 °C.[6] Bei −123,1 °C erstarrt die Substanz zu einem farblosen Feststoff. 1-Chlorbutan bildet mit Wasser und Alkoholen azeotrop siedende Gemische. Mit einem Wassergehalt von 6,6 Ma% zeigt sich ein Azeotrop bei 68,1 °C.[5] Die Azeotrope für Alkohole liegen für Methanol mit 28,5 Ma% bei 57,2 °C, für Ethanol mit 21,5 Ma% bei 66,2 °C und für 1-Propanol mit 16,0 Ma% bei 75,6 °C.[5]
Thermodynamische Eigenschaften
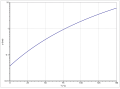
[Bearbeiten | Quelltext bearbeiten]Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,99588, B = 1182,903 und C = −54,885 im Temperaturbereich von 256,4 bis 351,6 K.[7]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−188,2 kJ·mol−1 −154,6 kJ·mol−1[8] |
|
| Verbrennungsenthalpie | ΔcH0liquid | −2695.8 kJ·mol−1[8] | |
| Wärmekapazität | cp | 159,53 J·mol−1·K−1 (25 °C)[9] 1,72 J·g−1·K−1 (25 °C)[9] |
als Flüssigkeit |
| Kritische Temperatur | Tc | 503 K[10] | |
| Kritischer Druck | pc | 45,8 bar[10] | |
| Kritisches Volumen | Vc | 0,247 l·mol−1[10] | |
| Kritische Dichte | ρc | 0,318 g·ml−1[10] | |
| Azentrischer Faktor | ωc | 0,228[10] | |
| Verdampfungsenthalpie | ΔVH0 ΔVH |
33,52 kJ·mol−1[11] 30,39 kJ·mol−1[12] |
beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der vereinfachten Watsongleichung ΔVH=A·(1−Tr)n (ΔVH in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 41,205 kJ/mol, n = 0,336 und Tc = 532,0 K im Temperaturbereich zwischen 184 K und 532 K beschreiben.[13]
-
Dampfdruckfunktion von 1-Chlorbutan
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]1-Chlorbutan gilt als entzündliche Flüssigkeit. Oberhalb der Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei −12 °C.[6] Der Explosionsbereich liegt zwischen 1,8 Vol.-% (65 g/m³) als untere Explosionsgrenze (UEG) und 10,1 Vol.-% (390 g/m³) als obere Explosionsgrenze (OEG).[6] Der maximale Explosionsdruck liegt bei 9,6 bar.[6] Die Grenzspaltweite wurde mit 1,06 mm bestimmt.[6] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[6] Mit einer Mindestzündenergie von 1,24 mJ sind Dampf-Luft-Gemische extrem zündfähig.[14][15] Die Zündtemperatur beträgt 245 °C.[6] Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung
[Bearbeiten | Quelltext bearbeiten]1-Chlorbutan wird als Alkylierungsreagenz zur Einführung einer Butylgruppe bei organischen Synthesen (z. B. für ionische Flüssigkeiten) verwendet. Durch Umsetzung mit metallischen Lithium erhält man das für metallorganische Synthesen sehr häufig genutzte Butyllithium.
Die Verbindung besitzt sehr gute Lösungseigenschaften für Fette, Öle und Wachse und wird auch in der HPLC verwendet. In der Veterinärmedizin wird 1-Chlorbutan als Mittel gegen niedere Würmer eingesetzt.[16]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- BAuA: Begründung zu 1-Chlorbutan in TRGS 900. (PDF)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l Eintrag zu 1-Chlorbutan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ W. Gerrard, H. R. Hudson, W. S. Murphy: s-Butyl Chloride from n-Butyl Dichloroborinate and from n-Butanol-Hydrogen Chloride. In: J. Chem. Soc. 1962, S. 1099–1101, doi:10.1039/JR9620001099.
- ↑ Eintrag zu 1-chlorobutane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c Datenblatt 1-Chlorbutan ( vom 25. März 2016 im Internet Archive) (PDF; 91 kB) bei Applichem; abgerufen am 27. August 2012.
- ↑ a b c Ullmann’s Encyclopedia of Industrial Chemistry. 7. Auflage. Wiley Interscience, Release 2009.
- ↑ a b c d e f g E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ H. R. Kemme, S. I. Kreps: Vapor Pressure of Primary ’n'-Alkyl Chlorides and Alcohols. In: J. Chem. Eng. Data., 14, 1, 1969, S. 98–102, doi:10.1021/je60040a011.
- ↑ a b G. Stridth, S. Sunner: Enthalpies of formation of some 1-chloroalkanes and the CH2-increment in the 1-chloroalkanes series. In: J. Chem. Thermodyn., 7, 1975, S. 161–168, doi:10.1016/0021-9614(75)90264-5.
- ↑ a b J.-P. E. Grolier, G. Roux-Desgranges, M. Berkane, E. Jimenez, E. Wilhelm: Heat capacities and densities of mixtures of very polar substances 2. Mixtures containing N,N-dimethylformamide. In: J. Chem. Thermodyn. 25(1), 1993, S. 41–50, doi:10.1006/jcht.1993.1005.
- ↑ a b c d e Carl L. Yaws, Prasad K. Narasimhan: Thermophysical Properties of Chemicals and Hydrocarbons - Chapter 1: Critical Properties and Acentric Factor, Organic Compounds. 1. Auflage. Elsevier, 2008, ISBN 978-0-8155-1596-8, S. 8, doi:10.1016/B978-081551596-8.50006-7.
- ↑ V. Tekac, V. Majer, V. Svoboda, V. Hynek: Enthalpies of vaporization and cohesive energies for six monochlorinated alkanes. In: J. Chem. Thermodyn. 13, 1981, S. 659–662, doi:10.1016/0021-9614(81)90037-9.
- ↑ V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ Carl L. Yaws, Marco A. Satyro: Thermophysical Properties of Chemicals and Hydrocarbons. Chapter 7: Enthalpy of Vaporation, Organic Compounds. 1. Auflage. Elsevier 2008, ISBN 978-0-8155-1596-8, S. 315; doi:10.1016/B978-081551596-8.50012-2.
- ↑ J. B. Fenn: Lean flammability limit and minimum spark ignition energy. In: Ind. Eng. Chem., 43, 1951, S. 2865–2869, doi:10.1021/ie50504a057.
- ↑ H. F. Calcote, C. A. Gregory, C. M. Barnett, R. B. Gilmer: Spark Ignition – Effect of Molecular Structure. In: Ind. Eng. Chem., 44, 1952, S. 2656–2662, doi:10.1021/ie50515a048.
- ↑ National Toxicology Program: n-Butyl chloride. ( vom 5. März 2016 im Internet Archive) ntp.niehs.nih.gov; abgerufen am 18. November 2014.