1-Ethyl-3-methylimidazoliumchlorid
(Weitergeleitet von 1-Ethyl-3-methylimidazol)
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
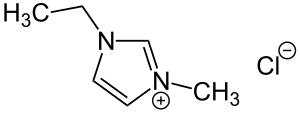
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1-Ethyl-3-methylimidazoliumchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H11N2Cl | |||||||||||||||
| Kurzbeschreibung |
hellbrauner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 146,62 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,112 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
1-Ethyl-3-methylimidazoliumchlorid ist eine heterocyclische quartäre Ammoniumverbindung. Das Kation ist ein Derivat von Imidazol. Die Stickstoffatome tragen jeweils eine Ethyl- und eine Methylgruppe.
Gewinnung
[Bearbeiten | Quelltext bearbeiten]1-Ethyl-3-methylimidazoliumchlorid kann durch Reaktion eines N-Alkylimidazol mit einem Überschuss eines Alkylchlorid gewonnen werden.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]1-Ethyl-3-methylimidazoliumchlorid ist eine ionische Flüssigkeit, die für viele Anwendungen verwendet werden kann, so zum Beispiel für die Celluloseveredelung oder die galvanische Abscheidung von Aluminium.[3]
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]Andere Salze mit dem gleichen Kation sind zum Beispiel 1-Ethyl-3-methylimidazoliumbromid und 1-Ethyl-3-methylimidazoliumtetrafluoroborat.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt 1-Ethyl-3-methylimidazolium chloride, 98% bei Sigma-Aldrich, abgerufen am 26. Februar 2013 (PDF).
- ↑ Robin D. Rogers: Green Industrial Applications of Ionic Liquids. Springer, 2003, ISBN 1-4020-1137-7, S. 219 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. O’Meara, A. Alemany, M. Maase, U. Vagt, I. Malkowsky, Metal Finishing 2009: Deposition of Aluminum Using Ionic Liquids ( vom 5. September 2015 im Internet Archive)
