Diethanolamin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diethanolamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H11NO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, hygroskopischer Feststoff mit ammoniakartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 105,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest (auch flüssig wegen niedrigem Schmelzpunkt)[1] | ||||||||||||||||||
| Dichte |
1,1 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
269 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
8,88 (25 °C)[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG/Schweiz: 1 mg·m−3 (gemessen als einatembarer Staub)[1][5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Diethanolamin (DEOA) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Aminoalkohole. Er wird als Grundstoff in der chemischen Industrie eingesetzt und findet in Lösungsmitteln, Emulgatoren und Wasch- sowie Reinigungsmitteln Anwendung.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Diethanolamin wird großtechnisch durch Umsetzung von Ethylenoxid mit Ammoniak bei Temperaturen von 80–140 °C und Drücken von 70–160 bar in Gegenwart von Wasser und eines sauren Katalysators hergestellt. Besonders bevorzugt werden saure Zeolithe (z. B. Alumosilicate) oder organische Ionentauscherharze in der H-Form (Protonen) eingesetzt.[6]
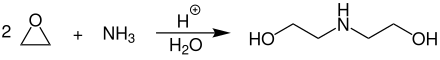
Als Nebenprodukte entstehen Monoethanolamin und Triethanolamin. Durch einen Überschuss an Ethylenoxid kann der Anteil an Diethanolamin und Triethanolamin stark erhöht werden. Daher liegt das Molverhältnis von Ammoniak zu Ethylenoxid bevorzugt bei 7:2. Die komplette Reaktion läuft dabei bevorzugt in Rührkessel- oder Rohrreaktoren ab. Die Reinigung und Aufarbeitung des Reaktionsgemisches erfolgt durch mehrstufige Destillation in Rektifikationskolonnen. Abgetrenntes Monoethanolamin kann wieder in den Reaktor zurückgeführt werden um die Gesamtausbeute an Diethanolamin nochmals zu erhöhen.[6]
Im Jahr 1990 wurden in der Bundesrepublik Deutschland etwa 20.500 Tonnen an Diethanolamin hergestellt.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Diethanolamin ist ein farbloser, hygroskopischer Feststoff mit ammoniakartigem Geruch.[1] Die dynamische Viskosität von Diethanolamin beträgt 352 mPa·s bei 30 °C.[7]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Durch Dehydratation (Wasserabspaltung) von Diethanolamin mit Schwefelsäure kann Morpholin erzeugt werden.[8]

Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Diethanolamin gilt als entzündlicher Stoff. Oberhalb der Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei 176 °C.[1][9] Der Explosionsbereich liegt zwischen 2,1 Vol.‑% als untere Explosionsgrenze (UEG) und 10,6 Vol.‑% als obere Explosionsgrenze (OEG).[1][9] Die Zündtemperatur beträgt 355 °C.[1][9] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Diethanolamin wird industriell in temperierten Tanks gelagert und als ölige Flüssigkeit verwendet:
- als Härter für Epoxidharze, wasserlösliche Epoxy-Amin-Addukte für KTL-Harze.
- als Zwischenprodukt für die Herstellung von Waschrohstoffen, Zementhilfsmitteln, Pflanzenschutzmitteln und Bohr- und Schneidölen (Kühlschmiermittel)[10]
- als Katalysator bei der Herstellung von Polyurethanen[10]
- als Mahlhilfsmittel für Zement
- als Absorptionsmittel für Schwefelwasserstoff (H2S) und Kohlendioxid (CO2) in chemischen Prozessen wie der Aminwäsche und im Direct-air-capture-Verfahren
- in pharmazeutischen Produkten oder in häuslichen Produkten (Schuhcremes, Bodenpflegemittel) als Weichmacher und Feuchthaltemittel
- in Kosmetika kommt es zur Einstellung des pH-Wertes[11] oder als Verunreinigung vor[12][13]
Risikobewertung
[Bearbeiten | Quelltext bearbeiten]Die Internationale Agentur für Krebsforschung (IARC) stufte Diethanolamin im Jahr 2013 als möglicherweise krebserzeugend ein.[14] Diethanolamin ist als gesundheitsschädlich eingestuft und kann Allergien auslösen. Durch Nitrosierung von Diethanolamin (mit Nitriten) können krebserregende Nitrosamine (z. B. N-Nitrosodiethanolamin) entstehen.[15]
Forscher der Universität von North Carolina haben herausgefunden, dass sich Diethanolamin auf die Gehirnentwicklung von Föten auswirkt. Sie strichen im Tierversuch DEA auf die Haut trächtiger Mäuse und stellten fest, dass die neugeborenen Mäuse mit Gehirnschäden auf die Welt kamen. Im Bereich des Hippocampus wachsen Hirnzellen unter dem Einfluss von DEA langsamer und zugleich war die Sterberate der Zellen erhöht. In Kosmetika ist jedoch nur eine sehr viel geringere Dosis des Stoffes enthalten, so dass eine Gesundheitsgefahr etwa durch Shampoos unwahrscheinlich ist.[16]
Das Risiko, das von DEA-haltigen Kosmetika ausgeht, könnte sogar noch wesentlich geringer sein als von den Forschern angegeben. Laut einer Stellungnahme der Cosmetic, Toiletry, and Fragrance Association (CTFA) wurde DEA kaum jemals selbst in Kosmetik eingesetzt.[17] Typischerweise entsteht DEA als Abbauprodukt von Alkanolamiden (Reaktionsprodukten von Fettsäuren mit DEA) bzw. kann in geringen Mengen als nicht abreagierter Ausgangsstoff noch enthalten sein. Die CTFA hat für die Verwendung von Shampoo mit einem sehr hohen, aber realistischen Gehalt an DEA-haltigen Inhaltsstoffen (und entsprechend DEA) errechnet, dass die Dosis an DEA auf der Haut der Mäuse sogar tausendfach höher war als die Dosis in Shampoos. Weiterhin wird von der CTFA darauf hingewiesen, dass die biologische Ursache der Hirnveränderung im Versuch mit Mäusen eine Cholindefizienz war, gegenüber der Mäuse empfindlicher sind als Menschen.
Diethanolamin wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Diethanolamin waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Stoffe. Die Neubewertung fand ab 2012 statt und wurde von Deutschland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[18][19]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Diethanolamine in der Consumer Product Information Database
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o Eintrag zu Diethanolamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Sigma-Aldrich, SDB.
- ↑ a b c d Toxikologische Bewertung von Diethanolamin (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 1. Mai 2018.
- ↑ Eintrag zu 2,2′-iminodiethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 111-42-2 bzw. Diethanolamin), abgerufen am 2. November 2015.
- ↑ a b Patent EP1289927B1: Verfahren zur Herstellung von Ethanolaminen. Veröffentlicht am 14. Mai 2014, Anmelder: BASF SE, Erfinder: Matthias Frauenkron, Ulrich Müller, Wolfgang Harder, Jörg Unger, Johann-Peter Melder, Anton Meier, Walter Himmel.
- ↑ Datenblatt Diethanolamin Rotipuran® ≥ 99 % (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Stephen Hawkins: Industrial Organic Chemistry. Wiley-VCH, 2003, ISBN 3-527-30578-5, Chap. 7. Oxidation Products of Ethylene, S. 159–161.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ a b Datenblatt Diethanolamin (Labor) (PDF; 183 kB) bei GisChem.
- ↑ Hautstadt.de: Informationen zu Kontaktallergenen
- ↑ Amtsblatt der Europäischen Union: Richtlinie 76/768/EWG des Rates zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über kosmetische Mittel (siehe Stichwort Fettsäure-Dialkylamide und Dialkanolamide) (PDF)
- ↑ Chemisches und Veterinäruntersuchungsamt Karlsruhe: Nitrosamine – auch in kosmetischen Mitteln unerwünscht! ( vom 12. Februar 2013 im Webarchiv archive.today).
- ↑ IARC Monograph 101 – Diethanolamin, 2013
- ↑ Dermaviduals: Nitrosamine in Kosmetika – Haut in Gefahr?
- ↑ Universität North Carolina: News Mitteilung UNC study shows ingredient commonly found in shampoos may inhibit brain development (engl.)
- ↑ fasebj.org: DEA in consumer products is safe
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2,2'-Iminodiethanol , abgerufen am 6. März 2022.


