N-Methyl-N-(trimethylsilyl)trifluoracetamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Methyl-N-(trimethylsilyl)trifluoracetamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H12F3NOSi | ||||||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 199,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Dimethylformamid (DMF) und Tetrahydrofuran (THF)[3] | ||||||||||||||||||
| Brechungsindex |
1,4720 (25 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
N-Methyl-N-(trimethylsilyl)trifluoracetamid (MSTFA) ist ein Silylierungsreagenz zur Einführung der Trimethylsilylgruppe TMS als Schutzgruppe für H-acide funktionelle Gruppen, insbesondere für Hydroxygruppen. MSTFA bildet bei der Silylierung besonders flüchtige Reaktionsprodukte und eignet sich daher für die Derivatisierung niedermolekularer Verbindungen für gaschromatographische GC- und massenspektrometrische MS-Analysen.[5]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Manfred Donike synthetisierte MSTFA erstmals 1969 als Reagenz zur Herstellung von O-, N- und S-Trimethylsilylderivaten.[2] Dabei reagiert N-Methyltrifluoracetamid (MTFA) und Trimethylchlorsilan in Benzol in Gegenwart von Triethylamin zu MSTFA (Ausbeute 90–95 %).

Zur Isolierung des Endprodukts muss das entstehende hygroskopische Triethylaminhydrochlorid unter Feuchtigkeitsausschluss abfiltriert und das karzinogene Lösungsmittel Benzol abdestilliert werden.
Industriell wird N-Methyl-N-(trimethylsilyl)trifluoracetamid durch Reaktion von N-Methyltrifluoracetamid und N,O-Bis(trimethylsilyl)acetamid (BSA) hergestellt.[6]
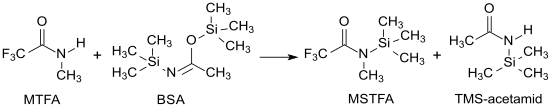
Die Ausgangsverbindung N-Methyltrifluoracetamid ist einfach aus Trifluoressigsäureanhydrid TFAA[7] oder Trifluoressigsäureethylester[8] und Methylamin, N,O-Bis(trimethylsilyl)acetamid (BSA) aus Acetamid und Trimethylchlorsilan in Gegenwart von Triethylamin zugänglich.[9][10]
Bei optimierter Prozessführung – Reaktion ohne Lösungsmittel, Temperatur zwischen 40 und 130 °C – kann MSTFA neben dem ebenfalls als Silylierungsmittel brauchbaren Nebenprodukt N-Trimethylsilylacetamid (TMS-Acetamid) in 94%iger Ausbeute erhalten werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]N-Methyl-N-(trimethylsilyl)trifluoracetamid ist eine klare, farblose und feuchtigkeitsempfindliche Flüssigkeit.[1]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Die Umwandlung einer para-ständigen Carboxygruppe in eine Nitrilgruppe verläuft quantitativ durch Dehydratisierung mit einem Kupfersalz und N-Methyl-N-(trimethylsilyl)trifluoracetamid MSTFA in Toluol bei 100 °C.[11]
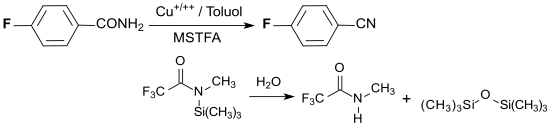
MSTFA wird dabei zu N-Methyltrifluoracetamid und Hexamethyldisiloxan hydrolysiert.
Wichtigste Anwendung für N-Methyl-N-(trimethylsilyl)trifluoracetamid ist die Darstellung von Trimethylsilylderivaten von Verbindungen, die Hydroxy-, Carboxy-, primären und sekundären Amino- und Thiolgruppen tragen,[12] für die GC- und GC/MS-Analytik. Die gebildeten Trimethylsilyl(TMS)-Derivate sind flüchtiger, weniger polar und thermisch stabiler als die Ausgangssubstanzen. Bei der Trimethylsilylierung entsteht aus MSTFA wiederum N-Methyltrifluoracetamid, das wegen seiner hohen Flüchtigkeit im Gaschromatogramm vor den TMS-Derivaten erscheint, wodurch das unerwünschte Überlagern mit Messsubstanzpeaks vermieden wird.
Die Grundlagen dazu wurden von dem später als „Doping-Papst“ bekannt gewordenen Manfred Donike[13] in mehreren frühen Publikationen gelegt, z. B. zum Nachweis der Katecholamine Adrenalin, Noradrenalin und Dopamin und der als Aufputschmittel verwendeten Phenylalkylamine Amphetamin, Methamphetamin und Ephedrin.[14][15][16]

Zur Trimethylsilylierung der weniger reaktiven Indolalkylamine, wie z. B. Tryptamin, Melatonin und Serotonin werden Gemische von MSTFA mit N-Methyltrifluoracetamid MTFA und Imidazol eingesetzt.[17]
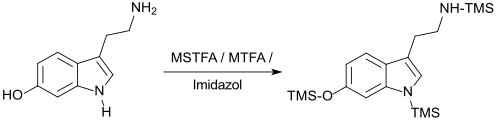
Die Reaktion kann auch durch Zugabe von Trimethylchlorsilan TMCS, Trimethylsilylimidazol (TMS-imidazol) oder des sehr reaktiven Iodtrimethylsilans TMIS beschleunigt werden.
Auch Sexualhormone, wie das zur Empfängnisverhütung eingesetzte Ethinylestradiol[18] oder anabole Steroide wie Testosteron[19] können in biologischen Proben nach Derivatisierung mit MSTFA durch GC/MS quantitativ bestimmt werden.
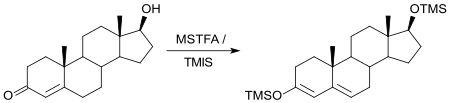
Derivatisierung mit MSTFA und anschließende GC/MS eignet sich auch zur Strukturaufklärung organischer Verbindungen mit aktiven Wasserstoffatomen.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt N-Methyl-N-trimethylsilyltrifluoracetamid bei Sigma-Aldrich, abgerufen am 28. September 2019 (PDF).
- ↑ a b M. Donike: N-Methyl-N-trimethylsilyl-trifluoracetamid, ein neues Silylierungsmittel aus der Reihe der silylierten Amide. In: J. Chromatogr. A. Band 42, 1969, S. 103–104, doi:10.1016/S0021-9673(01)80592-6.
- ↑ Ellen M. Leahy: 1,3-Dimethyl-2-imidazolidinone. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rd342.
- ↑ Eintrag zu N-Methyl-N-trimethylsilyltrifluoroacetamide bei TCI Europe, abgerufen am 28. September 2019.
- ↑ a b D. Urbach: MSTFA und MSTFA-D9 – unverzichtbare Werkzeuge für die massenspektrometrische Strukturaufklärung. In: Toxichem Krimtech. Band 79, Nr. 3, 2012, S. 137–146 (gtfch.org [PDF]).
- ↑ Patent US4663471: Method for the preparation of N-methyl-N-trimethylsilyl trifluoroacetamide. Angemeldet am 14. August 1986, veröffentlicht am 5. Mai 1987, Anmelder: Shin-Etsu Chemical Co., Ltd., Erfinder: T. Shinohara, Y. Inoue.
- ↑ E.N. Gate et al.: Structural studies on bioactive compounds. 4. A structure-antitumor activity study on analogs of N-methylformamide. In: J. Med. Chem. Band 29, Nr. 6, 1986, S. 1046–1052, doi:10.1021/jm00156a024.
- ↑ E.R. Bissell, M. Finger: Fluorine-containing nitrogen compounds. I. Trifluoroethylamines. In: J. Org. Chem. Band 24, Nr. 9, 1959, S. 1256–1259, doi:10.1021/jo01091a024.
- ↑ L. Birkofer, A. Ritter, W. Gießler: Bis-silylierte Carbonsäureamide. In: Angew. Chem. Band 75, Nr. 1, 1963, S. 93–94, doi:10.1002/ange.19630750127.
- ↑ Patent US3397220: Silylating process and agent. Angemeldet am 23. September 1964, veröffentlicht am 13. August 1968, Anmelder: General Electric Co., Erfinder: J.F. Klebe.
- ↑ S. Enthaler, M. Weidauer: Copper-catalyzed dehydration of primary amides to nitriles. In: Catal. Lett. Band 141, 2014, S. 1079–1085, doi:10.1007/s10562-011-0660-9.
- ↑ Improved Detection & Identification using MSTFA/MSTFA-d9 Derivatization - GC/MS Case Study of Amphetamine. In: Contributed Article. Merck KGaA, abgerufen am 1. Oktober 2019.
- ↑ GESTORBEN: Manfred Donike. In: Der Spiegel. Nr. 35, 1995 (online – 28. August 1995).
- ↑ M. Donike: N-Trifluoracetyl-O-trimethylsilyl-phenolalkylamine, Darstellung und massenspezifischer gaschromatographischer Nachweis. In: J. Chromatogr. A. Band 103, Nr. 1, 1975, S. 91–112, doi:10.1016/S0021-9673(00)83805-4.
- ↑ G. Forsdahl, G. Gmeiner: Investigation of the silylation of ephedrines using N-methyl-N-trimethylsilyl-trifluoroacetamide. In: J. Chromatogr. B. Band 811, Nr. 2, 2004, S. 201–208, doi:10.1016/j.chromb.2004.09.002.
- ↑ Deutsche Sporthochschule Köln, Institut für Biochemie: Stimulantien-Analytik.
- ↑ M. Donike, R. Gola, L. Jaenicke: Nachweis von Indolalkylaminen nach selektiver Derivatisierung. In: J. Chromatogr. A. Band 134, Nr. 2, 1977, S. 385–395, doi:10.1016/S0021-9673(00)88537-4.
- ↑ Y.-Q. Zhou, Z.-J. Wang, N. Jia: Formation of multiple trimethylsilyl derivatives in the derivatization of 17α-ethinylestradiol with BSTFA or MSTFA followed by gas chromatography-mass spectrometry determination. In: J. Environm. Sci. Band 19, Nr. 7, 2007, S. 879–884, doi:10.1016/S1001-0742(07)60146-6.
- ↑ Deutsche Sporthochschule Köln, Institut für Biochemie: Anabol androgene Steroidhormone (Anabolika)

