Tetrachlorphenole
Die Tetrachlorphenole bilden eine Stoffgruppe der Organochlorverbindungen, bestehend aus einem Benzolring mit vier Chloratomen (–Cl) und einer Hydroxygruppe (–OH) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C6H2Cl4O.
Vertreter
[Bearbeiten | Quelltext bearbeiten]| Tetrachlorphenole | ||||||||||
| Name | 2,3,4,5-Tetrachlorphenol | 2,3,4,6-Tetrachlorphenol | 2,3,5,6-Tetrachlorphenol | |||||||
| Andere Namen | 2,3,4,5-TeCP |
2,3,4,6-TeCP Dowicide 6 |
2,3,5,6-TeCP | |||||||
| Strukturformel | 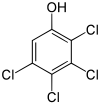 |
 |

| |||||||
| CAS-Nummer | 4901-51-3 | 58-90-2 | 935-95-5 | |||||||
| 25167-83-3 (Isomerengemisch) | ||||||||||
| PubChem | 21013 | 6028 | 13636 | |||||||
| Summenformel | C6H2Cl4O | |||||||||
| Molare Masse | 231,89 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Kurzbeschreibung | farblose bis graue Kristallnadeln mit phenolartigem Geruch[1][2][3] | |||||||||
| Schmelzpunkt | 69–70 °C[1] | 68 °C[2] | 113–114 °C[3] | |||||||
| Siedepunkt | 164 °C (31 mbar)[1] | 150 °C (21 mbar)[2] | 288 °C (Zersetzung)[3] | |||||||
| Dichte | 1,6 g·cm−3 (80 °C)[1] | 1,6 g·cm−3 (60 °C)[2] | ||||||||
| Löslichkeit | < 1 g·l−1 (20 °C)[1] | |||||||||
| schwer löslich in Wasser | ||||||||||
| GHS- Kennzeichnung |
|
|
| |||||||
| H- und P-Sätze | 301‐315‐318‐335‐410 | 301‐319‐315‐410 | 301‐335‐410 | |||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||||
| 261‐273‐280‐301+310‐302+352‐305+351+338 | 273‐301+310‐305+351+338‐501[4] | 273‐301+310+330 | ||||||||
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]2,3,4,6-Tetrachlorphenol gilt als Verunreinigung in technischem Pentachlorphenol und entsteht bei dessen Herstellung als Nebenprodukt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Siedepunkte der drei Isomere liegen relativ nah beieinander, während sich ihre Schmelzpunkte deutlicher unterscheiden. Das 2,3,5,6-Tetrachlorphenol, welches die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Die Tetrachlorphenole sind schwer löslich in Wasser und reagieren in Lösung schwach sauer.
Verwendung
[Bearbeiten | Quelltext bearbeiten]2,3,4,6-Tetrachlorphenol gehört zur Klasse der substituierten Phenolverbindungen, die in industriellen Anwendungen wie der Synthese von Pestiziden, Farbstoffen, Medikamenten, Kunststoffen usw. weit verbreitet sind.[4] Die Verbindung wird auch als Desinfektionsmittel und Schutzmittel (Fungizid[5]) für Holz, Latex und Leder eingesetzt.[6] Natrium-2,3,5,6-tetrachlorphenolat (das Natriumsalz von 2,3,5,6-Tetrachlorphenol, CAS-Nummer: 85712-07-8) wird als Fungizid eingesetzt.[7]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Bei der Zersetzung von Tetrachlorphenolen entsteht Chlorwasserstoff und andere hochgiftige Chlorprodukte wie PCDD/PCDF. Die Verbindungen sind sehr giftig für Wasserorganismen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Jennifer M. Gee, J. L. Peel: Metabolism of 2,3,4,6-Tetrachlorophenol by Micro-organisms from Broiler House Litter. In: Microbiology. Band 85, Nr. 2, 1974, S. 237–243, doi:10.1099/00221287-85-2-237 (freier Volltext).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu 2,3,4,5-Tetrachlorphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu 2,3,4,6-Tetrachlorphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Oktober 2012. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu 2,3,5,6-Tetrachlorphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b Datenblatt 2,3,4,6-Tetrachlorophenol bei Sigma-Aldrich, abgerufen am 1. Juli 2011 (PDF).
- ↑ Robert A. Lewis: Hawley's Condensed Chemical Dictionary. John Wiley & Sons, 2016, ISBN 978-1-119-19372-2 (books.google.com).
- ↑ Sub Ramamoorthy, E. G. Baddaloo, Sita Ramamoorthy: Handbook of Chemical Toxicity Profiles of Biological Species. CRC Press, 1995, ISBN 978-1-56670-014-6, S. 149 (books.google.com).
- ↑ 2,3,4,6-Tetrachlorophenol (SpecLab)


