2-Methyl-1-propanol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Methyl-1-propanol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C4H10O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fuselölartigem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 74,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,80 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
108 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,3955 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
2-Methyl-1-propanol (auch i-Butanol oder Isobutanol) gehört zur Gruppe der Alkanole, die wiederum zu den Alkoholen gehören.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Natürlich kommt 2-Methyl-1-propanol in Myrte (Myrtus communis),[7] Meerträubel (Ephedra sinica),[8] Lorbeer (Laurus nobilis),[7] Grüner Minze,[8] Römischer Kamille (Chamaemelum nobile),[9] Luzerne (Medicago sativa),[7] Echtem Hopfen,[8] Schwarzen Johannisbeeren (Ribes nigrum),[7] Ananas (Ananas comosus),[9] Orangen,[10] Sonnenblumen,[8] Mais,[8] Feigen (Ficus carica)[9] und in Spuren in der Färberdistel (Carthamus tinctorius)[7] vor. Daneben ist es z. B. Bestandteil von Fuselölen.[3]
-
Myrte
-
Lorbeer
-
Luzerne
-
Schwarze Johannisbeere
-
Ananas
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Chemisch gewinnt man Isobutanol wie auch 1-Butanol durch Hydroformylierung oder Hydrocarbonylierung von Propen.[3] Im Gegensatz zur Gewinnung von 1-Butanol arbeitet man hier mit dem anderen Reaktionsprodukt weiter und hydriert es:

- Propen reagiert mit Kohlenstoffmonoxid und Wasserstoff zu Butanal und 2-Methylpropanal.
Isobutanol kann mit Hilfe von Mikroorganismen biotechnologisch hergestellt werden. Dann dient es ähnlich wie 1-Butanol als regenerativer Biokraftstoff.[11]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Methyl-1-propanol ist eine farblose Flüssigkeit, die süßlich riecht. Wie alle Butanole ist auch 2-Methyl-1-propanol brennbar. Man kann 2-Methyl-1-propanol mit allen gängigen organischen Lösungsmitteln wie Ether, Ethylenglycol, Alkoholen, Ketonen und Aldehyden beliebig mischen, in Wasser ist es jedoch nur begrenzt löslich.
Die Verbindung bildet mit einer Reihe anderer Lösungsmittel azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit Methanol, Ethanol, n-Propanol, 2-Propanol, n-Butanol, 2-Butanol, Ethandiol, Chloroform, Aceton, Dibutylether, Ethylacetat, Isopropylacetat, n-Butylacetat, DMSO, Acetonitril und Schwefelkohlenstoff gebildet.[12]
Azeotrope mit verschiedenen Lösungsmitteln[12] Lösungsmittel Wasser n-Hexan n-Heptan Cyclohexan Dioxan Gehalt 2-Methyl-1-propanol in % 67 2 27 14 4 Siedepunkt in °C 89 68 91 78 101
Lösungsmittel Benzol Toluol Ethylbenzol Xylol Methylisobutylketon Gehalt 2-Methyl-1-propanol in % 8 45 80 88 91 Siedepunkt in °C 79 101 107 107 108
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]- Reaktionen
Mögliche Reaktionen des 2-Methyl-1-propanol sind die Veresterung zu einem Ester, die Dehydrierung zu einem Aldehyd, die Oxidation zu einer Carbonsäure und die Eliminierung von Wasser unter Bildung eines Alkens.

- 2-Methyl-1-propanol reagiert mit Essigsäure zu Essigsäureisobutylester und Wasser.

- Dehydration von 2-Methyl-1-propanol zu 2-Methylpropanal.
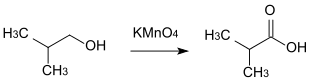
- 2-Methyl-1-propanol wird zu 2-Methylpropansäure oxidiert.
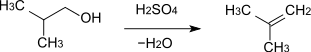
- 2-Methyl-1-propanol reagiert unter Wasserabspaltung zu 2-Methylpropen.
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]2-Methyl-1-propanol bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 27 °C.[2] Der Explosionsbereich liegt zwischen 1,7 Vol.-% (52 g/m3) als untere Explosionsgrenze (UEG) und 11 Vol.-% (340 g/m3) als obere Explosionsgrenze (OEG).[2][13] In Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergeben sich ein unterer Explosionspunkt von 26 °C und ein oberer Explosionspunkt von 59 °C.[2] Der maximale Explosionsdruck beträgt 8,5 bar.[2][13] Die Grenzspaltweite wurde mit 0,94 mm (50 °C) bestimmt.[2][13] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[13] Die Zündtemperatur beträgt 430 °C.[2][13] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Verwendung findet 2-Methyl-1-propanol in Derivaten als Lösungsmittel zur Synthese von Weichmachern und Estern,[3] die als Riechstoff- und Aroma verwendet werden, aber auch als Lösungsmittel, Verdünner und Zusatz in Nitrocelluloselacken, synthetischen Harzen, Reinigungsmitteln, Druckfarben und in Kraftstoff.[14] Vorwiegend wird es in der Lackindustrie verwendet und verbessert die Eigenschaften der Lacke.[14] Testweise wird es zudem bereits im Langstrecken-Motorsport als Treibstoff verwendet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu 2-METHYLPROPANOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- ↑ a b c d e f g h i j k l m n o p q r s t Eintrag zu 2-Methyl-1-propanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c d Toxikologische Bewertung von 2-Methylpropanol-1 (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 1. Mai 2018.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-370.
- ↑ Eintrag zu 2-methylpropan-1-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 78-83-1 bzw. 2-Methyl-1-propanol), abgerufen am 2. November 2015.
- ↑ a b c d e 2-METHYL-PROPANOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. August 2021.
- ↑ a b c d e 2-METHYL-PROPAN-1-OL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. August 2024.
- ↑ a b c ISOBUTANOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. August 2021.
- ↑ 2-METHYL-1-PROPANOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. August 2024.
- ↑ Alexandra M. Goho: Bakterien produzieren Butanol; Technology Review; 30. Januar 2008.
- ↑ a b I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 12–13.
- ↑ a b c d e E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ a b D. Stoye: Solvents. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2012, doi:10.1002/14356007.a24_437.













