Ferulasäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
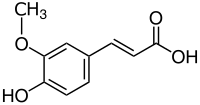
| ||||||||||||||||||||||
| Strukturformel der trans-Ferulasäure | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Ferulasäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H10O4 | |||||||||||||||||||||
| Kurzbeschreibung |
gelblicher geruchloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 194,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,14 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Ferulasäure (genauer trans-Ferulasäure) ist eine organische Verbindung, die (oder deren Ester) in verschiedenen Pflanzen, z. B. Stinkasant, Dill oder Süßgräsern wie Reis, Weizen oder Gerste, vorkommt (siehe auch die Pflanzengattung Ferula). Sie spielt eine Rolle bei der Synthese von Lignin in den Zellwänden der Pflanzen.[5]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ferulasäure gehört zur Gruppe der Phenolsäuren. Von ihrer Struktur leitet sich u. a. das Curcumin der Gelbwurzel ab. Sie kommt in der Natur fast nur in der trans-Form vor. Nur Bohnen enthalten einen höheren Anteil an cis-Ferulasäure,[6] wobei einige Forscher annehmen, dass die cis-Form nur bei der Lagerung der pflanzlichen Proben entsteht.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Ferulasäure wird als Ausgangsstoff zur Herstellung von Vanillin und von antimikrobiellen Stoffen für Seifen, Duftstoffe und Kosmetika verwendet.
Bedeutung bei der Bierbereitung
[Bearbeiten | Quelltext bearbeiten]Die Ferulasäure hat, insbesondere bei der Weizenbierbereitung, einen entscheidenden Einfluss auf die späteren sensorischen Merkmale des Bieres.
Vorkommen der Ferulasäure: Die Ferulasäure ist im Malz an die unlöslichen Pentosane gebunden, dort an Arabinose-Seitenketten. Gerstenmalz weist einen höheren Anteil an gebundener Ferulasäure auf als Weizenmalz, analog liegen höhere Werte in Gerstenmalzwürzen vor.
Einfluss beim Maischen: Beim Maischen besteht der größte Einfluss auf die Freisetzung der Ferulasäure (beim Mälzen nur durch hydrolytischen Pentosanabbau). Günstige Einmaischtemperaturen von 37–47 °C bewirken eine deutliche Erhöhung der Ferulasäure, 44 °C stellt eine optimale Temperatur dar. Durch den Abbau des Arabinoxylans durch die Endo- und Exo-Xylanasen (Optimum 45 °C) und Arabinosidasen (40–45 °C) wird die Ferulasäure freigesetzt. Eine Verringerung des Maische-pH unter 5,7 bewirkt eine Verlangsamung des Abbaus.
Gärung: Obergärige Hefe bildet aus Ferulasäure durch Decarboxylierung den Aromastoff 4-Vinylguajacol, der als typisches Weizenbieraroma gilt und an Gewürznelke erinnert. Bei Weizenbierhefe entsteht es in Konzentrationen von ca. 0,5–3,0 ppm. Die Bildung liegt weniger an den gebräuchlichen Temperaturen von 15–25 °C der Gärung als vielmehr an den verwendeten Gefäßen und Hefeführungen. Eine mehrfache Hefeführung durch Ernte im stehenden zylinderkonischen Gärtank hat einen negativen Einfluss auf die Bildung des 4-Vinylguajacols durch erhöhten statischen Druck, der sich auch allgemein auf die Bildung der Ester und Stress auf die Hefezelle auswirkt. Der wünschenswerte Konzentrationsbereich von 4-Vinylguajacol liegt bei 1,2–1,7 ppm.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu FERULIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. Mai 2020.
- ↑ a b c d e Eintrag zu Ferulasäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. ISBN 978-0-8155-1596-8.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 789.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 385.
- ↑ Tokusoglu Ozlem: Fruit and Cereal Bioactives: Sources, Chemistry, and Applications. CRC Press, 2011, ISBN 978-1-4398-0665-4 (Seite 63 in der Google-Buchsuche).
- ↑ Cesar G. Fraga: Plant phenolics and human health. Wiley, 2009, ISBN 978-0-470-28721-7 (Seite 67 in der Google-Buchsuche).
