6-Phosphogluconat-Dehydrogenase
(Weitergeleitet von 6PGD)
| 6-Phosphogluconat-Dehydrogenase | ||
|---|---|---|

| ||
| 6-Phosphogluconat dehydrogenase dimer, Ovis aries nach PDB 1PGO | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 482 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Namen | PGD ; 6PGD | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.44, Oxidoreduktase | |
| Reaktionsart | Decarboxylierende Dehydrierung | |
| Substrat | 6-Phospho-D-gluconat + NADP+ | |
| Produkte | Ribulose-5-phosphat + CO2 + NADPH/H+ | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 5226 | 110208 |
| Ensembl | ENSG00000142657 | ENSMUSG00000028961 |
| UniProt | P52209 | Q9DCD0 |
| Refseq (mRNA) | NM_001304451 | NM_001081274 |
| Refseq (Protein) | NP_001291380 | NP_001074743 |
| Genlocus | Chr 1: 10.4 – 10.42 Mb | Chr 4: 149.15 – 149.17 Mb |
| PubMed-Suche | 5226 | 110208
|
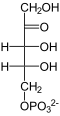
6-Phosphogluconat-Dehydrogenase (6PGD) ist das Enzym, das 6-Phosphogluconat zu Ribulose-5-phosphat umwandelt. Diese Reaktion ist der dritte Teilschritt im Pentosephosphatweg. 6PGD kommt in den meisten Lebewesen vor.[1]
Ein möglicher 6PGD-Mangel aufgrund von Defekten im PGD-Gen verläuft asymptomatisch, selbst wenn weniger als fünf Prozent der normalen Menge am Enzym zur Verfügung steht. Bakterielle 6PGD agiert als Adhäsin.[2][3]
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]6-Phosphogluconat wird zur Ketosäure dehydriert, wobei NADPH entsteht. Die Ketosäure zerfällt unter Abgabe von Kohlenstoffdioxid zu Ribulose-5-phosphat.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Wikibooks: Biochemie und Pathobiochemie: Hexosemonophosphatweg – Lern- und Lehrmaterialien
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ UniProt P52209, PROSITE: PROSITE documentation PDOC00390 (englisch)
- ↑ 6-Phosphogluconat-Dehydrogenase. In: Online Mendelian Inheritance in Man. (englisch).
- ↑ Tan C, Fu S, Liu M, et al: Cloning, expression and characterization of a cell wall surface protein, 6-phosphogluconate-dehydrogenase, of Streptococcus suis serotype 2. In: Vet. Microbiol. 130. Jahrgang, Nr. 3–4, August 2008, S. 363–70, doi:10.1016/j.vetmic.2008.02.025, PMID 18403138.