Desloratadin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
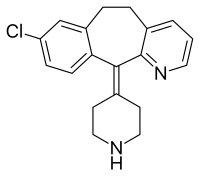
| Freiname | Desloratadin | |||||||||||||||||||||
| Andere Namen |
8-Chlor-11-(piperidin-4-yliden)-5,6-dihydro-11H-benzo[5,6]cyclohepta[1,2-b]pyridin (IUPAC) | |||||||||||||||||||||
| Summenformel | C19H19ClN2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 310,82 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Desloratadin ist ein Arzneistoff aus der Gruppe der Antihistaminika, der zur Behandlung der allergischen Rhinitis und Urtikaria eingesetzt wird.[3] Desloratadin ist ein Abkömmling und Metabolit des Antihistaminikums Loratadin und wurde in Deutschland von dem Pharmaunternehmen Essex Pharma, einer Schering-Plough-Tochter, mit dem Auslaufen des Patentschutzes für Loratadin auf den Markt gebracht.
Zulassung und Vermarktung
[Bearbeiten | Quelltext bearbeiten]Desloratadin wurde im Januar 2001 EU-weit unter den Namen Aerius als verschreibungspflichtiges Arzneimittel zugelassen zur Besserung der Symptomatik bei saisonaler allergischer Rhinitis bei Erwachsenen und Jugendlichen ab 12 Jahren. Es löste das Vorläufer-Präparat Lisino (Loratadin) ab, dessen Patentschutz 2001 auslief und vom Schering-Plough vom Markt genommen wurde.[4] Das Anwendungsgebiet von Aerius wurde später um die chronische idiopathische Urtikaria (2001) bzw. Urtikaria (2008) sowie allergische Rhinitis (2002) erweitert.[5] Nach dem Auslaufen des Patentschutzes von Desloratadin 2012[6] kamen erste Generika auf den Markt.
Im Jahr 2013 beantragte ein Generikahersteller beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Desloratadin in Deutschland aus der Verschreibungspflicht zu entlassen. Der zuständige Sachverständigen-Ausschuss sprach sich auch für die Entlassung aus,[7] jedoch wurde sie erst 2019 gegenüber dem BMG auf dem gerichtlichen Weg erstritten. Seit dem 22. Februar 2020[8] ist Desloratadin in Deutschland „in der oralen Anwendung zur symptomatischen Behandlung bei allergischer Rhinitis und Urtikaria bei Erwachsenen, Jugendlichen und Kindern ab zwei Jahren, es sei denn, es handelt sich um von der Europäischen Kommission als verschreibungspflichtig zugelassene Arzneimittel“ von der Verschreibungspflicht ausgenommen und dadurch auch als rezeptfreies Medikament (sog. OTC-Medikament) zu kaufen.[9]
In anderen Staaten gelten deren nationale Vorschriften.
Die mit der Übernahme von Schering-Plough an Merck, Sharp & Dohme (MSD) übergegangene Zulassung von Aerius wurde 2021 auf Organon übertragen.[10]
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Der Wirkmechanismus von Desloratadin entspricht dem des Loratadins. Als H1-Antihistaminikum blockiert es die speziellen Bindungsstellen für Histamin, die Histamin-H1-Rezeptoren, und hemmt somit die Histaminwirkungen (z. B. Hautrötung, Juckreiz, Blutdruckabfall und Bronchospasmen); weiterhin stabilisiert Desloratadin aber auch die Mastzellen, wodurch die Freisetzung von Histamin blockiert wird. Desloratadin wirkt zudem als funktioneller Hemmer der sauren Sphingomyelinase (FIASMA).[11]
Vergleich mit Loratadin
[Bearbeiten | Quelltext bearbeiten]Im Unterschied zu Loratadin hat Desloratadin eine drei- bis vierfach höhere Affinität zum H1-Rezeptor. Daher kann Loratadin formal als Prodrug des Desloratadins angesehen werden. Darüber hinaus hat Desloratadin eine längere Plasmahalbwertszeit. Gemeinsam ist beiden Substanzen die Eigenschaft, dass an der Blut-Hirn-Schranke ein Rücktransport durch P-Glykoproteine erfolgt,[12] sodass sowohl Loratadin als auch Desloratadin nur begrenzt in das Zentralnervensystem gelangen und dort weniger Nebenwirkungen wie z. B. Schläfrigkeit (Sedierung) verursachen können. Sie zählen daher beide zu den Antihistaminika der zweiten Generation.
Ein therapeutischer Vorteil von Desloratadin wird als marginal eingestuft, da auch Loratadin in der Leber nahezu vollständig in Desloratadin umgewandelt wird.[13] Die zeitliche Nähe zwischen dem Wegfall des Patentschutzes für Loratadin und der Markteinführung von Desloratadin legt nahe, dass auch dies ein Grund für dessen Einführung war.[14]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Aerius (EU, CH), Desloraderm (D), Desloratadin Glenmark, Desloratadin-Actavis, Dasselta (D, A), Deslora Denk, Desloratadin Heumann, Desloratadin-1 A Pharma[15]
- mit Pseudoephedrin: Aerinaze (EU)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Pharmazeutische Zeitung: Desloratadin | Aerius® | 07|2001
- Zentral zugelassene Desloratadin-Arzneimittel auf der Website der Europäischen Arzneimittelagentur (Europäischer Öffentlicher Beurteilungsbericht, EPAR)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 13-chloro-2-(piperidin-4-ylidene)-4-azatricyclo[9.4.0.0³,⁸]pentadeca-1(15),3,5,7,11,13-hexaene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. Januar 2020.
- ↑ Datenblatt 8-Chloro-11-(piperidin-4-ylidene)-6,11-dihydro-5H-benzo[5,6]cyclohepta[1,2-b]pyridine (PDF) bei BLD Pharmatech, Katalognummer: BD123824, abgerufen am 29. September 2024.
- ↑ Chronisch idiopathische Urtikaria: Desloratadin stoppt juckende Quaddeln, www.deutsche-apotheker-zeitung.de, 17. November 2002.
- ↑ Antiallergikum Loratadin (Lisino u.a.): Preisgünstigere Nachfolgepräparate, a-t, 13. Juni 2001.
- ↑ Procedural steps taken and scientific information, EMA, abgerufen am 8. März 2023.
- ↑ Ulrich Schwabe, Dieter Paffrath (Hrsg.): Arzneiverordnungs-Report 2014. Springer, Berlin/Heidelberg 2014, S. 237.
- ↑ Ergebnisprotokoll der 70. Sitzung (25. Juni 2013), BfArM, 8. Oktober 2013.
- ↑ Desloratadin jetzt auch ohne Rezept erhältlich, Kassenärztliche Vereinigung Baden-Württemberg, 20. März 2020.
- ↑ Desloratadin gibt es künftig auch ohne Rezept, DAZ, 20. Februar 2020.
- ↑ Commission Implementing Decision, EU-Kommission, 10. Mai 2021 (PDF).
- ↑ Kornhuber J, Muehlbacher M, Trapp S, Pechmann S, Friedl A, Reichel M, Mühle C, Terfloth L, Groemer T, Spitzer G, Liedl K, Gulbins E, Tripal P: Identification of novel functional inhibitors of acid sphingomyelinase. In: PLoS ONE. 6. Jahrgang, Nr. 8, 2011, S. e23852, doi:10.1371/journal.pone.0023852.
- ↑ Cuiping Chen, Elizabeth Hanson, John W. Watson, Jae S. Lee: P-glycoprotein limits the brain penetration of nonsedating but not sedating H1-antagonists. In: Drug Metabolism and Disposition: The Biological Fate of Chemicals. Band 31, Nr. 3, März 2003, S. 312–318, doi:10.1124/dmd.31.3.312, PMID 12584158.
- ↑ Ulrich Schwabe, Dieter Paffrath: Arzneiverordnungs-Report 2004: Aktuelle Daten, Kosten, Trends und Kommentare. Springer, 2004, ISBN 3-540-21359-7.
- ↑ Antje-Christina Raasch: Der Patentauslauf von Pharmazeutika als Herausforderung beim Management des Produktlebenszyklus. Springer, 2006, ISBN 978-3-8350-0632-4, Strategie und Erfolgsfaktoren beim Patentauslauf des Antihistaminikums Lisino von essex pharma, S. 211–225.
- ↑ Ulrich Schwabe, Dieter Paffrath, Wolf-Dieter Ludwig, Jürgen Klauber: Arzneiverordnungs-Report 2018. Springer-Verlag, 2018, ISBN 978-3-662-57386-0, S. 305.