Oxazolone
Oxazolone sind ungesättigte Fünfring-Heterocyclen, die neben einem Sauerstoff- und einem Stickstoffatom eine Carbonylgruppe im Ring aufweisen. Zu den Oxazolonen gehören die Azlactone (1,3-Oxazol-5(4H)-one), bei denen sich die Carbonylgruppe benachbart zum Sauerstoffatom befindet und die somit zu den cyclischen Estern (Lactone) zählen. Die 1,2-Oxazolone werden auch als Isoxazolone bezeichnet.
Struktur
[Bearbeiten | Quelltext bearbeiten]Abhängig von der Position der beiden Heteroatome, der Carbonylgruppe und der Doppelbindung lassen sich verschiedene Oxazolon-Grundstrukturen formulieren.
| Oxazolone | |||
|---|---|---|---|

|

|

| |

|

|

| |

|
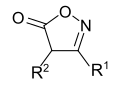
|

| |
Synthese
[Bearbeiten | Quelltext bearbeiten]2-Aminocarbonsäuren 1 (R1 = H, Alkyl, Aryl etc.) reagieren mit Carbonsäurechloriden (R2 = Alkyl, Aryl etc.) zu N-Acylcarbonsäuren 2. Letztere lassen sich unter Wasserabspaltung zu inneren Estern (Azlactonen) 3 cyclisieren:[1]
Statt eines Aminosäurechlorids kann die Acylierung von 1 auch mit einem Carbonsäureanhydrid erfolgen.[1]
Ein weiterer Zugang zu Azlactonen ist die Erlenmeyer-Plöchl-Azolactonsynthese.[2][3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Azlactone werden zur Herstellung von Peptiden bei der Bergmann-Azlacton-Synthese eingesetzt.[4] Einige am Stickstoffatom substituierte Oxazolone sind mesoionischen Verbindungen, beispielsweise die Münchnone.[5]
Literatur
[Bearbeiten | Quelltext bearbeiten]- azlactones. In: Alan D. McNaught, Andrew Wilkinson, IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. 2. Auflage. Blackwell Scientific Publications, Oxford 1997, ISBN 0-9678550-9-8, S. 1321, doi:10.1351/goldbook.A00559 (englisch, korrigierte Fassung – erstellt von M. Nic, J. Jirat, B. Kosata; mit Aktualisierungen von A. Jenkins [2006–]).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 508, ISBN 3-342-00280-8.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Ltd, 2010, ISBN 978-0-470-63885-9, Erlenmeyer-Plöchl Azlactone Synthesis, S. 997–1000, doi:10.1002/9780470638859.conrr217.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 53, 1982, ISBN 3-527-25892-2.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Ltd, 2010, ISBN 978-0-470-63885-9, Bergmann-Stern Azlactone Synthesis, S. 353–357, doi:10.1002/9780470638859.conrr077.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 671.
