Fibroblasten-Wachstumsfaktor
Die Fibroblasten-Wachstumsfaktoren (Abk. FGF, von engl. Fibroblast Growth Factor) sind eine Gruppe von Wachstumsfaktoren, die als FGF-Familie bezeichnet wird. Insgesamt sind bis heute 23 Mitglieder der FGF-Gruppe bekannt: FGF-1 bis FGF-23.
FGFs sind Ein-Ketten-Polypeptide mit einer Masse meistens zwischen 16 und 22 kDa. Sie gehören zu den Signalproteinen, die wichtige und potente Regulatoren des Zellwachstums und der Differenzierung von Zellen darstellen. Sie spielen eine Schlüsselrolle bei der embryonalen Entwicklung. Entsprechend führen Störungen der FGF-Funktionen zu schweren Entwicklungsstörungen in der Embryonalzeit. Im adulten Organismus steuern FGFs gewebsreparative Prozesse und sind aktiv eingebunden in die Vorgänge der Wundheilung und der Neubildung von Gefäßen (Angiogenese), sowie in die Regeneration von Nerven und Knorpelgewebe. FGFs sind in fast allen Geweben des Organismus nachgewiesen worden.
FGFs steuern und verändern (i. d. R. stimulieren) die Proliferation (Vermehrung), Migration (Wanderung) und Differenzierung von Zellen, insbesondere von Endothelzellen, aber auch von Muskelzellen (besonders glatte Muskelzellen) und Fibroblasten. Der komplexe Prozess der Angiogenese wird wesentlich von Wachstumsfaktoren der FGF-Familie gesteuert und beeinflusst. Prototypen der FGF-Familie sind FGF-1 (acidic-FGF) und FGF-2 (basic-FGF).[1]
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]FGF-Moleküle binden an ihre spezifischen Rezeptoren (FGFR = FGF-Rezeptor) an der Zelloberfläche. FGFRs sind Rezeptor-Tyrosinkinasen, die – nach Bindung des Liganden FGF – mittels Autophosphorylierung aktiviert werden und intrazellulär eine Signalkaskade mit nachfolgender Genaktivierung in Gang setzen. FGFRs bestehen aus einer extrazellulären Region, die drei immunglobulin-ähnliche (IG-like) Proteindomänen besitzen (D1-D3), einer singulären transmembranösen Helix, und einer intrazellulären Proteindomäne mit Tyrosin-Kinase Aktivität.[2] Es existieren vier FGFRs: FGFR1, FGFR2, FGFR3, FGFR4. Durch alternatives mRNA-Spleißen der Rezeptoren FGFR1-3 entstehen zusätzliche Formen der FGFRs (insgesamt sind sieben FGFRs bekannt), die mit „b“ und „c“ bezeichnet werden.[3] FGF-1 ist der einzige Ligand, der an alle sieben Rezeptoren der Zelloberfläche bindet. Der nach Bindung von FGF und FGFR entstehende eigentliche Signalkomplex an der Zellmembran wird als ternary complex bezeichnet, der aus zwei identischen FGF-Liganden, zwei identischen FGF-Rezeptor-Einheiten und entweder einer oder zwei Heparansulfat-Ketten besteht.[4]
Eine besondere Eigenschaft des Wirkmechanismus der FGFs besteht darin, dass er durch die besonders hohe Affinität der FGFs zu Proteoglycanen, Heparansulfaten und Heparin (Glykosaminoglycan) wesentlich verstärkt wird. Deshalb wurden die Wachstumsfaktoren der FGF-Familie früher auch als heparin-binding growth factors (HBGFs) bezeichnet.
FGFs werden physiologisch bei jeder Form der Gewebeschädigung, ganz besonders jedoch bei Hypoxie und Ischämie (up-regulation), aktiv sezerniert.

FGF-Familie
[Bearbeiten | Quelltext bearbeiten]FGF-1 (a-FGF) ist der aktivste Wachstumsfaktor der FGF-Familie. Er besteht aus 141 Aminosäuren.[5] Das FGF-1-codierende Gen ist auf dem Chromosom 5 lokalisiert. Durch seine umfassende Bindungskapazität mit allen FGF-Rezeptoren sind die biologischen, mitogenen Zelleffekte besonders ausgeprägt und durch die Initiierung von Zellproliferation, Migration und Differenzierung gekennzeichnet. FGF-1 wirkt ganz besonders auf Endothelzellen, aber auch auf viele andere Zelltypen. Aufgrund der besonders ausgeprägten angiogenetischen Aktivität von FGF-1 wurde FGF-1 neuerdings intensiver in der klinischen Forschung untersucht und in verschiedenen klinischen Studien in der Humanmedizin eingesetzt.[6] Die Plasmahalbwertszeit von FGF-1 nach intramyokardialer Injektion liegt zwischen 0,4 und 4,6 Stunden.
FGF-2 (b-FGF) weist eine ähnliche Molare Masse wie FGF-1 auf; die Struktur stimmt zu mehr als 50 % mit der von FGF-1 überein. Das FGF-2 codierende Gen ist auf dem Chromosom 4 lokalisiert. Die Wirkungen von FGF-2 sind denen von FGF-1 ähnlich, jedoch nicht ganz so intensiv ausgeprägt. Es wird unter anderem auch von Adipozyten gebildet und beeinflusst den Knochenstoffwechsel.[7]
FGF-3 besteht aus 240 Aminosäuren, seine Struktur ist zu ca. 40 % homolog mit FGF-1; das codierende Gen ist auf dem Chromosom 11 lokalisiert. Die physiologischen Wirkungen von FGF-3 sind noch wenig bekannt, möglicherweise jedoch ist FGF-3 besonders wichtig während der Embryonalzeit.
FGF-4 (früher K-FGF oder hst1) besteht aus 206 Aminosäuren, ist zu 40 % homolog mit der Struktur von FGF-1-3, und das codierende Gen liegt auf dem Chromosom 11. FGF-4 wird häufig in Tumoren gefunden, besonders in Magentumoren. In gesunden adulten Geweben kommt FGF-4 nur in geringer Konzentration vor.
FGF-5 besteht aus 251 Aminosäuren, das codierende Gen ist auf dem Chromosom 4 lokalisiert. FGF-5 spielt offenbar während der embryonalen Entwicklung eine wichtige (u. a. angiogene) Rolle, auch im Haarwachstum, in adulten Geweben kommt FGF-5 jedoch nur in sehr geringen Konzentrationen vor.
FGF-6 (früher hst2) ist zu 70 % homolog mit FGF-4. Das codierende Gen ist auf dem Chromosom 12 lokalisiert. Wenig ist über seine Wirkungen bekannt, möglicherweise spielt FGF-6 bei der Wundheilung eine Rolle.
FGF-7 wurde zuerst als Keratinozyten-Wachstumsfaktor (KGF) bezeichnet; es hat eine spezielle proliferative Wirkung auf Epithelzellen. Das codierende Gen liegt auf dem Chromosom 15.
FGF-8 (Genlokalisation auf Chromosom 10) spielt möglicherweise eine Schlüsselrolle bei der Ausbildung der Extremitäten während der Embryonalzeit.
FGF-9, zunächst als glioma-derived growth factor (GDGF) bezeichnet, stimuliert insbesondere die Proliferation und Aktivierung von Gliazellen im Gehirn.
FGF-10 bis FGF-22: Obwohl die Strukturen und Aminosäuresequenzen dieser Wachstumsfaktoren beschrieben sind, ist wenig über die detaillierten Funktionen dieser Proteine bekannt.[1] FGF-18 regt in Modellorganismen bei intraartikulärer Injektion die Bildung von Knorpel an. Ein rekombinant produziertes humanes FGF-18 befindet sich in der klinischen Erprobung.
FGF-23 wird von Osteozyten sezerniert und ist ein wichtiger Regulatur des Phosphat- und Vitamin-D-Haushaltes. FGF-23 stimuliert die Ausscheidung von Phosphat durch die Nieren. Aufgabe von FGF-23 ist es, die Phosphat-Spiegel im Blut trotz unterschiedlicher Phosphatzufuhr mit der Nahrung konstant zu halten. Erhöhte Blutspiegel von FGF-23 führen zu einem Abfall des Phosphatspiegels im Blut (Hypophosphatämie), verminderter Produktion von 1,25(OH)2-Vitamin D und Rachitis bzw. Knochenerweichung (Osteomalazie). Verminderte Blutspiegel von FGF-23 führen zu erhöhten Phosphatspiegeln im Blut (Hyperphosphatämie), erhöhter Produktion von 1,25(OH)2-Vitamin D, Weichteilverkalkungen, überschießender Knochenbildung (Hyperostose) und verminderter Lebenserwartung.[8] Bei Nierenkranken, die mit der Dialysebehandlung beginnen müssen, sind erhöhte FGF-23 Spiegel mit einer erhöhten Sterblichkeit (Mortalität) assoziiert.[9] FGF-23 bindet an den FGF-Rezeptor 1c und den Korezeptor Klotho. Aktivierung dieses Rezeptorkomplexes im proximalen Tubulus im Nephron der Niere inhibiert die Re-Absorption von Phosphat aus dem Primärharn und wirkt somit phosphorurisch und hypophosphatämisch. Dies erfolgt durch eine reduzierte Expression der Natrium-Phosphat-Kotransporter NaPi-IIa und NaPi-IIc. Selten können Tumoren FGF-23 produzieren, und dadurch eine tumorbedingte (onkogene) Osteomalazie als Paraneoplastisches Syndrom auslösen.[10]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die ersten FGFs wurden in den 1970er Jahren entdeckt und ihre chemischen Strukturen beschrieben. Zunächst nahm man an, dass sie ausschließlich auf Fibroblasten wirken (daher der Name). Später fand man jedoch heraus, dass FGFs viel allgemeinere Funktionen – besonders Proliferation und Differenzierung – haben, und auf fast alle Zellen wirken können. Heute sind sogar FGFs bekannt, die keinerlei Wirkung auf Fibroblasten haben, z. B. FGF-7 und FGF-9. FGF-1 und FGF-2 wurden zunächst aus dem Gehirn von Rindern gewonnen und isoliert,[11][12][13] später wurden auch die Strukturen der humanen Wachstumsfaktoren FGF-1 und FGF-2 beschrieben.[14][15]
Schon frühzeitig wurde die verstärkende Wirkung von Heparin und Heparansulfaten auf die Funktion der FGFs erkannt.[16] Bis heute (2007) sind 23 verschiedene Sub-Typen der FGF-Familie beschrieben.
Funktionen und medizinische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Die verschiedenen FGF-Typen haben intensive mitogene Aktivitäten und sind von großer Bedeutung für die Organdifferenzierung und Entwicklung in der Embryonalzeit. Sie regulieren die Zellproliferation, -migration und -differenzierung. Eine reguläre Zell- und Gewebsdifferenzierung ohne FGFs ist nicht möglich. In adulten Geweben und Organen haben FGFs – allen voran FGF-1 – eine ausgesprochen intensive Aktivität hinsichtlich der Induktion der Angiogenese. Diese Eigenschaft der FGFs hat in jüngerer Zeit das Interesse der medizinischen Forschung geweckt, da Angiogenese als therapeutisches Prinzip bei solchen Krankheitszuständen und Störungen zur Anwendung kommen kann, bei denen einer Störung der arteriellen Durchblutung (Arteriosklerose) vorliegt, z. B. Koronare Herzkrankheit (KHK) und periphere arterielle Verschlusskrankheit (PAVK).[17][18][19] Hypoxie und Ischämie triggern die Sekretion von FGF-1 und FGF-2, so dass es zu einer up-regulation der FGF-Rezeptoren im Gewebe kommt. Die durch die Bindung von FGF und FGFR hervorgerufene Induktion der Angiogenese kann im Sinne eines Reparaturprozesses verstanden werden, der durchblutungsverbessernd wirkt. Klinische Studien mit Patienten, die an schwerer koronarer Herzkrankheit litten, konnten FGF-1 induzierte neue Gefäße im menschlichen Herzmuskel, sowie eine lokale Durchblutungssteigerung mit Minderung von Angina pectoris Symptomen nachweisen.[6] [20][21][22] Auch bei Störungen der Wundheilung, z. B. bei diabetischen Ulcera, wirken FGFs, besonders FGF-1, wundheilungsfördernd. Tierexperimentell konnte sogar eine das Ausmaß eines Schlaganfalles deutlich reduzierende Wirkung von FGF-1 nachgewiesen werden.
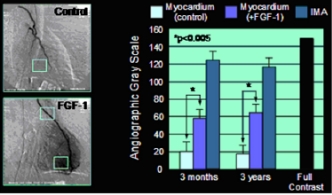
Beispiel für FGF-1 induzierte Angiogenese im menschlichen Herzmuskel. Links, angiographische Darstellung des neu gebildeten Gefäßnetzes im Bereich der Vorderwand des linken Ventrikels. Rechts, Grauwert-Analyse zur Quantifizierung des angiogenetischen Effekts.
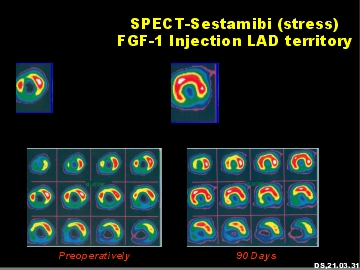
Stress-SPECT-Analyse des menschlichen Herzmuskels nach intramyokardialer FGF-1 Applikation. Links, vor FGF-1 Behandlung. Rechts, drei Monate nach Behandlung.
Aufgrund der breiten mitogenen Aktivität der FGFs werden diese in der aktuellen klinischen Forschung auch untersucht hinsichtlich ihrer positiven Wirkung auf die Osteoporose (Aktivierung der Osteoblasten durch FGF-1) und hinsichtlich ihres Reparaturpotentials bei Knorpelschäden (Arthrose). Auch können FGF-1 und (geringer) auch FGF-2 möglicherweise eine Stimulation von sogenannten Herz-Progenitorzellen (cardiac progenitor cells) im Sinne einer Ausreifung dieser lokalen, im Myokard vorhandenen, Herzmuskel-Vorläuferzellen zu adulten Kardiomyozyten bewirken. Schließlich liegt ein weiteres klinisches Potenzial von FGF-1 in seiner Fähigkeit zur Regenerierung von Nervenzellen.[23]
Da FGFs auch in erhöhter Konzentration in vielen Tumoren vorkommen und dort an der Tumorangiogenese beteiligt sind, richten sich Forschungen zur anti-angiogenetischen Tumortherapie[24] auch auf eine Inhibierung der angiogenetischen Aktivität der FGFs.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b G. M. Rubanyi (Editor): Angiogenesis in health and disease. M. Dekker, Inc., New York – Basel, 2000
- ↑ P. L. Lee u. a.: Purification and complementary DNA cloning of a receptor for basic fibroblast growth factor. In: Science 245, 1989, S. 57–60. PMID 2544996
- ↑ D. M. Ornitz u. a.: Receptor Specificity of the Fibroblast Growth Factor Family. In: J Biol Chem 271, 1996, S. 15292–15297. PMID 8663044
- ↑ D. M. Ornitz und N. Itoh: Fibroblast growth factors. In: Genome Biol 2, 2001, S. 1–12. PMID 11276432, PMC 138918 (freier Volltext)
- ↑ Blaber, M., DiSalvo, J. Thomas, K.A.: X-ray crystal structure of human acidic fibroblast growth factor. In: Biochemistry 35, 1996, S. 2086–2094. PMID 8652550
- ↑ a b T. J. Stegmann: A human growth factor in the induction of neoangiogenesis. In: Exp Opin Invest Drugs 7, 1998, S. 2011–2015. PMID 15991943
- ↑ Kühn MC, Willenberg HS, Schott M, Papewalis C, Stumpf U, Flohé S, Scherbaum WA, Schinner S: Adipocyte-secreted factors increase osteoblast proliferation and the OPG/RANKL ratio to influence osteoclast formation. In: Mol Cell Endocrinol. 349. Jahrgang, Nr. 2, 2012, S. 180–188, doi:10.1016/j.mce.2011.10.018, PMID 22040599.
- ↑ Shiguang Liu und L. Darryl Quarles: How Fibroblast Growth Factor 23 Works. In: J Am Soc Nephrol. Nr. 18, 2007, S. 1637–1647 (Artikel).
- ↑ O. M. Gutierrez u. a.: Fibroblast Growth Factor 23 and Mortality among Patients Undergoing Hemodialysis. In: N Engl J Med. Nr. 359, 2008, S. 584–592 (Abstract).
- ↑ Clemens Bergwitz, Michael T. Collins, Ravi S. Kamath: Case 33-2011 — A 56-Year-Old Man with Hypophosphatemia. New England Journal of Medicine 2011, Band 365, Ausgabe 17 vom 27. Oktober 2011, Seiten 1625–1635, doi:10.1056/NEJMcpc1104567
- ↑ D. Gospodarowicz u. a.: Purification of a growth factor for ovarian cells from bovine pituitary glands. In: PNAS 71, 1974, S. 2295–2299. PMID 4526208. PMC 388439 (freier Volltext)
- ↑ D. Gospodarowicz: Localisation of a fibroblast growth factor and its effect alone and with hydrocortisone on 3T3 cell growth. In: Nature 249, 1974, S. 123–127. PMID 4364816
- ↑ D. Gospodarowicz: Purification of a fibroblast growth factor from bovine pituitary. In: J Biol Chem 250, 1975, S. 2515–2520. PMID 1168187
- ↑ G. Gimenez-Gallego u. a.: The complete amino acid sequence of human brain-derived acidic fibroblast growth factor. In: Biochem Biophys Res Commun 138, 1986, S. 611–617. PMID 3527167
- ↑ G. Gimenez-Gallego u. a.: Human brain-derived acidic and basic fibroblast growth factors: amino terminal sequences and specific mitogenic activities. In: Biochem Biophys Res Commun 135, 1986, S. 541–548. PMID 3964259
- ↑ S. C. Thornton u. a.: Human endothelial cells: use of heparin in cloning and long-term serial cultivation. In: Science 222, 1983, S. 623–625. PMID 6635659
- ↑ J. Folkman: Angiogenic therapy of the heart. In: Circulation 97, 1998, S. 628–629. PMID 9495294
- ↑ M. Simons u. a.: Clinical trials in coronary angiogenesis: issues, problems, consensus: an expert panel summary. In: Circulation 102, 2000, S. E73–E86. PMID 10982554
- ↑ R. Khurana und M. Simons: Insights from angiogenesis trials using fibroblast growth factor for advanced arteriosclerotic disease. In: Trends Cardiovasc Med 13, 2003, S. 116–122. PMID 12691676
- ↑ T. J. Stegmann, und T. Hoppert: Combined local angiogenesis and surgical revascularization for coronary heart disease. In: Current Intervent Cardiol Reports 1, 1999, S. 172–178. PMID 11096622
- ↑ T. J. Stegmann u. a.: Therapeutic angiogenesis: intramyocardial growth factor delivery of FGF-1 as sole therapy in patients with chronic coronary artery disease. (PDF; 449 kB) In: CVR 1, 2000, S. 259–267.
- ↑ L. E. Wagoner u. a.: Angiogenesis Protein Therapy With Human Fibroblast Growth Factor (FGF-1): Results Of A Phase I Open Label, Dose Escalation Study In Subjects With CAD Not Eligible For PCI Or CABG. In: Circulation 116, 2007, S. 443.
- ↑ J. M. A. Laird u. a.: Acidic Fibroblast growth factor stimulates motor and sensory axon regeneration after sciatic nerve crush in the rat. In: Neuroscience 65, 1995, S. 209–216. PMID 7538644
- ↑ J. Folkman: Fighting cancer by attacking its blood supply. In: Sci Am 275, 1996, S. 150–154. PMID 8701285