β-Carboline
β-Carboline sind eine Stoffgruppe von mehr als hundert Alkaloiden und synthetischen Verbindungen mit einer β-Carbolin-Grundstruktur (9H-Pyrido[3,4-b]indol). Die Wirkungen dieser Stoffe hängen von ihrem jeweiligen Substituenten ab. Natürliche β-Carboline beeinflussen dabei primär die Gehirnfunktion, können aber auch antioxidativ wirken.[1] Synthetisch hergestellte Derivate von β-Carbolinen weisen wiederum neuroprotektive,[2] kognitionsfördernde und krebshemmende Eigenschaften auf.[3]
Struktur
[Bearbeiten | Quelltext bearbeiten]β-Carboline gehören zur Gruppe der Indolalkaloide. Sie bestehen aus einem Pyridinring, der an ein Indolgerüst gebunden ist. Ihre Struktur ähnelt der von Tryptamin und Serotonin. Es wird angenommen, dass diese Indole die Vorstufen der β-Carboline sind.[4] Im Pyridinring sind unterschiedliche Sättigungsgrade – Dihydro- und Tetrahydropyridin – möglich.
| Beispiele für verschiedene β-Carboline | |||||
|---|---|---|---|---|---|
 | |||||
| Name | R1 | R6 | R7 | R9 | Struktur |
| β-Carbolin (Norharman) | H | H | H | H | 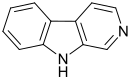 |
| Pinolin | H | OCH3 | H | H |  |
| Harman | CH3 | H | H | H | 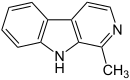 |
| Harmin | CH3 | H | OCH3 | H |  |
| Harmalin | CH3 | H | OCH3 | H | 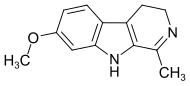 |
| Harmalol | CH3 | H | OH | H |  |
| Tetrahydroharmin | CH3 | H | OCH3 | H |  |
| 9-Methyl-β-carbolin | H | H | H | CH3 |  |
Wirkweise
[Bearbeiten | Quelltext bearbeiten]Die pharmakologische Wirkung verschiedener β-Carboline hängt von ihren jeweiligen Substituenten ab.
Das natürliche β-Carbolin Harmin hat beispielsweise Veränderungen an den Positionen 1 und 7. Dadurch wirkt es hemmend auf die Proteinkinase DYRK1A, welche für die Gehirnentwicklung notwendig ist.[5][6] Zudem legen tierexperimentelle Untersuchungen nahe, dass Harmin antidepressiv wirkt. Zum einen stimuliert es den Serotoninrezeptor Subtyp 2A,[7][8] zum anderen erhöht es die Konzentration des Brain-Derived Neurotrophic Factor (BDNF) im Hippocampus der Ratte.[8][9] Ein niedriger BDNF-Spiegel wurde beim Menschen mit der Entstehung von schweren Depressionen in Verbindung gebracht. Die antidepressive Wirkung von Harmin könnte zudem auf die Hemmung des Enzyms Monoaminoxidase-A (MAO-A) zurückzuführen sein, wodurch es den Abbau von Serotonin, Dopamin und Noradrenalin reduziert.[9][10]
Synthetische β-Carboline mit Veränderungen in Position 3 weisen wiederum eine andere Wirkweise auf. Sie reduzieren die Wirkung von Benzodiazepinen auf GABA-A Rezeptoren und können dadurch krampfartige, angstauslösende und gedächtnisfördernde Effekte haben.[11] Darüber hinaus kann 3-Hydroxymethyl-beta-carbolin bei Nagetieren das Schlafbedürfnis dosisabhängig vermindern und die schlaffördernde Wirkung von Flurazepam blockieren.[12] Das Derivat Methyl-β-carbolin-3-carboxylat hingegen stimuliert in niedrigen Dosen das Lernen und Gedächtnis, kann jedoch in hohen Dosen Angstzustände und Krämpfe hervorrufen.[13] Bei Veränderung in Position 9 wurden ähnliche positive Effekte auf das Lernen und Gedächtnis beobachtet, jedoch ohne Angst oder Krämpfe hervorzurufen.[14]
So wirkt das synthetische Carbolin-Derivat 9-Methyl-β-Carbolin schützend auf Nervenzellen durch Erhöhung der Expression neurotropher Faktoren und Verstärkung der Atmungskettenaktivität.[15][16] Es konnte zudem nachgewiesen werden, dass dieses Derivat kognitive Leistungen verbessert,[17] die Anzahl dopaminerger Neurone erhöht und die Ausbildung von Synapsen und dendritischen Nervenfasern fördert.[18][19] Letzteres dürfte maßgeblich zur Verbesserung von Gedächtnisleistungen beitragen. In Tiermodellen konnten außerdem therapeutische Wirkungen gegen die Parkinson-Krankheit und andere neurodegenerative Prozesse nachgewiesen werden.[20]
Da β-Carboline auch mit verschiedenen krebsrelevanten Molekülen wie DNA, Enzymen (GPX4, Kinasen usw.) und Proteinen (ABCG2/BRCP1 usw.) interagieren, werden sie auch als potenzielle Krebstherapeutika diskutiert.[3]
Bestimmte β-Carbolin-Derivate steigern auch die Produktion des Antibiotikums Reveromycin A in bodenbewohnenden „Streptomyces“-Arten.[21][22] Hierbei wird die Expression biosynthetischer Gene durch Bindung des β-Carbolins an einen ATP-bindenden Regulator der LuxR-Familie erleichtert.
Ein von Lactobacillus spp. abgesondertes β-Carbolin (1-Acetyl-β-Carbolin) verhindert, dass der pathogene Pilz Candida albicans in eine virulentere Wachstumsform übergeht (filamentöse Wachstumsform). Hierdurch kehrt das β-Carbolin Ungleichgewichte in der Zusammensetzung des Mikrobioms um, was Pathologien wie vaginale Candidiasis oder Pilzsepsis verursachen können.[23]
Medizinische Verwendung von β-Carbolinen
[Bearbeiten | Quelltext bearbeiten]Der Extrakt Ayahuasca der Liane Banisteriopsis caapi wurde von indigenen Stämmen des Amazonasgebiets als entheogen („näher zu den Göttern“) verwendet. Nachdem Ayahuasca Mitte des 19. Jahrhunderts als Halluzinogen beschrieben wurde, identifizierten europäische Apotheker im frühen 20. Jahrhundert das Harmin als den zentralen Wirkstoff.[24] Diese Entdeckung weckte das Interesse, das Potenzial von Harmin als Medizin weiter zu untersuchen. Der bekannte Pharmakologe Louis Lewin zeigte beispielsweise eine deutliche Verbesserung neurologischer Symptome bei Patienten mit postenzephalitischem Parkinson nach Injektionen von B. caapi. Extrakt[25]. Es herrschte allgemeine Einigkeit, dass sich Hypokinesie, vermehrter Speichelfluss, Stimmung und vereinzelt Muskelsteife durch die Behandlung mit Harmin verbesserten. Insgesamt wurden in den zwanziger und dreißiger Jahren diesbezüglich 25 Studien mit Patienten mit der Parkinson-Krankheit und postenzephalitischem Parkinson veröffentlicht. Die pharmakologische Wirkung von Harmin wurde dabei hauptsächlich seiner Eigenschaft als Hemmstoff der Monoaminoxidase (MAO) zugeschrieben. Studien in Nagern konnten zeigen, dass Extrakte von Banisteriopsis caapi und Peganum harmala zu einer Dopaminfreisetzung im Striatum führen.[26][27][28] Harmin fördert zudem das Überleben dopaminerger Neurone in Mäusen, bei denen durch Injektion des Neurotoxins MPTP Parkinson-ähnliche Symptome induziert wurden.[29] Da Harmin auch N-Methyl-d-Aspartat(NMDA)-Rezeptoren antagonisiert,[30] führten einige Forscher die schnelle Besserung bei Patienten mit Parkinson-Krankheit auf diese antiglutamaterge Wirkung zurück.[25] Die weitere Forschung konzentrierte sich nach deren Entdeckung auf synthetische Anticholinergika, wodurch Harmin vorerst in den Hintergrund rückte.[25]
Natürliches Vorkommen
[Bearbeiten | Quelltext bearbeiten]β-Carbolin-Alkaloide sind in Prokaryonten, Pflanzen und Tieren weit verbreitet. Einige dieser Verbindungen, insbesondere Tetrahydro-ß-Carboline (z. B. Pinolin), können von Pflanzen und dem menschlichen Körper aus den Vorstufen Tryptophan, Serotonin und Tryptamin synthetisiert werden.
- Insgesamt sind acht Pflanzenfamilien bekannt, die 64 verschiedene β-Carbolin-Alkaloide synthetisieren. Beispielsweise sind die β-Carboline Harmin, Harmalin und Tetrahydroharmin Bestandteile der Liane Banisteriopsis caapi und spielen eine zentrale Rolle in der Pharmakologie der Psychedelika im Ayahuasca Extrakt der indigenen Völker des Amazonas. Darüber hinaus enthalten die Samen von Peganum harmala (syrische Raute) zwischen 0,16 %[31] und 5,9 %[32] β-Carbolin-Alkaloide (bezogen auf Trockengewicht).
- Eine andere Gruppe von β-Carbolinen, die Eudistomine, wurde aus Seescheiden (marinen Manteltieren der Familie Ascidiacea) wie Ritterella sigillinoides,[33] Lissoclinum fragile[34] oder Pseudodistoma aureum[35] extrahiert.
- Nostocarbolin wurde aus Süßwasser-Cyanobakterien isoliert.[36]
- Vollaromatische β-Carboline kommen in geringer Konzentration auch in zahlreichen Lebensmitteln vor. Die höchsten Mengen wurden in gebrühtem Kaffee, Rosinen, durchgebratenem Fisch und Fleisch nachgewiesen.[37] Rauchen ist eine weitere wichtige Quelle der vollaromatischen β-Carboline mit einer Konzentration von bis zu 1000 µg pro Person und Tag.[38]
- β-Carboline wurden auch in der Cuticula von Skorpionen gefunden, die ihre Haut bei Bestrahlung mit ultraviolettem Licht bestimmter Wellenlängen (z. B. Schwarzlicht) fluoreszieren lassen.[39]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Renata Francik, Grzegorz Kazek, Marek Cegła, Marek Stepniewski: Antioxidant activity of beta-carboline derivatives. In: Acta Poloniae Pharmaceutica. Band 68, Nr. 2, März 2011, S. 185–189, PMID 21485291.
- ↑ Natalia Gulyaeva, Victor Aniol: Good guys from a shady family. In: Journal of Neurochemistry. Band 121, Nr. 6, Juni 2012, S. 841–842, doi:10.1111/j.1471-4159.2012.07708.x, PMID 22372749.
- ↑ a b Shams Aaghaz, Komal Sharma, Rahul Jain, Ahmed Kamal: β-Carbolines as potential anticancer agents. In: European Journal of Medicinal Chemistry. Band 216, 15. April 2021, S. 113321, doi:10.1016/j.ejmech.2021.113321, PMID 33684825.
- ↑ Jessica Baiget, Sabin Llona-Minguez, Stuart Lang, Simon P. Mackay, Colin J. Suckling: Manganese dioxide mediated one-pot synthesis of methyl 9H-pyrido[3,4-b]indole-1-carboxylate: Concise synthesis of alangiobussinine. In: Beilstein Journal of Organic Chemistry. Band 7, 2011, S. 1407–1411, doi:10.3762/bjoc.7.164, PMID 22043251, PMC 3201054 (freier Volltext).
- ↑ Sarah E. Mennenga, Julia E. Gerson, Travis Dunckley, Heather A. Bimonte-Nelson: Harmine treatment enhances short-term memory in old rats: Dissociation of cognition and the ability to perform the procedural requirements of maze testing. In: Physiology & Behavior. Band 138, Januar 2015, S. 260–265, doi:10.1016/j.physbeh.2014.09.001, PMID 25250831, PMC 4406242 (freier Volltext).
- ↑ Walter Becker, Wolfgang Sippl: Activation, regulation, and inhibition of DYRK1A. In: The FEBS journal. Band 278, Nr. 2, Januar 2011, S. 246–256, doi:10.1111/j.1742-4658.2010.07956.x, PMID 21126318.
- ↑ R. A. Glennon, M. Dukat, B. Grella, S. Hong, L. Costantino: Binding of beta-carbolines and related agents at serotonin (5-HT(2) and 5-HT(1A)), dopamine (D(2)) and benzodiazepine receptors. In: Drug and Alcohol Dependence. Band 60, Nr. 2, 1. August 2000, S. 121–132, doi:10.1016/s0376-8716(99)00148-9, PMID 10940539.
- ↑ a b Jucélia J. Fortunato, Gislaine Z. Réus, Tamires R. Kirsch, Roberto B. Stringari, Laura Stertz: Acute harmine administration induces antidepressive-like effects and increases BDNF levels in the rat hippocampus. In: Progress in Neuro-Psychopharmacology & Biological Psychiatry. Band 33, Nr. 8, 13. November 2009, S. 1425–1430, doi:10.1016/j.pnpbp.2009.07.021, PMID 19632287.
- ↑ a b Jucélia J. Fortunato, Gislaine Z. Réus, Tamires R. Kirsch, Roberto B. Stringari, Gabriel R. Fries: Chronic administration of harmine elicits antidepressant-like effects and increases BDNF levels in rat hippocampus. In: Journal of Neural Transmission (Vienna, Austria: 1996). Band 117, Nr. 10, Oktober 2010, S. 1131–1137, doi:10.1007/s00702-010-0451-2, PMID 20686906.
- ↑ Francisco López-Muñoz, Cecilio Alamo: Monoaminergic neurotransmission: the history of the discovery of antidepressants from 1950s until today. In: Current Pharmaceutical Design. Band 15, Nr. 14, 2009, S. 1563–1586, doi:10.2174/138161209788168001, PMID 19442174.
- ↑ Patrice Venault, Georges Chapouthier: From the behavioral pharmacology of beta-carbolines to seizures, anxiety, and memory. In: TheScientificWorldJournal. Band 7, 19. Februar 2007, S. 204–223, doi:10.1100/tsw.2007.48, PMID 17334612, PMC 5901106 (freier Volltext).
- ↑ W. B. Mendelson, M. Cain, J. M. Cook, S. M. Paul, P. Skolnick: A benzodiazepine receptor antagonist decreases sleep and reverses the hypnotic actions of flurazepam. In: Science (New York, N.Y.). Band 219, Nr. 4583, 28. Januar 1983, S. 414–416, doi:10.1126/science.6294835, PMID 6294835.
- ↑ Patrice Venault, Georges Chapouthier: From the behavioral pharmacology of beta-carbolines to seizures, anxiety, and memory. In: TheScientificWorldJournal. Band 7, 19. Februar 2007, S. 204–223, doi:10.1100/tsw.2007.48, PMID 17334612, PMC 5901106 (freier Volltext).
- ↑ Michael Gruss, Dorothea Appenroth, Armin Flubacher, Christoph Enzensperger, Jörg Bock: 9-Methyl-β-carboline-induced cognitive enhancement is associated with elevated hippocampal dopamine levels and dendritic and synaptic proliferation. In: Journal of Neurochemistry. Band 121, Nr. 6, Juni 2012, S. 924–931, doi:10.1111/j.1471-4159.2012.07713.x, PMID 22380576.
- ↑ Isoquinolines And Beta-Carbolines As Neurotoxins And Neuroprotectants. 2012, doi:10.1007/978-1-4614-1542-8.
- ↑ Catrin Wernicke, Julian Hellmann, Barbara Zieba, Katarzyna Kuter, Krystyna Ossowska: 9-Methyl-beta-carboline has restorative effects in an animal model of Parkinson's disease. In: Pharmacological reports: PR. Band 62, Nr. 1, Januar 2010, S. 35–53, doi:10.1016/s1734-1140(10)70241-3, PMID 20360614.
- ↑ Michael Gruss, Dorothea Appenroth, Armin Flubacher, Christoph Enzensperger, Jörg Bock: 9-Methyl-β-carboline-induced cognitive enhancement is associated with elevated hippocampal dopamine levels and dendritic and synaptic proliferation. In: Journal of Neurochemistry. Band 121, Nr. 6, Juni 2012, S. 924–931, doi:10.1111/j.1471-4159.2012.07713.x, PMID 22380576.
- ↑ Juliane Hamann, Catrin Wernicke, Jochen Lehmann, Heinz Reichmann, Hans Rommelspacher: 9-Methyl-beta-carboline up-regulates the appearance of differentiated dopaminergic neurones in primary mesencephalic culture. In: Neurochemistry International. Band 52, Nr. 4-5, März 2008, S. 688–700, doi:10.1016/j.neuint.2007.08.018, PMID 17913302.
- ↑ Witold Polanski, Heinz Reichmann, Gabriele Gille: Stimulation, protection and regeneration of dopaminergic neurons by 9-methyl-β-carboline: a new anti-Parkinson drug? In: Expert Review of Neurotherapeutics. Band 11, Nr. 6, Juni 2011, S. 845–860, doi:10.1586/ern.11.1, PMID 21651332.
- ↑ Catrin Wernicke, Julian Hellmann, Barbara Zieba, Katarzyna Kuter, Krystyna Ossowska: 9-Methyl-beta-carboline has restorative effects in an animal model of Parkinson's disease. In: Pharmacological reports: PR. Band 62, Nr. 1, Januar 2010, S. 35–53, doi:10.1016/s1734-1140(10)70241-3, PMID 20360614.
- ↑ Suresh Panthee, Shunji Takahashi, Teruo Hayashi, Takeshi Shimizu, Hiroyuki Osada: β-carboline biomediators induce reveromycin production in Streptomyces sp. SN-593. In: Scientific Reports. Band 9, Nr. 1, 9. April 2019, S. 5802, doi:10.1038/s41598-019-42268-w, PMID 30967594, PMC 6456619 (freier Volltext).
- ↑ Suresh Panthee, Naoko Kito, Teruo Hayashi, Takeshi Shimizu, Jun Ishikawa: β-carboline chemical signals induce reveromycin production through a LuxR family regulator in Streptomyces sp. SN-593. In: Scientific Reports. Band 10, Nr. 1, 23. Juni 2020, S. 10230, doi:10.1038/s41598-020-66974-y, PMID 32576869, PMC 7311520 (freier Volltext).
- ↑ Jessie MacAlpine, Martin Daniel-Ivad, Zhongle Liu, Junko Yano, Nicole M. Revie: A small molecule produced by Lactobacillus species blocks Candida albicans filamentation by inhibiting a DYRK1-family kinase. In: Nature Communications. Band 12, Nr. 1, 22. Oktober 2021, S. 6151, doi:10.1038/s41467-021-26390-w, PMID 34686660, PMC 8536679 (freier Volltext).
- ↑ Paul Foley: Beans, roots and leaves: a brief history of the pharmacological therapy of parkinsonism. In: Wurzburger Medizinhistorische Mitteilungen. Band 22, 2003, S. 215–234, PMID 15641199.
- ↑ a b c Atbin Djamshidian, Sabine Bernschneider-Reif, Werner Poewe, Andrew J. Lees: Banisteriopsis caapi, a Forgotten Potential Therapy for Parkinson's Disease? In: Movement Disorders Clinical Practice. Band 3, Nr. 1, Januar 2016, S. 19–26, doi:10.1002/mdc3.12242, PMID 30713897, PMC 6353393 (freier Volltext).
- ↑ M. J. Schwarz, P. J. Houghton, S. Rose, P. Jenner, A. D. Lees: Activities of extract and constituents of Banisteriopsis caapi relevant to parkinsonism. In: Pharmacology, Biochemistry, and Behavior. Band 75, Nr. 3, Juni 2003, S. 627–633, doi:10.1016/s0091-3057(03)00129-1, PMID 12895680.
- ↑ Daniel I. Brierley, Colin Davidson: Harmine augments electrically evoked dopamine efflux in the nucleus accumbens shell. In: Journal of Psychopharmacology (Oxford, England). Band 27, Nr. 1, Januar 2013, S. 98–108, doi:10.1177/0269881112463125, PMID 23076833.
- ↑ Volodymyr Samoylenko, Md Mostafizur Rahman, Babu L. Tekwani, Lalit M. Tripathi, Yan-Hong Wang: Banisteriopsis caapi, a unique combination of MAO inhibitory and antioxidative constituents for the activities relevant to neurodegenerative disorders and Parkinson's disease. In: Journal of Ethnopharmacology. Band 127, Nr. 2, 3. Februar 2010, S. 357–367, doi:10.1016/j.jep.2009.10.030, PMID 19879939, PMC 2828149 (freier Volltext).
- ↑ M. J. Barallobre, C. Perier, J. Bové, A. Laguna, J. M. Delabar: DYRK1A promotes dopaminergic neuron survival in the developing brain and in a mouse model of Parkinson's disease. In: Cell Death & Disease. Band 5, 12. Juni 2014, S. e1289, doi:10.1038/cddis.2014.253, PMID 24922073, PMC 4611726 (freier Volltext).
- ↑ W. Du, V. J. Aloyo, J. A. Harvey: Harmaline competitively inhibits [3H]MK-801 binding to the NMDA receptor in rabbit brain. In: Brain Research. Band 770, Nr. 1-2, 3. Oktober 1997, S. 26–29, doi:10.1016/s0006-8993(97)00606-9, PMID 9372198.
- ↑ Bahram Hemmateenejad, Abdolkarim Abbaspour, Homeyra Maghami, Ramin Miri, Mohhamad Reza Panjehshahin: Partial least squares-based multivariate spectral calibration method for simultaneous determination of beta-carboline derivatives in Peganum harmala seed extracts. In: Analytica Chimica Acta. Band 575, Nr. 2, 11. August 2006, S. 290–299, doi:10.1016/j.aca.2006.05.093, PMID 17723604.
- ↑ T. Herraiz, D. González, C. Ancín-Azpilicueta, V. J. Arán, H. Guillén: beta-Carboline alkaloids in Peganum harmala and inhibition of human monoamine oxidase (MAO). In: Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association. Band 48, Nr. 3, März 2010, S. 839–845, doi:10.1016/j.fct.2009.12.019, PMID 20036304.
- ↑ R. J. Lake, J. W. Blunt, M. H. G. Munro: Eudistomins From the New Zealand Ascidian Ritterella sigillinoides. In: Australian Journal of Chemistry. Band 42, Nr. 7, 1989, S. 1201–1206, doi:10.1071/ch9891201.
- ↑ A. Badre, A. Boulanger, E. Abou-Mansour, B. Banaigs, G. Combaut: Eudistomin U and isoeudistomin U, new alkaloids from the Caribbean ascidian Lissoclinum fragile. In: Journal of Natural Products. Band 57, Nr. 4, April 1994, S. 528–533, doi:10.1021/np50106a016, PMID 8021654.
- ↑ R. A. Davis, A. R. Carroll, R. J. Quinn: Eudistomin V, a new beta-carboline from the Australian ascidian Pseudodistoma aureum. In: Journal of Natural Products. Band 61, Nr. 7, Juli 1998, S. 959–960, doi:10.1021/np9800452, PMID 9677285.
- ↑ Paul G. Becher, Julien Beuchat, Karl Gademann, Friedrich Jüttner: Nostocarboline: isolation and synthesis of a new cholinesterase inhibitor from Nostoc 78-12A. In: Journal of Natural Products. Band 68, Nr. 12, Dezember 2005, S. 1793–1795, doi:10.1021/np050312l, PMID 16378379.
- ↑ Tomás Herraiz: β-Carbolines as Neurotoxins. In: Isoquinolines And Beta-Carbolines As Neurotoxins And Neuroprotectants. Springer US, Boston, MA 10. November 2011, S. 77–103, doi:10.1007/978-1-4614-1542-8_5.
- ↑ T. Herraiz, D. González, C. Ancín-Azpilicueta, V. J. Arán, H. Guillén: β-Carboline alkaloids in Peganum harmala and inhibition of human monoamine oxidase (MAO). In: Food and Chemical Toxicology. Band 48, Nr. 3, 1. März 2010, S. 839–845, doi:10.1016/j.fct.2009.12.019.
- ↑ S. J. Stachel, S. A. Stockwell, D. L. Van Vranken: The fluorescence of scorpions and cataractogenesis. In: Chemistry & Biology. Band 6, Nr. 8, August 1999, S. 531–539, doi:10.1016/S1074-5521(99)80085-4, PMID 10421760.