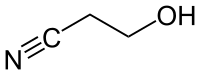
Ethylencyanhydrin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylencyanhydrin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5NO | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 71,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,06 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
228 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ethylencyanhydrin (nach IUPAC-Nomenklatur: 3-Hydroxypropannitril, oft auch als β-Cyanoethanol bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der aliphatischen Nitrile und der Alkohole. Früher galt die Verbindung als wichtiges Zwischenprodukt bei der Herstellung von Acrylsäure und Acrylnitril. Als Cyanhydrine werden sonst meist Verbindungen bezeichnet, die Cyano- und Hydroxygruppe am gleichen Kohlenstoffatom tragen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die großtechnische Herstellung von Ethylencyanhydrin erfolgt durch Umsetzung von Ethylenoxid mit Blausäure bei Temperaturen von 100–110 °C und Drücken von 11–25 bar in Gegenwart von Natronlauge als Katalysator in der flüssigen Phase.[3]

Die Reaktion wird in einer Reaktorkolonne aus Rohrschlangen durchgeführt und der pH-Wert über die Zugabe der Natronlauge gesteuert. Bei diesem Verfahren können Ausbeuten von 90–98 % erreicht werden. Die Reinigung und Aufarbeitung des Produkts erfolgt durch mehrstufige Destillation in nachgeschalteten Kolonnen.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ethylencyanhydrin hat eine relative Gasdichte von 2,45 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,00 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Die Dichte beträgt 1,06 g/cm3. Ethylencyanhydrin weist einen Dampfdruck von 0,10 hPa bei 20 °C, 0,20 hPa bei 30 °C und 0,80 hPa bei 50 °C auf. Die dynamische Viskosität beträgt weniger als 10 mPa·s bei 20 °C.[1]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ethylencyanhydrin ist eine brennbare, jedoch schwer entzündbare Flüssigkeit aus der Stoffgruppe der Nitrile und Alkohole. Sie ist sehr leicht in Wasser löslich und auch mit einigen organischen Lösungsmitteln wie Ethanol, Aceton, Methylethylketon, Chloroform und Diethylether gut mischbar. 3-Hydroxypropanitril ist schwer bzw. sehr schwer flüchtig. Bei einer Temperatur von > 228 °C zersetzt sich der Stoff und setzt hochgiftigen Cyanwasserstoff als Gas frei. Bei Kontakt mit Alkalihydroxid, Oxidationsmitteln, Säuren und Wasser können gefährliche Reaktionen stattfinden, bei denen meistens auch Cyanwasserstoff frei wird. Ethylencyanhydrin weist als Reinstoff bei einer Temperatur von 20 °C einen pH-Wert zwischen 3,0 und 4,5 auf. Folglich reagieren wässrige Lösungen schwach sauer.[1][2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Früher galt Ethylencyanhydrin als wichtiges Zwischenprodukt bei der Herstellung von Acrylnitril und Acrylsäure. Dieser Prozess wurde allerdings durch das derzeit dominierende Sohio-Verfahren abgelöst, bei dem man den billigeren Ausgangsstoff Propen als Reaktionsgrundlage verwendet und diesen in einer Ammonoxidation zu Acrylnitril bzw. partiellen Oxidation zur Acrylsäure umsetzt. Ethylencyanohydrin wird heutzutage vorwiegend als Lösungsmittel für Celluloseester und viele anorganische Salze verwendet.[4] Des Weiteren gilt es als Vorprodukt in der Pharma- und Kosmetikindustrie.[3]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Hauptsächlich wird Ethylencyanhydrin über den Atemtrakt und die Haut aufgenommen. Dabei kommt es akut zu Reizwirkungen auf Schleimhäute und die Haut. Zur Reproduktionstoxizität, Mutagenität und Kanzerogenität sind keine ausreichenden Angaben verfügbar. Ethylencyanhydrin weist eine untere Explosionsgrenze (UEG) von 1,1 Vol.-% und eine obere Explosionsgrenze (OEG) von 12,1 Vol.-% auf. Mit einem Flammpunkt von 128 °C gilt Ethylencyanhydrin als schwer entflammbar.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o Eintrag zu Ethylencyanhydrin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. April 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu ETHYLENE CYANOHYDRIN in der Hazardous Substances Data Bank (via PubChem), abgerufen am 18. April 2019.
- ↑ a b c Patentanmeldung EP2027084A1: Vorrichtung und Verfahren zur kontinuierlichen Darstellung von Ethylencyanhydrin. Angemeldet am 14. März 2007, veröffentlicht am 25. Februar 2009, Anmelder: Evonik Roehm GmbH, Erfinder: Volker Schleep, Benedikt Laux.
- ↑ Eintrag zu Hydroxypropionitrile. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. April 2019.