Palmendieb
| Palmendieb | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Palmendieb | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Birgus | ||||||||||||
| W. E. Leach, 1815 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Birgus latro | ||||||||||||
| (Linnaeus, 1767) |
Der Palmendieb (Birgus latro), auch Kokosnussräuber[1], im angelsächsischen Sprachraum Coconut crab genannt, ist ein zur Ordnung der Zehnfußkrebse (Decapoda) gehörendes Krebstier (Crustacea) aus der Familie der Landeinsiedlerkrebse (Coenobitidae). Dieser Familie werden zwei Gattungen zugeordnet: die Gattung Coenobita, zu der etwa 15 Arten gehören, und die Gattung Birgus, deren einziger Vertreter der Palmendieb ist. Der Palmendieb, der unter anderem in der Lage ist, eine Kokosnuss zu öffnen, ist das größte an Land lebende Krebstier der Erde.
Name
[Bearbeiten | Quelltext bearbeiten]Der Name „Palmendieb“ mag wie die englische Bezeichnung Coconut crab darauf verweisen, dass das Tier auf Palmen zu klettern und dort Kokosnüsse zu ernten vermag, die es dann am Boden öffnet, um deren Inhalt zu verzehren. Die ursprüngliche wissenschaftliche Bezeichnung Cancer latro (latro ist lateinisch für Räuber), die auf Carl von Linné zurückgeht, führte dann offenbar in der deutschen Übersetzung zum -dieb. Georg Eberhard Rumpf, ein niederländischer Botaniker und Naturforscher auf der Molukken-Insel Ambon in Niederländisch-Indien (heute Indonesien), machte durch sein Werk D’Amboinische Rariteitkamer (Erstausgabe in den Niederlanden 1705, illustriert von Maria Sibylla Merian) den Palmendieb erstmals in Europa bekannt.
Merkmale des Palmendiebs
[Bearbeiten | Quelltext bearbeiten]Körperbau
[Bearbeiten | Quelltext bearbeiten]Ausgewachsen erreichen Palmendiebe eine Körperlänge von bis zu 40 Zentimeter und ein Gewicht bis 4 Kilogramm. Die Spannweite der Beine kann bis zu einem Meter betragen. Der Palmendieb ist damit der größte landlebende Vertreter der Arthropoden. Lediglich im Wasser, wo der Körper durch den Auftrieb getragen wird, können Zehnfußkrebse noch größer werden, beispielsweise männliche Exemplare der Japanischen Riesenkrabbe (Macrocheira kaempferi).
Palmendiebe haben halb eingesenkt getragene, rote Komplexaugen auf kurzen Augenstielen. Ihre Körperfarbe variiert von Insel zu Insel zwischen blau-violett und rot-orange. Die männlichen Tiere sind in der Regel größer als die weiblichen.


Wie für Zehnfußkrebse typisch ist der Körper in einen vorderen Abschnitt (Cephalothorax), an dem sich die zehn Beine befinden, und einen hinteren, das Abdomen oder Pleon, unterteilt. Am Ende des vordersten Beinpaares befinden sich verschieden große und in ihrer Funktion spezialisierte Scheren, deren linke stets die größere ist: Birgus ist also, wie z. B. auch Linkshändige Einsiedlerkrebse, „monostroph linksscherig“: Die größere linke soll „mehr als doppelt so groß wie die andere“ sein.[2] Mit den unterschiedlich einsetzbaren Scheren ist der Palmendieb in der Lage, Kokosnüsse zu öffnen (durch ein gezieltes Ansetzen einer der Scheren an den drei Keimlöchern am oberen Ende der Nuss) und Gegenstände mit einem Gewicht von bis zu 28 Kilogramm hochzuheben. Die Kneifkraft der Scheren korreliert mit dem Körpergewicht. Basierend auf Messungen der Kneifkraft unterschiedlich schwerer Palmendiebe wird für 4 kg schwere Exemplare eine Kneifkraft von 3300 N angenommen; das übertrifft die Beißkraft der meisten terrestrischen Raubtiere.[3]
Die Beine werden vom Palmendieb vor allem zur Fortbewegung eingesetzt. Aufgrund der Scheren und Beine sind Palmendiebe unter anderem in der Lage, senkrecht an rauen Baumstämmen hinaufzuklettern. Das letzte Beinpaar ist sehr klein und wird vom Palmendieb nur zur Reinigung der Luftatmungsorgane verwendet.
Obwohl der Palmendieb zu den Landeinsiedlerkrebsen gehört, nutzen nur Jung- und heranwachsende Tiere Schneckenhäuser, um ihren weichen Unterleib zu schützen. Heranwachsende Tiere nutzen gelegentlich auch zerbrochene Kokosnussschalen, wenn sie keine Schneckenhäuser in geeigneter Größe finden. Ausgewachsene Tiere haben andere Schutzstrategien entwickelt: Zum einen krümmen Palmendiebe ihren Hinterleib schützend unter den Vorderleib, wie es bei Echten Krabben noch stärker ausgeprägt ist. Ihr wichtigster Schutz ist jedoch, dass sie im Laufe ihrer Entwicklung vom Jungtier zum ausgewachsenen Palmendieb Chitin und Kalk in die Hinterleibsdecke einlagern. Diese verhärtet sich im Laufe der Zeit und bildet so einen schützenden Panzer, der gleichzeitig auch den Wasserverlust an Land reduziert. In regelmäßigen Abständen stoßen die Palmendiebe diesen Schutzpanzer jedoch ab. Während der dreißig Tage, die es dauert, bis sich nach solch einer Häutung ein neuer schützender Panzer ausbildet, leben die Palmendiebe sehr versteckt.
Atmung
[Bearbeiten | Quelltext bearbeiten]Palmendiebe können nicht schwimmen und würden im Wasser ertrinken. Sie atmen mit Kiemenhöhlen, die von den weit übergreifenden Seitenrändern des Carapax gebildet werden. Diese Ränder nennt man Branchiostegite. Die beiden Atemhöhlen befinden sich am Ende des Cephalothorax. Sie enthalten ein Gewebe, das sich auch in Kiemen findet, das jedoch anders als bei Kiemen darauf ausgerichtet ist, Sauerstoff aus der Luft aufzunehmen und nicht aus dem Wasser. Palmendiebe nutzen ihr kleinstes Beinpaar, um dieses Atmungsorgan zu reinigen und es mit Meereswasser zu befeuchten. Der Atmungsapparat benötigt Wasser, um zu funktionieren, und die Palmendiebe stellen dies sicher, indem sie ihre Beine ins Wasser tauchen und anschließend über das schwammartige Gewebe ihres Branchiostegiten streichen. Palmendiebe trinken auch Salzwasser, das sie mit Hilfe der Beine zum Mund führen.
Zusätzlich zu diesem Atmungsapparat haben Palmendiebe noch ein rudimentäres Paar Kiemen. Während der Evolutionsgeschichte dieser Art dienten diese Kiemen wahrscheinlich der Atmung unter Wasser. Heute sind sie jedoch nicht mehr in der Lage, das Tier mit ausreichend Sauerstoff zu versorgen. Über die Dauer, die ein Palmendieb unter Wasser überleben kann, liegen unterschiedliche Angaben vor, die zwischen Minuten und mehreren Stunden schwanken, da der Sauerstoffverbrauch von der individuellen Kondition und dem Stressniveau abhängt.
Geruchssinn
[Bearbeiten | Quelltext bearbeiten]Der Geruchssinn von Krebsen funktioniert unterschiedlich, je nachdem, ob die zu riechenden Moleküle hydrophob oder hydrophil sind. Im Wasser lebende Krebstiere haben an ihren Fühlern spezielle Organe, die als Aesthetasken oder auch olfaktorische Reizfäden bezeichnet werden. Mit diesen können sie die Konzentration der Geruchsmoleküle und die Richtung, aus der sie kommen, bestimmen. Bei den Palmendieben unterscheiden sich die Aesthetasken jedoch deutlich von denen der im Wasser lebenden Krebse. Sie gleichen mehr den Geruchsorganen der Insekten, den Sensillen – die Ähnlichkeit ist auf eine Konvergente Evolution zurückzuführen. Palmendiebe bewegen ihre Fühler auch ähnlich wie Insekten, um Gerüche wahrzunehmen. Sie reagieren besonders auf den Geruch von verrottendem Fleisch, Bananen und Kokosnüssen.
Verbreitungsgebiet
[Bearbeiten | Quelltext bearbeiten]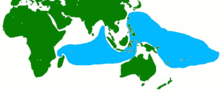
Birgus latro kommt auf ozeanischen Inseln und auf den kleineren kontinentalen Inseln im westlichen Pazifik und im östlichen Indischen Ozean vor.
Auf der Weihnachtsinsel im Indischen Ozean lebt die größte dokumentierte Population der Palmendiebe. Große Populationen befinden sich auch auf den Cookinseln. Sie sind dort insbesondere auf Pukapuka, Suwarrow, Mangaia, Takutea, Mauke und Atiu verbreitet. Auch auf Niue gibt es eine Population. Palmendiebe leben außerdem auf den Inseln des Caroline-Atolls, das zu Kiribati gehört, sowie den kleineren Inseln von Palmerston. Populationen gibt es auch auf den Seychellen, insbesondere auf Aldabra, Îles Glorieuses, Astove-Insel, Assumption Island und Cosmoledo. Auf den zentralen Inseln der Seychellen sind die Palmendiebe dagegen ausgestorben. Sie kommen außerdem auf einigen Inseln der Andamanen und Nikobaren im Golf von Bengalen vor. Ebenso gibt es eine Population auf den Inseln des Bikini-Atolls. Bei den dort lebenden Tieren wurde 1972 eine radioaktive Verstrahlung infolge der Atombombenversuche der 1940er und 1950er Jahre festgestellt.[4] Da Palmendiebe als adulte Tiere nicht schwimmen können, muss die Kolonisation dieser Inseln im Larvenstadium erfolgt sein. Einige Wissenschaftler sind jedoch überzeugt, dass die Entfernungen zwischen den Inseln zu groß sind, als dass diese während des nur 28 Tage andauernden Larvenstadiums überbrückt werden könnten. Sie meinen, dass juvenile Palmendiebe diese über natürliche Flöße erreichten.
Palmendiebe fehlen dagegen in Indonesien (Ausnahme Bunaken und Togianinseln bei Sulawesi) oder auf dem Festland von Neuguinea, obwohl diese Inseln einen geeigneten Lebensraum bieten und durch eine Verdriftung von Larven oder Jungtieren gleichfalls besiedelt sein könnten. Man geht daher davon aus, dass Palmendiebe nach jeder erfolgreichen Ansiedlung von den Inselbewohnern als Nahrungsquelle genutzt wurden, so dass sich hier keine Populationen erhalten konnten.
Lebensraum
[Bearbeiten | Quelltext bearbeiten]
Der Palmendieb bewohnt Felsspalten und Sandlöcher entlang der Küstenlinie. Die Vorlieben schwanken von Insel zu Insel und sind abhängig vom vorhandenen Lebensraum. So bewohnt er auf den philippinischen Olango-Inseln Höhlen im Korallenriff, während er auf den Guam-Inseln (Ozeanien) selbst Höhlen in den porösen Kalkstein gräbt. Auf den Inseln, auf denen er keine natürlichen Unterschlupfe findet, gräbt er sich seine Sandlöcher auf Sand- oder ähnlichen losen Böden selber.
Tagsüber hält sich der Palmendieb meist in seiner Höhle auf, um sich vor Austrocknung und Feinden zu schützen. Den Eingang seiner Höhle verschließt er mit einer seiner Scheren und schafft somit in seiner Höhle das feuchte Mikroklima, das für seinen Atmungsapparat notwendig ist. In Regionen, in denen viele Palmendiebe leben, kommen einige auch am Tag aus ihren Bauten. Die meisten Palmendiebe kann man allerdings in der Nacht dabei beobachten, wie sie den Strand auf der Suche nach Futter entlangwandern.
Fortpflanzung
[Bearbeiten | Quelltext bearbeiten]
Die Paarungszeit der Palmendiebe ist zwischen Mai und September. Hauptpaarungszeit sind dabei die Monate Juli und August. Palmendiebe paaren sich mehrfach in dieser Zeit. Die Paarung findet an Land statt und beginnt mit einer Auseinandersetzung zwischen Männchen und Weibchen, in deren Verlauf das Männchen das Weibchen auf den Rücken dreht und sich dann mit ihm paart. Die Paarung dauert etwa 15 Minuten. Kurz darauf legt das Weibchen die befruchteten Eier, die sie an ihren Unterkörper anklebt, um sie für einige Monate mit sich herumzutragen. Kurz vor dem Schlupf der Larven sucht das Weibchen den Strand bei Hochwasser auf und lässt die Eier ins Meerwasser fallen.
Die Larven schwimmen als Plankton für 28 Tage im Meerwasser. Die größte Zahl fällt in dieser Zeit Fressfeinden zum Opfer. Die überlebenden Larven verbleiben die nächsten 28 Tage überwiegend im Meeresboden, sie nutzen in dieser Zeit leere Schneckenhäuser als Schutz. Danach verlassen sie das Meer als Lebensraum und verlieren auch ihre Fähigkeit, unter Wasser zu atmen. Wie im Abschnitt Körperbau beschrieben, nutzen heranwachsende Palmendiebe Schneckenhäuser und gegebenenfalls zerbrochene Kokosnüsse als Schutz des Unterleibs, bevor sie einen eigenen Schutzpanzer entwickeln. Nach vier bis acht Jahren ist ein Palmendieb geschlechtsreif. Für Krebstiere ist dies eine ungewöhnlich lange Entwicklungszeit.
Nahrung und Nahrungserwerb
[Bearbeiten | Quelltext bearbeiten]Die Hauptnahrungsquelle der Tiere sind die Früchte der Pflanzen seines Habitats, vor allem der Feigenbäume (Ficus), der Arengapalmen (Arenga) und der Schraubenbäume (Pandanus). Sie fressen aber auch Aas und lebende Kleintiere, wie beispielsweise frisch geschlüpfte Meeresschildkröten und die rotgefärbten Weihnachtsinsel-Krabben auf ihrem Weg zur Küste. Außerdem ist bekannt, dass Palmendiebe manchmal unvorsichtige Vögel wie z. B. Rotfußtölpel erbeuten.[5][6] Daneben ernähren sie sich von abgestreiften Häuten anderer Krustentiere, die viel Calcium enthalten, was wiederum für das Wachstum des eigenen Panzers wichtig ist. Palmendiebe untereinander sind futterneidisch. Die meisten schleppen ihre Beute in ihre Höhlen, um dort in Ruhe fressen zu können.
Lange Zeit wurde bezweifelt, dass Palmendiebe tatsächlich in der Lage sind, Kokosnüsse zu öffnen. Bei Experimenten verhungerten manche Exemplare selbst dann, wenn sie von Kokosnüssen umgeben waren. 1980 konnte der deutsche Biologe Holger Rumpf, der das Verhalten von Palmendieben erforschte, bei wildlebenden Exemplaren erstmals beschreiben, wie sie Nüsse der Kokospalme (Cocos nucifera) öffnen. Wenn die Kokosnuss noch von Fasern bedeckt ist, nutzen Palmendiebe die großen Scheren ihres vorderen Beinpaares, um die Fasern in Streifen zu entfernen. Sie beginnen dabei immer an der Seite, an der sich die drei Keimlöcher befinden. Sobald die harte Schale freigelegt ist, schlagen sie mit den Scheren auf die Keimlöcher ein, bis die Kokosnuss an dieser Stelle aufbricht. Mit den kleinen Scheren der mittleren Beinpaare holen sie dann das weiße Kokosfleisch heraus.
Palmendiebe erklimmen mitunter sogar Palmen, um sich an den Kokosnüssen gütlich zu tun. Falsch jedoch ist, dass Palmendiebe dabei die Kokosnüsse planvoll an den Fruchtstielen abzwicken, um sie dann am Boden zu verzehren. Nach den Untersuchungen von Holger Rumpf reicht ihre Intelligenz für eine „geplante Ernte“ nicht aus. Es kann jedoch vereinzelt vorkommen, dass Kokosnüsse unbeabsichtigt vom Baum fallen, während der Palmendieb sich an ihnen zu schaffen macht.
Bedrohung
[Bearbeiten | Quelltext bearbeiten]Nach den RAHA-Kriterien liegen keine ausreichenden Daten vor, um entscheiden zu können, ob der Palmendieb als bedrohte Tierart einzuordnen ist. Er wird daher in der Rote Liste gefährdeter Arten der IUCN oder Weltnaturschutzorganisation als eine Art ausgewiesen, für die nur unzureichendes Datenmaterial („data deficient“) vorhanden ist. Die letzte Einordnung stammt aus dem Jahr 1994 und ist mit der heute nicht mehr existenten Kategorie selten („Rare“) angegeben. Einige Berichte weisen darauf hin, dass der Bestand auf einigen Inseln noch recht hoch ist. Einer der größten Bestände befindet sich auf Caroline Island. Wahrscheinlich schwankt die Bestandsdichte signifikant von Insel zu Insel.
Junge Palmendiebe sind bedroht durch eingeführte Neozoen wie Ratten, Schweine oder Ameisen wie die Gelbe Spinnerameise (Anoplolepis gracilipes, Yellow Crazy Ant). Ausgewachsene Palmendiebe haben keine natürlichen Feinde – wenn man vom Menschen absieht. Palmendiebe haben eine schlechte Sehfähigkeit und nehmen die Annäherung von potenziellen Feinden durch Bodenerschütterungen wahr.
Insgesamt haben vor allem die zunehmenden Bevölkerungszahlen auf den Inseln einen negativen Einfluss auf die Population der Palmendiebe. Da ihr Fleisch sehr schmackhaft ist und auf vielen Inseln als Delikatesse bzw. Aphrodisiakum gilt, ist der Bestand durch intensive Bejagung bedroht. Außerdem haben wachsender Tourismus und die Bebauung der Küstenlinien den Lebensraum des Palmendiebes beeinträchtigt bzw. zerstört. Deshalb wurde der Palmendieb inzwischen in einigen Gebieten unter Schutz gestellt. So ist beispielsweise eine Mindestgröße vorgegeben, die Palmendiebe erreicht haben müssen, bevor sie gefangen werden dürfen.
Mensch und Palmendieb
[Bearbeiten | Quelltext bearbeiten]Palmendiebe mit ihrer beeindruckenden Größe und Stärke haben häufig eine spezielle Position in der Kultur der pazifischen Inselbewohner. So gilt er zum Beispiel bei den Inselbewohnern des Tuamotu-Atolls oder der Ryūkyū-Inseln traditionell als Delikatesse. Das Fleisch der Palmendiebe soll dem von Hummern und Langusten gleichen. Nach dem Kochen zeigt die Außenschale auch eine vergleichbare Rotfärbung. Zu den geschätztesten Teilen gehören die Eier im Inneren der weiblichen Palmendiebe und das Fett im Hinterleib. Palmendiebe werden ähnlich wie Hummer durch Kochen oder Dampfgaren zubereitet. Die Rezepte variieren von Insel zu Insel – örtlich werden Palmendiebe auch in Kokosmilch zubereitet.
Obwohl Palmendiebe normalerweise nicht giftig sind, kann ihr Fleisch gelegentlich giftig werden – sie gehören zu den so genannten passiv giftigen Krebstieren. Auf dem Tuamotu-Atoll und den Ryūkyū-Inseln soll es auch schon zu tödlichen Vergiftungen durch den Verzehr des Fleisches gekommen sein. Die Herkunft und Art der Toxine ist unklar, jedoch wird vermutet, dass das Tier Pflanzentoxine aufnimmt und einlagert. Die unterschiedliche Giftaufnahme individueller Tiere würde erklären, warum der Verzehr in manchen Fällen Vergiftungen verursacht, in anderen Fällen wiederum nicht. Es ist auch möglich, dass es diese Pflanzentoxine sind, die in geringeren Dosen als Aphrodisiakum wirken – ähnlich wie bei dem in Japan so geschätzten Kugelfisch. Allerdings sind Palmendiebe nach wie vor kein kommerzielles Handelsgut.
Auf die Jagd begeben sich die Inselbewohner bevorzugt während dunkler Nächte, wenn es frisch geregnet hat. Als beste Zeit gelten die drei Tage, die dem Neumond folgen. Palmendiebe können auch während des Tages gejagt werden, aber dies bedeutet meist, dass man nach ihnen graben oder sie aus ihren Verstecken ausräuchern muss.
Literatur
[Bearbeiten | Quelltext bearbeiten]- R. Altevogt, T. A. Davis: Birgus latro India’s monstrous crab. A study and an appeal. In: Bulletin of the Department of Marine Sciences. University of Cochin, Ernakulam 1975. ISSN 0970-9878
- P. Grubb: Ecology of terrestrial decapod crustaceans on Aldabra. In: Philosophical Transactions of the Royal Society: Biological Sciences. 1971, 260, S. 411–416.
- E. E. Held: Moulting behaviour of Birgus latro. In: Nature. Macmillan Journals, London 1963,200, S. 799–800. ISSN 0028-0836
- L. K. Barnett, C. Emms, D. Clarke: The coconut or robber crab (Birgus latro) in the Chagos Archipelago and its captive culture at London Zoo. In: C.R.C. Sheppard, M.R.D. Seaward (Hrsg.): Ecology of the Chagos Archipelago. Linnean Society Occasional Publications. Bd. 2. Westbury Publishing, Otley 1999, S. 273–284. ISBN 1-84103-003-1
- S. Lavery, C. Moritz, D. R. Fielder: Indo-Pacific population structure and evolutionary history of the Coconut Crab Birgus latro. Molecular ecology. Blackwell, Oxford 5.1996, S. 557–570. ISSN 0962-1083
- C. A. N. Combs, A. Alford, M. Boynton, R. P. Henry: Behavioural regulation of haemolymph osmolarity through selective drinking in land crabs, Birgus latro and Gecarcoidea lalandii. In: The Biological bulletin. Lancaster 182.1992, S. 416ff. ISSN 0006-3185
- P. Greenaway, S. Morris: Adaptations to a terrestrial existence by the robber crab Birgus latro. III. Nitrogenous excretion. In: The journal of experimental biology. Cambridge 143.1989, S. 333 ff. ISSN 0022-0949
- P. Greenaway, H. H. Taylor, S. Morris: Adaptations to a terrestrial existence by the robber crab Birgus latro. VI. The role of the excretory system in fluid balance. In: The journal of experimental biology. Cambridge 152.1990, S. 505ff. ISSN 0022-0949
- S. Morris, H. H. Taylor, P. Greenaway: Adaptations to a terrestrial existence in the robber crab Birgus latro L. VII. The branchial chamber and its role in urine reprocessing. In: The journal of experimental biology. Cambridge 161.1991, S. 315 ff. ISSN 0022-0949
- H. H. Taylor, P. Greenaway, S. Morris: Adaptations to a terrestrial existence in the robber crab Birgus latro L. VIII. Osmotic and ionic regulation on freshwater and saline drinking regimens. In: The journal of experimental biology. Cambridge 179.1993, S. 93 ff. (PDF-Download; 253 kB) ISSN 0022-0949
- M. C. Stensmyr, S. Erland, E. Hallberg, R. Wallén, P. Greenaway, B. S. Hansson: Insect-Like Olfactory Adaptations in the Terrestrial Giant Robber Crab. In: Current Biology. London 15.2005, S. 116–121 (26. Januar 2005). ISSN 0960-9822
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Video: Die Weihnachtsinsel und der Palmendieb NDR 2018
- Zubereitung zum Verzehr
- Birgus latro in der Roten Liste gefährdeter Arten der IUCN 2009. Eingestellt von: Eldredge, 1996. Abgerufen am 4. Januar 2010.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Palmendieb, der. Abgerufen am 12. September 2017.
- ↑ Jürgen Neffe: Darwin. Das Abenteuer des Lebens, 8. Aufl. 2008, ISBN 978-3-570-01091-4, S. 409.
- ↑ Shin-ichiro Oka, Taketeru Tomita, Kei Miyamoto: A Mighty Claw: Pinching Force of the Coconut Crab, the Largest Terrestrial Crustacean. In: PLOS ONE. Band 11, Nr. 11, 23. November 2016, ISSN 1932-6203, S. e0166108, doi:10.1371/journal.pone.0166108, PMID 27880779, PMC 5120803 (freier Volltext) – (plos.org [abgerufen am 18. Dezember 2021]).
- ↑ Bauernfeind, Ingo: Radioaktiv bis in alle Ewigkeit – Das Schicksal der Prinz Eugen. E. S. Mittler & Sohn, Hamburg/Berlin/Bonn 2011, ISBN 978-3-8132-0928-0, S. 108.
- ↑ 20 Minuten: Riesenkrebs verspeist schlafenden Vogel. 10. November 2017, abgerufen am 10. November 2017.
- ↑ Mark E. Laidre: Ruler of the atoll: the world's largest land invertebrate. In: Frontiers in Ecology and the Environment. 1. November 2017 (englisch, wiley.com [abgerufen am 10. November 2017]).