Blut-Hirn-Schranke



Als Blut-Hirn-Schranke, auch Blut-Gehirn-Schranke oder Blut-Hirn-Barriere genannt, wird die selektive physiologische Barriere zwischen den Flüssigkeitsräumen des Blutkreislaufs und dem Zentralnervensystem bezeichnet.
Diese besondere Abgrenzung des Bluts (intravasal) vom extravasalen Raum in Gehirn und Rückenmark ist bei allen Landwirbeltieren (Tetrapoda) ausgebildet und ermöglicht es, für das Nervengewebe eigene Milieubedingungen aufrechtzuerhalten (Homöostase). Im Wesentlichen wird diese Barriere von Endothelzellen gebildet, die hier in den kapillaren Blutgefäßen über Tight Junctions eng miteinander verknüpft sind.
Die Blut-Hirn-Schranke schützt das Gehirn vor im Blut zirkulierenden Krankheitserregern, Toxinen und Botenstoffen. Sie stellt einen hochselektiven Filter dar, über den die vom Gehirn benötigten Nährstoffe zugeführt und die entstandenen Stoffwechselprodukte abgeführt werden. Die Ver- und Entsorgung wird durch eine Reihe spezieller Transportprozesse gewährleistet.
Andererseits erschwert diese Schutzfunktion des Gehirns die medikamentöse Behandlung einer Vielzahl neurologischer Erkrankungen, da auch sehr viele Wirkstoffe die Blut-Hirn-Schranke nicht passieren können. Die Überwindung der Blut-Hirn-Schranke ist ein aktuelles Forschungsgebiet, um auch diese Krankheiten behandeln zu können. Nur sehr wenige – ausgesprochen seltene – Erkrankungen stehen in unmittelbarem Zusammenhang mit der Blut-Hirn-Schranke, während sie selbst von einer deutlich höheren Anzahl weitverbreiteter Erkrankungen betroffen sein kann. Eine so hervorgerufene Störung oder Schädigung der Blut-Hirn-Schranke ist eine sehr ernst zu nehmende Komplikation.
Die ersten Versuche, die auf die Existenz dieser Barriere hindeuteten, führte Paul Ehrlich 1885 durch. Er interpretierte seine Versuchsergebnisse allerdings falsch. Der endgültige Nachweis der Blut-Hirn-Schranke erfolgte 1967 durch elektronenmikroskopische Untersuchungen.
Aufgaben der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]Das Gehirn hat beim Menschen einen Anteil von etwa 2 % an der Körpermasse. Der Anteil am Nährstoffbedarf liegt aber bei ungefähr 20 %. Im Gegensatz zu anderen Organen im Körper verfügt das Gehirn über äußerst geringe Nährstoff- oder Sauerstoff-Reserven. Auch sind die Nervenzellen nicht in der Lage, den Energiebedarf anaerob, das heißt ohne elementaren Sauerstoff, zu decken. So führt eine Unterbrechung der Blutzufuhr zum Gehirn nach zehn Sekunden zur Bewusstlosigkeit und bereits wenige Minuten später sterben die Nervenzellen ab.[1] Je nach Aktivität eines Hirnareals können dessen Energiebedarf und -reserven sehr unterschiedlich sein. Um die Versorgung dem jeweiligen Bedarf anpassen zu können, regeln diese Areale ihre Blutversorgung selbsttätig.[1]
Die komplexen Funktionen des Gehirns sind an hochempfindliche elektrochemische und biochemische Vorgänge gebunden, die nur in einem konstanten inneren Milieu, dem Homöostat, weitgehend störungsfrei ablaufen können. So dürfen beispielsweise Schwankungen des Blut-pH-Wertes nicht an das Gehirn weitergegeben werden. Schwankungen der Kalium-Konzentration würden das Membranpotenzial der Nervenzellen verändern. Die in den Blutgefäßen zirkulierenden Neurotransmitter dürfen nicht in das Zentralnervensystem gelangen, da sie den Informationsfluss der dort vorhandenen Synapsen erheblich stören würden. Zudem sind die Neuronen bei einer durch eine Milieuschwankung hervorgerufenen Schädigung nicht regenerationsfähig.[1] Letztlich muss das Gehirn, als zentral steuerndes Organ, auch vor der Einwirkung körperfremder Stoffe, wie beispielsweise Xenobiotika und Krankheitserregern, geschützt werden. Die weitgehende Undurchlässigkeit der Blut-Hirn-Schranke für im Blut befindliche Pathogene, Antikörper und Leukozyten macht sie zu einer immunologischen Barriere.[2][3]
Andererseits entstehen durch den hohen Energiebedarf des Gehirns – im Vergleich zu anderen Organen – überdurchschnittlich große Mengen von Stoffwechsel-Abbauprodukten, die über die Blut-Hirn-Schranke auch wieder abgeführt werden müssen.[4]
Um all diese Funktionen (Versorgung, Entsorgung und Homöostase) zu gewährleisten, weist das zerebrale Blutgefäßsystem der Wirbeltiere, im Vergleich zum peripheren Blutgefäßsystem, eine Reihe von strukturellen und funktionellen Unterschieden auf. Diese Differenzierung bewirkt eine weitgehende Abtrennung des Gehirns vom umgebenden extrazellularen Raum und ist für den Schutz des empfindlichen neuronalen Gewebes sowie für den Erhalt eines konstanten inneren Milieus von essenzieller Bedeutung.[1]
Veränderungen der Funktion der Blut-Hirn-Schranke bewirken Änderungen des Zustands des Zentralnervensystems(ZNS), was wiederum zu Funktionsstörungen oder Erkrankungen im ZNS führen kann.[4] Dementsprechend steht eine Reihe neurologischer Erkrankungen mittelbar oder unmittelbar mit der Blut-Hirn-Schranke in Verbindung.
Anatomie der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]


Das wesentliche Element der Blut-Hirn-Schranke bilden die Endothelzellen mit ihren Tight Junctions. Für Funktion sowie Aufbau und Entwicklung der Blut-Hirn-Schranke sind jedoch noch zwei andere Zelltypen, die Perizyten und die Astrozyten, von großer Bedeutung.[1] Die Zell-Zell-Interaktionen zwischen Endothelzellen, Perizyten und Astrozyten sind so eng wie bei sonst keinen anderen Zellen. Diese drei Zelltypen zusammen bilden die Blut-Hirn-Schranke der meisten Wirbeltiere, die endotheliale Blut-Hirn-Schranke.[5][6] Die nachfolgenden anatomischen Angaben beziehen sich auf die endotheliale Blut-Hirn-Schranke der Wirbeltiere. Die bei einigen Wirbeltieren und vielen Wirbellosen ausgebildete gliale Blut-Hirn-Schranke wird am Ende dieses Kapitels gesondert aufgeführt.
Das Endothel
[Bearbeiten | Quelltext bearbeiten]
Die Kapillargefäße werden – wie in den peripheren Blutgefäßen auch – von Endothelzellen gebildet. Das Endothel peripherer Kapillaren hat, für den Austausch von Wasser und darin gelösten oder suspendierten Stoffen zwischen dem Blut und der extrazellulären Flüssigkeit des umliegenden Gewebes, Öffnungen (Fenestrierungen) von ca. 50 nm Durchmesser und Zwischenzellspalten von 0,1 bis 1 µm Weite. Zwischen den Endothelzellen im Gehirn gibt es dagegen keine Fenestrierungen und keine Intrazellularspalten,[7] weshalb man auch von einem kontinuierlichen Endothel spricht.[8] Die dem Innenraum der Kapillare zugewandte (luminale) Membran unterscheidet sich bezüglich der Art der Membranproteine erheblich von der dem Interstitium zugewandten apikalen Seite.
Die Anzahl an pinozytotischen Vesikeln, die eine Endozytose von gelösten Substanzen ermöglichen, ist im Endothel des Gehirns sehr gering.[9][10]

Im Gegensatz dazu ist die Anzahl an Mitochondrien etwa 5- bis 10-mal höher als in den peripheren Kapillaren. Dies ist ein Hinweis auf einen hohen Energiebedarf der Endothelien – unter anderem für aktive Transportprozesse – und eine hohe Stoffwechselaktivität.[3] Die Blut-Hirn-Schranke ist nicht nur eine physikalische, sondern auch eine metabolische beziehungsweise enzymatische Barriere.[11][12][13][14][15] In der Zellmembran der Endothelien befindet sich eine Reihe von Enzymen in deutlich höherer Anzahl als beispielsweise bei den Zellen des Parenchyms. Dazu gehören unter anderem γ-Glutamyltransferase, alkalische Phosphatase und Glucose-6-Phosphatase. Metabolisierende Enzyme wie Catechol-O-Methyltransferase, Monoaminooxidase oder Cytochrom P450 sind ebenfalls in einer relativ hohen Konzentration in den Endothelien aktiv.[16][17][18] Auf diese Weise werden viele Substanzen bereits vor oder während ihres intrazellulären Transportes metabolisiert.[11] Die Endothelzellen sind mit 0,3 bis 0,5 µm äußerst dünn. Enterozyten, die Epithelzellen des Darmes, sind im Vergleich dazu mit 17 bis 30 µm erheblich dicker.[19] Das Verhältnis von Cholesterin zu Phospholipiden liegt, wie bei anderen Endothelzellen auch, bei 0,7.[20] Reine Diffusionsprozesse durch die Zellmembran sind daher über die Blut-Hirn-Schranke ähnlich schnell wie bei anderen Endothelzellen.[21] Die Endothelzellen weisen auf ihrer Zellmembran für die Regulation des Wasserhaushaltes des Gehirnes eine Vielzahl von Aquaporinen auf. Diese Kanäle ermöglichen Wassermolekülen die freie Diffusion sowohl in Richtung Gehirn als auch zum Blut.[22]
Die nicht vorhandenen Fenestrierungen und der Mangel an pinozytotischen Vesikeln stellen die passive Barriere der Blut-Hirn-Schranke dar. Diese Barrierewirkung ist physikalisch über ihren elektrischen Widerstand quantifizierbar. Bei einer gesunden adulten Farbratte liegt der Widerstand bei ungefähr 1500 bis 2000 Ω cm². Dagegen liegt der Wert für die Kapillaren im Muskelgewebe bei etwa 30 Ω cm².[23]
Die später noch ausführlicher beschriebenen aktiven Transportersysteme des Endothels bilden die aktive Barriere der Blut-Hirn-Schranke.
Die Tight Junctions
[Bearbeiten | Quelltext bearbeiten]

| A Lumen (Biologie) B apikale Seite C basale Seite a Mucus b apikale Seite c basolaterale Oberfläche d Tight Junctions f parazellulärer Raum g Zellmembran | e Proteinkomplex 1 Occludin 2 Claudin-1 3 E-Cadherin 4 ZO-1 5 JAM-1 6 Catenine 7 Cingulin 8 Aktin |

Die Endothelzellen sind über feste Zell-Zell-Verbindungen, die sogenannten Tight Junctions, miteinander verbunden. Diese Tight Junctions stellen dichte Verbindungen zwischen benachbarten Zellen dar und liefern einen wesentlichen Beitrag für die Schrankenfunktion der Blut-Hirn-Schranke.[24][25] Denn sie dichten den Raum zwischen den Zellen ab und schließen so einen parazellulären Transport, die Passage von Stoffen längs des interzellulären Spaltraums zwischen benachbarten Endothelzellen an diesen vorbei, praktisch aus.[26][27][28]
Mehrere Transmembranproteine, wie Occludin, verschiedene Claudine und Junctional Adhesion Molecules (JAM), verknüpfen die Endothelien im apikalen Bereich der lateralen Zellwände durch umlaufende Proteinbänder in Tight junctions, und unterbinden damit die parazelluläre Passage via Zwischenzellspalt zweier Endothelzellen für größere Moleküle weitgehend.[29] Die einzelnen Protein-Protein-Verbindungen wirken wie parallel verschaltete Sicherungen. Die Endothelzellen der Blut-Hirn-Schranke exprimieren von den 24 bekannten Claudinen nur Claudin-5 und Claudin-12. Claudin-5 wird dabei als wichtigstes Zelladhäsionsprotein der Blut-Hirn-Schranke angesehen.[30] Das Ausschalten (Gen-Knockout) des CLDN5-Gens, das für Claudin-5 codiert, führt bei Mäusen dazu, dass die Blut-Hirn-Schranke für Moleküle mit einer molaren Masse von bis zu 800 g·mol−1 durchlässig wird. Die so genetisch veränderten Tiere verstarben innerhalb weniger Stunden nach ihrer Geburt.[31]
Durch die Fixierung der Endothelien wird zugleich deren Ausrichtung in zwei sehr unterschiedliche Seiten gewährleistet: in die luminale, dem Blut entgegengerichtete Seite und die abluminale, dem Gehirn zugewandte Seite.[6]
Die Basallamina
[Bearbeiten | Quelltext bearbeiten]
Die Endothelzellen sind von einer Proteinschicht, der Basallamina, vollständig umgeben.[8] Diese Doppelschicht ist ungefähr 40 bis 50 nm stark und nur im Elektronenmikroskop sichtbar. Sie besteht im Wesentlichen aus dem Kollagen Typ IV, Heparinsulfat-Proteoglykanen, Laminin, Fibronektin und anderen extrazellulären Matrixproteinen. Die Basallamina grenzt an die Plasmamembran der Endfüßchen der Astrozyten.[10][26]
Die Perizyten
[Bearbeiten | Quelltext bearbeiten]

Perizyten, vor allem in der älteren Literatur nach ihrem Entdecker Charles Marie Benjamin Rouget (1824–1904) als Rouget-Zellen[32] bezeichnet, sind ein wichtiger Bestandteil der Blut-Hirn-Schranke.[33] Drei wesentliche Eigenschaften stehen dabei im Vordergrund: ihre Fähigkeit zur Kontraktion, die Regulierung der Endothelien und ihre Makrophagen-Aktivität.[34]
Etwa 20 % der äußeren Endotheloberfläche der zerebralen Kapillaren ist von den relativ kleinen, oval geformten Perizyten bedeckt und jede zweite bis vierte Endothelzelle ist mit einem Perizyten verbunden.[6] Bevorzugt befinden sich die Perizyten dabei an der Kontaktstelle zweier Endothelzellen.[35][36] Perizyten finden sich auf nahezu allen Arteriolen, Venolen und Kapillaren – nicht nur im zerebralen Endothel. Der Bedeckungsgrad des Endothels mit Perizyten korreliert unmittelbar mit der Undurchlässigkeit der Tight Junctions. Bei fenestrierten Kapillaren, beispielsweise in der Skelettmuskulatur, liegt das Verhältnis von Endothelien zu Perizyten bei 100:1.[37][38]
Wie die Endothelien sind auch die Perizyten von einer kontinuierlichen Basallamina umgeben.[8]
Der Zellkontakt Perizyt-Endothel
[Bearbeiten | Quelltext bearbeiten]
Diese kanalbildenden Proteinkomplexe sind ein Verbindungstyp, über den die Perizyten mit den Endothelzellen verbunden sind.
Die Perizyten sind fest mit den Endothelzellen verankert. Mindestens drei Arten von Perizyt-Endothel-Kontakten bilden dabei die Verbindung zwischen diesen beiden Zelltypen. Dies sind Gap Junctions (kanalbildende Proteinkomplexe), fokale Adhäsion (Adhesion Plaques) und Peg-and-Socket-Invaginationen.[34] Die Gap Junctions verbinden dabei die beiden Zytoplasmen direkt miteinander und ermöglichen über Kanäle den Austausch von Ionen und kleineren Molekülen zwischen den beiden Zelltypen.[39] Über die fokale Adhäsion sind die Perizyten mit den Endothelien mechanisch fest verankert.[40] Die Peg-and-Socket-Invaginationen bestehen aus wechselseitig verflochtenen Ausstülpungen der beiden miteinander verbundenen Zellen.[41] Auch dieser Zellkontakttyp trägt offensichtlich zur mechanischen Verankerung der Perizyten auf den Endothelien bei.[34]
Beide Zelltypen beeinflussen sich wechselseitig bezüglich ihrer Mitose und vermutlich auch bezüglich ihrer phänotypischen Expressionen.[42]
Kontraktion
[Bearbeiten | Quelltext bearbeiten]Perizyten haben einen hohen Anteil des kontraktilen Strukturproteins Aktin. Sie können dadurch über ihre Fortsätze den Kapillardurchmesser verändern und so den Blutdruck lokal regulieren.[43][44]
Makrozytische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Eine spezielle Eigenschaft weisen offensichtlich nur die auf den zerebralen Kapillaren liegenden Perizyten auf. Sie fungieren dort als Makrophagen. So befinden sich im Zytoplasma der Perizyten viele Lysosomen und in vivo zeigen sie die Fähigkeit zur Aufnahme von löslichen Tracern, die intravenös oder intraventrikular verabreicht werden und sonst nur von Makrophagen aufgenommen werden. In Gewebekulturen wurde bei Perizyten die Fähigkeit zur Phagozytose[45][46] und der Antigen-Präsentation[47][48] nachgewiesen.[34]
Diese makrozytischen Eigenschaften sind eine „zweite Abwehrfront“ (second line of defense) gegen neurotoxische Moleküle, die die Endothelschicht in Richtung Gehirn bereits passiert haben.[49] Perizyten tragen daher wesentlich zum Immunsystem des Zentralnervensystems bei. Andererseits sind sie durch diese Eigenschaften auch bei der Entwicklung verschiedener Erkrankungen, speziell Autoimmunerkrankungen, beteiligt. Auch eine mittelbare Beteiligung an der Alzheimer-Krankheit wird diskutiert.[50][51]
Weitere Eigenschaften der zerebralen Perizyten
[Bearbeiten | Quelltext bearbeiten]Die Perizyten regulieren die Zellteilung und die Differenzierung der Endothelien. Zudem sind sie aus pluripotenten adulten Stammzellen gebildete Vorläuferzellen (Progenitorzellen), die sich in Osteoblasten, Adipozyten, Chondrozyten und fibroblastähnliche Zellen differenzieren können.[42] Einige Autoren bezeichnen Perizyten daher als pluripotent.[32]
Perizyten synthetisieren eine Reihe von vasoaktiven Agonisten[38] und spielen bei der Neubildung von Blutgefäßen (Angiogenese) eine wichtige Rolle.[42][52]
Die Astrozyten
[Bearbeiten | Quelltext bearbeiten]

Astrozyten sind sternförmig verzweigte, im Vergleich zu den Perizyten deutlich größere Zellen aus der Familie der Makroglia. Sie werden dem Zentralen Nervensystem zugerechnet und sind nach der Geburt noch teilungsfähig. Bei höheren Wirbeltieren haben sie keine direkte Schrankenfunktion, auch wenn sie die Kapillargefäße im Gehirn zu etwa 99 % mit ihren Endfüßchen bedecken.[6][53] Sie stehen allerdings in unmittelbarer Wechselwirkung mit den Endothelien.[54] Astrozyten induzieren in den Endothelien der zerebralen Blutgefäße die Funktion der Blut-Hirn-Schranke. Dies wurde durch Transplantationsversuche nachgewiesen. Zerebrale Blutgefäße, die in periphere Organe verpflanzt wurden, verhielten sich wie die dort vorhandenen „normalen“ Kapillaren und bildeten beispielsweise Fenestrierungen aus. Im umgekehrten Versuch nahmen periphere Kapillaren, die in das Zentralnervensystem verpflanzt wurden, den dortigen Phänotyp mit Tight Junctions an.[1][55] Auch in In-vitro-Versuchen zeigt sich der Einfluss der Astrozyten auf die Phänotypausprägung der Endothelien. In Co-Kulturen aus Astrozyten und Endothelzellen weisen die Endothelien eine höhere Dichtigkeit auf als in reinen Endothelkulturen.[56]
Astrozyten schütten eine Reihe von Botenstoffen aus, die die Durchlässigkeit des Endothels im Sekunden- bis Minutenbereich modulieren können.[57] Umgekehrt schütten die Endothelzellen den Leukämieinhibierenden Faktor (LIF), ein Zytokin der Interleukin-6-Klasse, aus, der die Differenzierung der Astrozyten induziert.[57] Der Abstand der Astrozytenfüßchen zu den Endothelzellen und den Perizyten beträgt nur 20 nm.[6][58]
Die Hauptaufgabe der Astrozyten sind jedoch die selektive Versorgung der Neuronen mit Nährstoffen sowie die Regulation der extrazellulären Ionenkonzentrationen.[57][59] Ein Großteil des im Gehirn vorhandenen Cholesterols wird von Astrozyten produziert. Cholesterol kann die Blut-Hirn-Schranke nicht passieren, weshalb es lokal innerhalb des Gehirns synthetisiert werden muss. Im Gehirn befinden sich etwa 25 % des Cholesterols des gesamten Körpers; im Wesentlichen im Myelin, das die Axone der Neuronen ummantelt.[60]

Die Endfüßchen der Astrozyten bilden einen filigranen rosettenartigen Kontakt zu den Endothelzellen. Diese Anordnung ist für die wechselseitige Beeinflussung und Kommunikation der beiden Zelltypen wichtig. So ist zudem eine freie Diffusion zwischen dem Endothel und dem Parenchym des Gehirns möglich.[57]
Erkrankungen, die direkt oder indirekt die Astrozyten betreffen, wie beispielsweise die Alzheimer-Krankheit oder bei Astrozytomen, können durch die enge Wechselwirkung zwischen Astrozyten und Endothel die Blut-Hirn-Schranke in ihrer Funktion erheblich beeinträchtigen.
Bereiche des Gehirns ohne Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]

Nicht alle Kapillaren des Gehirns sind als Blut-Hirn-Schranke aufgebaut. So sind Hirnareale, die neuroendokrine Verbindungen (Hormone) an das Blut abgeben oder eine sensorische Funktion – beispielsweise für bestimmte Peptid-Hormone – haben, notwendigerweise ohne Blut-Hirn-Schranke. Dies ist bei sechs zirkumventrikulären Organen der Fall. Die Zirbeldrüse, die Eminentia mediana, die Neurohypophyse, die Area postrema, das Organum vasculosum laminae terminalis und das Organum subfornicale weisen fenestrierte Kapillaren auf. Beispielsweise können so die Neuronen der Area postrema für den Körper toxische Substanzen detektieren und im Brechzentrum einen Brechreiz stimulieren. Beim Organum subcommissurale ist als einzigem der zirkumventrikulären Organe die Blut-Hirn-Schranke vorhanden.[61] Um das umliegende Hirngewebe zu schützen, sind die zirkumventrikulären Organe von Tanyzyten umgeben. Dies sind spezielle Ependymzellen mit sehr dichten Tight Junctions.[62]
Daten der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]Ein Netz von über 100 Milliarden Kapillargefäßen, deren Gesamtlänge bei einem Erwachsenen ungefähr 600 km beträgt, durchzieht das gesamte Gehirn.[21] Der durchschnittliche Abstand dieser Blutgefäße beträgt 40 µm.[63] Die unterschiedlichen Hirnregionen werden unterschiedlich stark versorgt. Die Dichte an Kapillargefäßen ist in der Großhirnrinde (Cortex cerebri) mit 300 bis 800 Kapillarquerschnitten pro mm² Gewebe am höchsten.[1]
Die Gesamtfläche der Blutgefäße im Gehirn liegt zwischen 12[64] und 20 m².[65] Etwa 610 ml Blut fließen pro Minute durch diese Gefäße, wobei die mittlere Strömungsgeschwindigkeit bei 1 mm/s liegt. Der mittlere Blutdruck ist dabei im Bereich von 15 bis 35 mmHg.[3] Die mittlere Passagezeit (mean transit time MTT) beträgt 5 Sekunden. Im Vergleich dazu liegt sie im Darm, dessen Blutgefäße eine Oberfläche von 180 m² aufweisen, bei etwa 40 Stunden[66][67] und in der Leber – mit 70 m² – bei 30 Sekunden.[68][69][70]
Die Entwicklung der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]Bis zum Ende des 20. Jahrhunderts ging man davon aus, dass in Feten und Neugeborenen die Blut-Hirn-Schranke noch nicht vollständig ausgebildet („unreif“) sei oder gar fehle. Die Ursache für diese auch heute noch weitverbreitete Meinung sind methodische Unzulänglichkeiten in früheren physiologischen Versuchen. Dabei wurden meist proteinbindende Farbstoffe oder Proteine selbst als Marker in Tierfeten injiziert. Die ersten Versuche dazu wurden bereits 1920 durchgeführt.[71] In diesen Versuchen wurden die Marker im Gehirn oder im Liquor bei den Feten nachgewiesen, während sie bei den adulten Tieren nicht nachweisbar waren. Dabei wurden allerdings entweder Volumina injiziert, die teilweise bis an das Blutvolumen der Versuchstiere reichten[72] oder das Bindungsvermögen der Plasmaproteine um den Faktor zwei übertrafen.[73] In beiden Fällen ist der osmotische Druck so hoch, dass die empfindlichen embryonalen Kapillargefäße[74] partiell reißen können. In Versuchen mit reduzierten Markervolumina wird keine Passage der Marker in das Gehirn festgestellt.[75][76][77]
Betrachtet man körpereigene Markermoleküle, wie beispielsweise Albumin, α-1-Fetoprotein oder Transferrin, die auch in einem sehr frühen embryonalen Stadium in einer hohen Konzentration im Plasma zu finden sind, so lassen sich diese Moleküle zu keinem Zeitpunkt im extrazellulären Raum des Gehirns nachweisen.[78] Auch der Efflux-Transporter P-Glykoprotein ist schon in den embryonalen Endothelien vorhanden.[79] Die Blut-Hirn-Schranke ist folglich schon im pränatalen Stadium vorhanden. Dies schließt jedoch Veränderungen, speziell an den Tight Junctions, im Laufe der embryonalen Entwicklung nicht aus. Die Tight Junctions selbst sind schon in einem äußerst frühen Stadium zwischen den Endothelzellen vorhanden, unterliegen aber einer progressiven Entwicklung.[77]
Für kleine polare Moleküle, wie beispielsweise Inulin oder Saccharose, ist die Durchlässigkeit der pränatalen und neonatalen Blut-Hirn-Schranke signifikant höher als bei der adulten.[80][81][82] Der gleiche Effekt ist auch bei Ionen zu beobachten.[83] Der Transport von Aminosäuren über die embryonale Blut-Hirn-Schranke ist – offensichtlich bedingt durch den großen Bedarf zur weiteren Entwicklung des Gehirnes – ebenfalls deutlich erhöht.[84][85][86] Gleiches gilt für das Hormon Insulin.[87]
Andererseits bildet das embryonale Gehirn zusätzliche morphologische Barrieren aus, die im adulten Gehirn nicht mehr vorhanden sind. So finden sich im embryonalen Gehirn beispielsweise an der Grenzfläche zwischen Liquor und Hirngewebe sogenannte Strap Junctions auf dem inneren Ependym.[88]
Die Blut-Hirn-Schranke im Tierreich und im Lauf der Evolution
[Bearbeiten | Quelltext bearbeiten]
Im Laufe der Evolution wurde das neurale Gewebe von Wirbellosen und Wirbeltieren größer, komplexer und nahm eine immer zentralere Rolle im jeweiligen Organismus ein. Dadurch konnte die Koordination der Körperfunktionen ständig weiter verbessert werden. Dies wiederum führt zu einem Vorteil bei der Selektion. Andererseits muss eine größer und komplexer werdende Hirnmasse auch besser mit Nährstoffen versorgt und von Stoffwechselprodukten wieder befreit werden. Dies wird bei höher entwickelten Wirbellosen, beispielsweise aus der Ordnung der Zehnfußkrebse oder der Klasse der Kopffüßer, und allen Wirbeltieren durch ein weit verzweigtes Kapillarnetzwerk im Gehirn gewährleistet. Die Ausbildung einer Schutzbarriere gegen Xenobiotika, Toxine und andere für das neuronale System schädlicher Stoffe ist dabei ein weiterer evolutionärer Vorteil.[5][89]
Viele Wirbellose haben keine Blut-Hirn-Schranke. Das heißt, die Endothelien sind meist nur unvollständig ausgekleidet oder lückenhaft. Bei den Wirbellosen, bei denen eine Blut-Hirn-Schranke vorhanden ist, so beispielsweise bei Insekten, Krebsen (Crustacea) und Kopffüßern (Cephalopoda),[90] ist sie ausschließlich glialer Natur.[91] Man spricht in diesen Fällen von einer glialen Blut-Hirn-Schranke.[92]
Der Modellorganismus Drosophila bildet beispielsweise eine gliale Blut-Hirn-Schranke aus.[93]
Alle Wirbeltiere haben eine Blut-Hirn-Schranke, und fast alle bilden die endotheliale Blut-Hirn-Schranke aus, bei der die Tight Junctions der Endothelien den wesentlichen Beitrag zur Barrierewirkung leisten. Lediglich bei der Unterklasse der Plattenkiemer (Elasmobranchii), zu der unter anderem die Haie und Rochen gehören, sowie der Familie der Störe wird die Barrierewirkung der Blut-Hirn-Schranke durch die perivaskulären Astrozyten gewährleistet. Es wird davon ausgegangen, dass im Verlauf der Evolution das Endothel, wenn es dicht genug ausgebildet war, die Barrierewirkung übernahm. Die gliale Blut-Hirn-Schranke wird deshalb auch als die Ur-Form der Blut-Hirn-Schranke angesehen. Bei der Familie der Flösselhechte (Polypteridae) und der Ordnung der Lungenfische wird die Blut-Hirn-Schranke durch die Tight Junctions der Endothelien ausgebildet. Dagegen wird sie bei den Echten Stören durch eine komplexe Umhüllung von Gliazellen ohne erkennbare Tight Junctions geformt.
Noch heute finden sich in einigen Wirbeltieren Elemente der glialen Barriere, so beispielsweise in der Glia limitans des gefäßlosen (avaskulären) Rückenmarks der Neunaugen[94] sowie bei Säugetieren in bestimmten ependymialen Strukturen wie den Tanyzyten, letztere speziell in den zirkumventrikulären Organen, im Plexus choroideus und im Pigmentepithel der Netzhaut (RPE).[95] Astrozyten sind auch bei Säugetieren prinzipiell in der Lage, untereinander Tight Junctions auszubilden. Dies lässt sich unter anderem an den olfaktorischen Hüllzellen (OEC, engl. olfactory ensheathing cells) nachweisen, die wachsende Axone umschließen.[5][96]
Aus den strukturellen Unterschieden im Phänotyp der glialen Blut-Hirn-Schranke bei Wirbellosen lässt sich des Weiteren ableiten, dass solche Barrieren im Laufe der Evolution mehrfach und unabhängig voneinander aufkamen. Die endothelialen Barrieren bieten dabei einen signifikanten Vorteil bei der Selektion – vermutlich durch die striktere Trennung der Funktion von Endothel und Astrozyten. Der wesentliche Selektionsdruck kam dabei vermutlich durch die Notwendigkeit der Homöostase.[91] Es wird vermutet, dass die endotheliale Blut-Hirn-Schranke im Laufe der Evolution sich mindestens sechsmal entwickelte und dass alle Wirbeltiere vor 400 bis 500 Millionen Jahren mit einer glialen Blut-Hirn-Schranke versehen waren.[5]
Blut-Liquor-Schranke
[Bearbeiten | Quelltext bearbeiten]Neben der Blut-Hirn-Schranke besteht als zweite Grenze zwischen Blutkreislauf und Zentralnervensystem die Blut-Liquor-Schranke. Diese Blut-Liquor-Schranke wird durch Epithelzellen und Tight Junctions der Plexus choroidei gebildet.[97][98] Auch die Blut-Liquor-Schranke sichert die Homöostase des Zentralnervensystems. Durch sie können nur niedermolekulare Stoffe als Ultrafiltrat vom intravasalen Raum der Blutgefäße in den Liquorraum übertreten oder solche, die von den Ependymzellen eines Plexus choroideus aktiv aufgenommen und sezerniert werden. Der Beitrag zum Stoffaustausch ist allerdings gering und kann den Bedarf des Gehirns bei weitem nicht decken. Die Austauschfläche der Plexusepithelien ist etwa 5000-mal geringer als die des die Blut-Hirn-Schranke bildenden intrazerebralen Kapillarnetzes.
Außer diesen beiden für das Zentralnervensystem so wichtigen Barrieren sind im Körper des Menschen weitere ähnliche hochselektive Schranken zu finden, die den Stoffaustausch über das Blut kontrollieren. Dies sind unter anderem die Blut-Plazenta-Schranke, die Blut-Hoden-Schranke, die Blut-Harn-Schranke, die Blut-Augen-Schranke, die Blut-Thymus-Schranke und die Blut-Luft-Schranke.
Transportprozesse der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]
Die Blut-Hirn-Schranke muss trotz ihrer Funktion als Schutzbarriere auch den Transport von Nährstoffen zum Gehirn, beziehungsweise den Abtransport von Stoffwechselprodukten aus dem Gehirn, gewährleisten. Wasserlösliche Nährstoffe und Peptide überwinden die Blut-Hirn-Schranke im Wesentlichen durch spezifische Transporter oder spezielle Kanäle in der Zellmembran. Die meisten anderen löslichen Verbindungen passieren – wenn überhaupt – diese Barriere durch Diffusion.[11][15]
Parazellulärer Transport
[Bearbeiten | Quelltext bearbeiten]Bei peripheren Kapillaren findet der Stofftransport zu Organen und Muskeln im Wesentlichen durch Fenestrierungen und Intrazellularspalten statt. Bei einem gesunden und intakten zerebralen Endothel sind die einzelnen Endothelzellen untereinander über die Tight Junctions dicht verbunden. Die Kapillargefäße des Gehirns lassen daher hauptsächlich nur einen transmembranen Stofftransport zu, der zudem von den Zellen besser als der parazelluläre Transport geregelt werden kann.[99] Wasser, Glycerin und Harnstoff sind Beispiele für kleine polare Verbindungen, die durch die Tight Junctions der Blut-Hirn-Schranke hindurchdiffundieren können.[100]
Freie Diffusion
[Bearbeiten | Quelltext bearbeiten]

Die einfachste Form des Transportes durch die Blut-Hirn-Schranke stellt die freie Diffusion dar. Dieser auch als passiver Transport bezeichnete Austausch kann prinzipiell sowohl durch die Zellmembran der Endothelien als auch durch die Tight Junctions stattfinden. Dabei wird – wie bei jeder Diffusion – ein Konzentrationsausgleich oder der Ausgleich eines elektrochemischen Gradienten angestrebt. Bei der freien Diffusion wird für den Membrantransport keine Energie aus der Zelle benötigt. Der Materialfluss ist proportional zur Konzentration und kann von der Zelle nicht reguliert werden.[101]
Die lipophilen („fettfreundlichen“) Eigenschaften der Zellmembran und ihre dichte Verknüpfung über die Tight Junctions reduzieren die Zahl der Substanzen, die durch Diffusion die Blut-Hirn-Schranke überwinden können, allerdings erheblich. Die Durchlässigkeit der Blut-Hirn-Schranke für ein bestimmtes Molekül steht in direktem Verhältnis zu seiner Lipophilie.[102] Bezüglich der molaren Masse verhält es sich umgekehrt proportional. Das heißt, je lipophiler und kleiner eine Verbindung ist, umso leichter kann sie durch das Endothel hindurch diffundieren.[11] Für die molare Masse eines Moleküls wird als Grenzwert eine maximale Größe von 400 bis 500 g·mol−1 bei einer intakten Blut-Hirn-Schranke angegeben. Moleküle oberhalb dieses Grenzwertes können nicht durch die Blut-Hirn-Schranke diffundieren. Man darf die Blut-Hirn-Schranke allerdings nicht als diskrete Barriere verstehen, die eine bestimmte Molekülgröße komplett zurückhält und einer kleineren vollständig die Diffusion in das Gehirn ermöglicht. Die Diffusionsprozesse an der Blut-Hirn-Schranke sind dynamische Gleichgewichte. Für ein Molekül mit einer Querschnittsfläche von 0,52 nm², was einer molaren Masse von etwa 200 g·mol−1 entspricht, ist die Blut-Hirn-Schranke um den Faktor 100 durchlässiger als für ein Molekül mit einer Fläche von 1,05 nm² (= 450 g·mol−1).[20][103]

Der Göttinger Biophysiker Hermann Träuble entwickelte 1971 eine Theorie über den Transport von kleinen Molekülen durch die Zellmembran. Danach sind kleine, zwischen den Fettsäureketten der Lipiddoppelschichten befindliche Hohlräume für den diffusen Transport verantwortlich. Die Hohlräume entstehen durch Übergänge der anti- zur gauche-Konformation (trans-gauche-trans Kinks) in den Fettsäureresten der Phospholipide der Zellmembran. Zwischen diesen Konformationsübergängen liegen nur sehr niedrige Energieschwellen. Die Kinks (engl. kink ‚Knick‘) sind beweglich und wandern mit dem zu transportierenden Molekül durch die Membran.[104][105][106][107] Träubles Theorie wurde 1974 von Anna und Joachim Seelig NMR-spektroskopisch bestätigt.[108][109]
Bezüglich der Lipophilie ist der Verteilungskoeffizient in Oktanol/Wasser ein wichtiger Indikator für die Fähigkeit einer Substanz, durch die Blut-Hirn-Schranke diffundieren zu können.[110] Der Verteilungskoeffizient wird üblicherweise in logarithmischer Form als log P angegeben. Ein log P-Wert einer Substanz von beispielsweise 3,8 bedeutet dabei, dass diese Substanz sich in einer um den Faktor 103,8 höheren Konzentration in Oktanol (lipophil) als in Wasser (hydrophil) verteilt. Liegt der log P-Wert bei 0, so verteilt sich die Substanz in beiden Phasen gleich, ist er negativ, so ist die Substanz hydrophil. Lipophile Substanzen können prinzipiell am leichtesten die aus Fettsäuren aufgebaute Plasmamembran der Zellen passieren. Liegt der log P-Wert oberhalb von 3, so nimmt dieser Effekt meist wieder ab, da solche Moleküle eine hohe Bindungsaffinität zu Plasmaproteinen haben.
Die Vorhersage über das Penetrationsvermögen einer Substanz in das Gehirn ist über verschiedene Modelle und Simulationen ex vivo beziehungsweise in silico möglich.[111] An isolierten Endothelzellkulturen sind verlässliche in-vitro-Untersuchungen durchführbar.[15][103][112][113]
Lipophilie und kleine Molekülgröße sind keine Garantie für eine mögliche Diffusion zum Gehirn. So sind beispielsweise über 98 % aller niedermolekularen Pharmaka (small molecules) nicht in der Lage, die Blut-Hirn-Schranke zu passieren. Hochmolekulare Substanzen, wie beispielsweise monoklonale Antikörper, rekombinante Proteine, Antisense-RNA oder Aptamere, werden per se von der Blut-Hirn-Schranke zurückgehalten.[114]
Kanalvermittelte Permeabilität
[Bearbeiten | Quelltext bearbeiten]

Kleine polare Moleküle, wie beispielsweise Wasser, können nur sehr eingeschränkt über die hydrophoben Kinks durch das Endothel diffundieren. Dennoch weist die Blut-Hirn-Schranke eine sehr hohe Permeabilität für Wasser auf. Dies wurde von William Henry Oldendorf (1925–1992) 1970 in Versuchen mit Tritium-markiertem Wasser nachgewiesen.[115]
Für die Diffusion von Wasser befinden sich in der Zellmembran spezielle hydrophile Kanal-Proteine, die Aquaporine. Während nicht-zerebrale Endothelien sehr oft Aquaporin-1 (AQP1) exprimieren, ist dieses Gen an der Blut-Hirn-Schranke inaktiviert. Die Anwesenheit der Astrozyten inhibiert die AQP1-Expression.[116] Die spezialisierten zerebralen Endothelien exprimieren im Wesentlichen Aquaporin-4 (AQP4)[117] und Aquaporin-9 (AQP9).
Über die Aquaporine wird der Wasserhaushalt des Gehirns reguliert. Sie ermöglichen eine hohe Kapazität für die Diffusion von Wasser in beide Richtungen, jeweils dem osmotischen Gradienten folgend.[118] Für Glycerin, Harnstoff und Monocarboxylate[119] bilden die Aquaglyceroporine eigene Kanäle in der Plasmamembran. An der Blut-Hirn-Schranke ist dies im Wesentlichen das auch für den Wassertransport zuständige Aquaporin-9.[119]
Kanäle sind für den Molekültransport wesentlich schneller als Transporter. Durch Spannungsimpulse oder interagierende Hormone und andere Einflussfaktoren können die Ionenkanäle aktiviert oder deaktiviert werden (Gating).[99]
Erleichterte Diffusion
[Bearbeiten | Quelltext bearbeiten]

Eine spezielle Form der Diffusion durch die Zellmembran der Endothelien ist die erleichterte Diffusion (engl. facilitated diffusion). Lebenswichtige Nährstoffe wie Glucose und viele Aminosäuren sind zu polar und zu groß, um auf den bisher geschilderten Transportwegen in ausreichender Menge dem Gehirn über die Blut-Hirn-Schranke zur Verfügung gestellt zu werden. Für diese Moleküle gibt es in der Zellmembran ein spezielles Transportsystem: den sogenannten Carrier-vermittelten Transport. Beispielsweise wird die D-Glucose über den GLUT-1-Transporter in das Gehirn transportiert. Die Dichte der GLUT-1-Transporter ist auf der abluminalen Seite der Endothelien viermal höher als auf der luminalen, das heißt der zum Blut hin gerichteten, Seite.[120] Der Transport wird nur durch ein Konzentrationsgefälle ermöglicht und benötigt selbst keine Energie.
Neben der in relativ großen Mengen vom Gehirn benötigten D-Glucose gibt es außer GLUT-1 eine Reihe von weiteren speziellen Transportern. Sehr viele dieser Transporter sind aus der Familie der Solute Carrier (SLC), darunter beispielsweise MCT-1 und MCT-2, die eine Reihe von kurzkettigen Monocarbonsäuren – unter anderem Lactat, Pyruvat, Mevalonat, verschiedene Butyrate und Acetat – transportieren. SLC7 transportiert kationische Aminosäuren (Arginin, Lysin und Ornithin). Vom Modellorganismus Maus sind bisher 307 SLC-Gene bekannt. Davon werden über 200 im Choroid plexus und in anderen Gehirnbereichen exprimiert. An der Blut-Hirn-Schranke der gleichen Art wurden bisher allerdings nur 36 nachgewiesen. Etwa 70 % von den 36 haben Genprodukte, die am Transport von Nährstoffen, Vitaminen, Hormonen und Spurenelementen beteiligt sind. Besonders stark sind an der Blut-Hirn-Schranke die Thyroid-Transporter SLC16a2 und SLCO1c1, der Sulfat-Transporter SLC13a4, der L-Ascorbinsäure-Transporter SLC23a2, der Aminosäure-Transporter SLC 38a3 und der Folat-Transporter SLC19a1 exprimiert.[121] Ascorbinsäure (Vitamin C) wird in oxidierter Form über die Glukosetransporter dem Gehirn zugeführt.[122]
Die Transporter können als Uniporter (nur in eine Richtung), als Symporter in zwei Richtungen und als Antiporter in entgegengesetzter Richtung arbeiten.[123]
Aktiver Transport
[Bearbeiten | Quelltext bearbeiten]Bei den zuvor beschriebenen passiven Arten des Transportes durch das Endothel gelangen die Moleküle ohne zusätzlichen Bedarf an Energie zum Gehirn, beziehungsweise vom Gehirn weg. Sie folgen dabei dem jeweiligen Konzentrationsgefälle. Mit aktiven Transportern, sogenannten „Pumpen“, ist ein Transport auch gegen einen Konzentrationsgradienten möglich. Dabei wird allerdings direkt oder indirekt Energie in Form von Adenosintriphosphat benötigt.[99] Findet der aktive Transport vom Blut zum Gehirn statt, so spricht man von Influx („Einströmen“). In umgekehrter Richtung spricht man von Efflux („Abfluss“).
An der Blut-Hirn-Schranke befinden sich aktive Influx-Transporter für Leu-Enkephalin,[124][125] Arginin-Vasopressin (AVP)[126] und [D-Penicillamin2,D-Penicillamin5]-Enkephalin (DPDPE).[127]

P-Glykoprotein[128][129] – das Genprodukt des MDR1-Gens – war der erste Efflux-Transporter, der an der Blut-Hirn-Schranke identifiziert wurde.[130] Dazu kamen später die Multidrug Resistance-Related Proteine, beispielsweise MRP1,[131] die ebenfalls zu der Klasse der ABC-Transporter gehören. Das Brustkrebs-Resistenz-Protein (Breast Cancer Resistance Proteine, BCRP)[132][133] befindet sich zusammen mit dem P-Glykoprotein im Wesentlichen auf der zum Blut hin gerichteten luminalen Seite des Endothels.[132][134][135]
Einige der Efflux-Transporter arbeiten – wie auch ein Teil der Influx-Transporter – stereoselektiv. Das heißt, sie transportieren nur ein Enantiomer aus dem Gehirn ins Blutgefäßsystem. D-Asparaginsäure ist im Gehirn ein Präkursor von N-Methyl-D-Aspartat (NMDA) und beeinflusst die Sekretion verschiedener Hormone, wie beispielsweise Luteinisierendes Hormon, Testosteron oder Oxytocin.[136] Die L-Asparaginsäure gehört dagegen zusammen mit L-Glutaminsäure zu den stimulierenden Aminosäuren.[137] Der Efflux-Transporter ASCT2 (Alanin-Serin-Cystein-Transporter) der Blut-Hirn-Schranke transportiert nur das L-Enantiomer der Asparaginsäure, dessen Akkumulation neurotoxische Effekte zur Folge hätte. Das für den Aufbau von NMDA benötigte D-Enantiomer wird dagegen nicht von ASCT2 transportiert.[138] Die EAAT-Transporter (engl. excitatory amino acid transporter) SLC1A3, SLC1A2 und SLC1A6 transportieren dagegen beide Isoformen der Asparaginsäure.[4][139]
In epileptischem Gewebe ist P-Glykoprotein in den Endothelien und Astrozyten der Blut-Hirn-Schranke sowie in den Neuronen überexprimiert.[140][141]
Des Weiteren befinden sich die organischen Anionentransporter (OAT[142] und OATP[143]) und organische Kationentransporter[144] (OCT)[145] in der Zellmembran der Endothelien. Speziell die Efflux-Transporter können eine Vielzahl unterschiedlicher Substrate aktiv aus dem Endothel in die Kapillaren transportieren.[101]
Für eine Reihe von Transportprozessen am Endothel ist noch unklar, ob es sich um aktive (ATP-verbrauchende) oder Carrier-vermittelte Prozesse handelt.[4]
Vesikulärer Transport
[Bearbeiten | Quelltext bearbeiten]Rezeptorvermittelte Transzytose
[Bearbeiten | Quelltext bearbeiten]
Für den Transport ausgewählter großer Moleküle gibt es die rezeptorvermittelte Transzytose. Spezielle Rezeptoren, die durch die Zellmembran nach außen in das Lumen ragen, sind für die Erkennung der aufzunehmenden Substanzen zuständig.[1] So gelangt beispielsweise das 75,2 kDa schwere und aus 679 Aminosäuren bestehende Transferrin aus dem Blut in die extrazelluläre Flüssigkeit des Gehirns.[146] Die im Lumen befindlichen Rezeptoren werden nach der Anbindung des Transferrins internalisiert, das heißt in das Zellinnere eingeschleust. Über coated pits wird es dann auf die andere Seite der Zelle (abluminale Seite) transportiert und ausgeschleust. Mit dem gleichen Mechanismus wird über den LDL-Rezeptor der Transport von Low Density Lipoprotein zum Gehirn ermöglicht, um dort daraus Cholesterol produzieren zu können.[112][147] Auch Insulin[148] und andere Peptidhormone sowie Zytokine gelangen auf diesem Weg zum Gehirn.[1]
Adsorptionsvermittelte Transzytose
[Bearbeiten | Quelltext bearbeiten]Bei der adsorptionsvermittelten Transzytose (adsorptive-mediated transcytosis, AMT) bewirken elektrostatische Wechselwirkungen zwischen der durch Glykoproteinen negativ geladenen Zelloberfläche und positiv geladenen Molekülen (Kationen) einen Transport durch das Zytoplasma der Endothelien.[149] Diese Form des Transportes wird auch als kationischer Transport bezeichnet.[150] Eine positive Ladung weisen beispielsweise Peptide und Proteine auf, deren isoelektrischer Punkt im Basischen liegt.[151] Die kationische Transzytose durch das Endothel der Blut-Hirn-Schranke ermöglicht einen höheren Grad des Stofftransportes als die rezeptorvermittelte Transzytose.[152]
Die wichtigsten Transporter an der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]| Transporter | Bezeichnung (englisch) | Gen | Chromosom, Genlocus | Familie | Quelle |
| Erleichterte Diffusion | |||||
| GLUT1 | glucose transporter 1 | SLC2A1 | 1 p35-p31.3 | solute carrier | [153] |
| LAT1 | large neutral amino acid transporter 1 | SLC7A5 | 16 q24.3 | solute carrier | [153] |
| CAT1 | cationic amino acid transporter 1 | SLC7A1 | 13 q12.3 | solute carrier | [153] |
| MCT1 | monocarboxylic acid transporter 1 | SLC16A1 | 1 p13.2-p12 | solute carrier | [153] |
| CNT2 | concentrative nucleoside transporter 2 | SLC28A2 | 15 q15 | solute carrier | [153] |
| CHT1 | choline transporter 1 | SLC5A7 | 2 q12 | solute carrier | [153] |
| NBTX | nucleobase transporter | ? | ? | [153] | |
| Aktiver Efflux | |||||
| MDR1 | P-Glycoprotein | ABCB1 | 7 q21.1 | ATP-binding cassette | [154] |
| MRP1 | multidrug resistance protein 1 | ABCC1 | 16 p13.1 | ATP-binding cassette | [154] |
| MRP3 | multidrug resistance protein 3 | ABCC3 | 17 q22 | ATP-binding cassette | [154] |
| MRP4 | multidrug resistance protein 4 | ABCC4 | 13 q32 | ATP-binding cassette | [154] |
| MRP5 | multidrug resistance protein 5 | ABCC5 | 3 q27 | ATP-binding cassette | [154] |
| BCRP | breast cancer resistance protein | ABCG2 | 4 q22 | ATP-binding cassette | [154] |
| OAT3 | organic anion transporter 3 | SLC22A8 | 11 | solute carrier | [4] |
| OATP-A | organic anion transporter polypeptide A | SLC21A3 | 12 p12 | solute carrier | [4] |
| OATP3A1 | organic anion transporter polypeptide 3 | SLCO1A2 | 15 q26 | solute carrier | [4] |
| EAAT1 | excitatory amino acid transporter 5 | SLC1A3 | 5 p13 | solute carrier | [4] |
| TAUT | taurine transporter | SLC6A6 | 3 p25-q24 | solute carrier | [153] |
| Rezeptorvermittelter Transport | |||||
| INSR | Insulinrezeptor | INSR | 19 p13.2 | [153] | |
| TFR1 | transferrin receptor | TFRC | 3 q29 | [153] | |
| IGF1R | insuline-like growth factor 1 receptor | IGF1R | 15 q25-q26 | [153] | |
| LEPR | leptin receptor | LEPR | 1 p31 | [153] | |
| FCGRT | Fc fragment of IgC, receptor transporter | FCGRT | 19 q13.3 | [153] | |
| SCARB1 | scavenger receptor class B 1 | SCARB1 | 12 q24.31 | [153] |
Das Zusammenspiel der vielfältigen Mitglieder der Solute-Carrier-Familie und der ABC-Transporter ist ein äußerst effektiver Schutzmechanismus der Bluthirnschranke, um das Eindringen von Xenobiotika in das Gehirn zu verhindern.[155][156]
Messung und Darstellung der Durchlässigkeit der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]Bei der Entwicklung von neuen Pharmaka ist das Ausmaß, in welchem eine Substanz die Blut-Hirn-Schranke passieren kann, eine wichtige pharmakologische Größe (engl. brain uptake). Dies gilt sowohl für Neuropharmaka, die ihre Wirkung im Wesentlichen im Zentralnervensystem entfalten sollen, als auch für Pharmaka, die nur in der Peripherie wirken sollen.[157] Zur Untersuchung ob, in welchem Ausmaß und mit welchem Mechanismus eine Substanz die Blut-Hirn-Schranke überwinden kann, wurden in der Vergangenheit eine Reihe unterschiedliche Methoden entwickelt. Die klassischen Verfahren arbeiten mit Modellorganismen in vivo. Neuere Ansätze nutzen Zellkulturen (in vitro) und ein recht neues Verfahren arbeitet über Computersimulationen (in silico).[158] Durch den bei Säugetieren weitgehend gleichen Aufbau der Blut-Hirn-Schranke sind die In-vivo-Ergebnisse gut auf den Menschen übertragbar.
Physikalische Grundlagen
[Bearbeiten | Quelltext bearbeiten]Ein vereinfachtes, auf einer einzelnen Kapillare basierendes Modell wurde von Renkin (1959) und Crone (1965) für Messungen der Permeabilität der Blut-Hirn-Schranke aufgestellt. Trotz der Vereinfachungen ist dieses Modell die beste Näherung an die realen Verhältnisse.[159] Das sogenannte Permeabilitätsoberflächenprodukt (permeability surface area product) PS ist ein Maß für die Durchlässigkeit des Kapillarbettes. Das auch als Crone-Renkin-Konstante[160] bezeichnete Permeabilitätsoberflächenprodukt ist das Produkt aus dem Permeabilitätskoeffizienten einer bestimmten Substanz und der zur Verfügung stehenden Transferfläche. Die Maßeinheit ist ml·min−1·g−1 (g nasses Gewebe) und entspricht der der Perfusion (Blutfluss) Q. Die einseitige (unidirektionale) Extraktionsfraktion E, das ist der Anteil einer Substanz, der bei einer einzelnen Passage in das Gehirn transportiert wird, ergibt sich dann aus:
.
Wenn die Perfusion (Q) größer als das Permeabilitätsoberflächenprodukt (PS) ist, so ist der Stofftransfer perfusionslimitiert. Sind die Verhältnisse umgekehrt, so ist der Stofftransfer durch die Diffusion begrenzt.[161][162]
Prinzipbedingt ist der Wert von E für alle Substanzen immer kleiner als 1, da der Influx nicht größer als die Zufuhr an Substanz sein kann. Bei Werten kleiner als 0,2 spricht man üblicherweise davon, dass die Permeation der limitierende Faktor für den Stofftransport zum Gehirn ist. Im Bereich von 0,2 bis 0,8 ist die Permeation moderat.[159]
In-silico-Verfahren
[Bearbeiten | Quelltext bearbeiten]Die Simulationsverfahren werden vor allem in der sehr frühen Phase der Wirkstoffentwicklung, dem Drug Design, eingesetzt. Die Berechnungsmodelle beschränken sich derzeit auf passiven Transport durch Diffusion und einige molekulare Deskriptoren, wie Lipophilie, Ladung, molare Masse und Anzahl der Wasserstoffbrückenbindungen.[158]
In-vitro-Verfahren
[Bearbeiten | Quelltext bearbeiten]
In kultivierten Endothelzellen lassen sich quantitative Untersuchungen über das Verhalten von Substanzen an der Blut-Hirn-Schranke durchführen.
Das einfachste In-vitro-Verfahren ist die Verwendung von isolierten noch lebenden Kapillargefäßen. Damit sind Untersuchungen der Transportmechanismen auf zellulärer Ebene möglich.[15] Dabei werden teilweise auch Kapillaren humanen Ursprungs aus Autopsien eingesetzt. Die Kapillaren sind auch nach der Isolierung metabolisch aktiv, selbst wenn der ATP-Vorrat in den Zellen weitgehend aufgebraucht ist.[163] Bei diesem Verfahren sind allerdings sowohl die luminale als auch die abluminale Seite der Endothelien dem zu untersuchenden Wirkstoff ausgesetzt. Deshalb ist keine Differenzierung beider Seiten bezüglich der Wirkstoffaufnahme möglich. Mittels konfokaler Fluoreszenzmikroskopie kann bei inkubierten Kapillaren die räumliche Verteilung analysiert werden. So kann beispielsweise die Aufnahme fluoreszenzmarkierter monoklonaler Antikörper am Transferrinrezeptor untersucht werden.[164] Die Methode lässt sich so verfeinern, dass damit auch halbquantitative Assays für den Efflux von Wirkstoffen an der luminalen Seite der Endothelien möglich sind.[158][165]
Mit immortalisierten Endothelzelllinien lassen sich quantitative Aussagen über die Durchlässigkeit einer Substanz machen. Dazu gibt es inzwischen eine Vielfalt unterschiedlicher Zelllinien verschiedener Spezies. Diese Zelllinien werden sowohl für die Grundlagenforschung als auch für die Wirkstoffentwicklung verwendet.[166][167] Die Endothelzellen werden dabei, wie in den Kapillargefäßen auch, in einlagigen Schichten (Monolayer) gezüchtet. Die Qualität dieser Schichten lässt sich beispielsweise über den elektrischen Widerstand der Endothelschicht beurteilen. Der transendotheliale elektrische Widerstand (transendothelial electrical resistance = TEER) sollte dabei möglichst hoch sein. Im lebenden Organismus liegt dieser Wert oberhalb von 2000 ·cm²[23] und wird im Wesentlichen durch die Qualität der Tight Junctions bestimmt. In vitro werden meist um eine Größenordnung geringere Werte erreicht.[166] Diese Werte verbessern sich erheblich, wenn Ko-Kulturen von Endothelien und Astrozyten verwendet werden. Die Astrozyten beeinflussen die Genexpression der Endothelien zur Bildung von Tight Junctions positiv. Auf diese Weise können Werte von bis zu 800 ·cm² erreicht werden.[168] Ähnlich hohe Werte können auch ohne Astrozyten erreicht werden, wenn die Zellkultur Cortisol enthält.[158][169]
In-vivo-Verfahren
[Bearbeiten | Quelltext bearbeiten]
Das erste, von Paul Ehrlich angewandte Verfahren zur Darstellung der (Un)-Durchlässigkeit der Blut-Hirn-Schranke war die Injektion eines Farbstoffes und die anschließende Sektion des Versuchstieres. Farbstoffe, die in der Lage sind, die Blut-Hirn-Schranke zu überwinden, färben das Interstitium des Gehirns nachhaltig an. Das Verfahren ist auf Farbstoffe beschränkt und erlaubt nur qualitative Betrachtungen. In Untersuchungen zum gezielten Öffnen der Blut-Hirn-Schranke werden noch heute Farbstoffe angewendet.[170] Aus dem gleichen Grund ist die – in der Mikrobiologie sonst sehr häufig angewendete – Methode der Fluoreszenzmarkierung zur Untersuchung von Transportmechanismen kleiner Moleküle an der Blut-Hirn-Schranke gänzlich ungeeignet. Nur bei sehr großen Molekülen, wie Polypeptiden, bei denen das Molekül des Fluoreszenzfarbstoffes im Verhältnis zum Peptid relativ klein ist, kann die Fluoreszenzmarkierung angewendet werden.
Es wurden in der Vergangenheit eine Reihe unterschiedlicher In-vivo-Verfahren entwickelt, die zum Teil noch heute in der Praxis Anwendung finden. Generell sind die In-vivo-Methoden die Referenzverfahren. Die intravenöse oder intraarterielle Applizierung eines Wirkstoffs unter realen physiologischen Bedingungen in einem Modellorganismus und anschließende Analyse des Gehirngewebes kann derzeit durch kein In-vitro-Verfahren oder gar durch Simulationsrechnung ersetzt werden. Es sind die Verfahren mit der höchsten Empfindlichkeit, bei denen die Aufnahme einer Substanz im Gehirn über lange Zeiträume und mehrere Passagen der Blut-Hirn-Schranke bestimmt werden können.[158]
Brain-Uptake-Index
[Bearbeiten | Quelltext bearbeiten]Das erste Verfahren zur Quantifizierung der Aufnahme von Nähr- und Wirkstoffen über die Bluthirnschranke wurde 1970 von William H. Oldendorf entwickelt.[115] Dabei wird eine radioaktiv markierte Substanz zusammen mit einer ebenfalls radioaktiv markierten Referenzprobe direkt und möglichst schnell in die äußere Halsschlagader eines Versuchstieres (meist eine Ratte) injiziert. Etwa fünf Sekunden nach der Injektion wird das Tier dann dekapitiert, das Gehirn isoliert und über die Radioaktivität die Konzentration der darin enthaltenen markierten Substanzen ermittelt. Über das Verhältnis der Dosis der injizierten Substanzen und der im isolierten Gehirn gemessenen Dosis für Testsubstanz und Referenzprobe wird der sogenannte Brain-Uptake-Index (BUI) berechnet.
Das Verfahren ist wegen der sehr kurzen Zeit, in der die applizierten Substanzen verabreicht werden und permeieren können, nur für solche Substanzen geeignet, die die Blut-Hirn-Schranke schnell passieren. Hydrophile Verbindungen, wie beispielsweise viele Peptide, werden dagegen nur langsam aufgenommenen. Für solche Substanzen ist die Methode ungeeignet.[11][171]
Die zu untersuchenden Verbindungen sind meist Tritium- oder 14C-markiert. Als Referenzsubstanzen dienen beispielsweise tritiertes Wasser oder 14C-Butanol.[172] Das dem Versuchstier injizierte Volumen wird dabei möglichst klein gehalten. Volumina kleiner als 10 µl sind notwendig, um Strömungs- und Verteilungsartefakte zu vermeiden, da diese den gemessenen BUI beeinflussen.[173] Die Abhängigkeit des BUI von der Konzentration der injizierten Substanz ist dagegen eher gering.[174]
Der Brain-Uptake-Index verschiedener Substanzen
| Verbindung | BUI [%] | log P | M [g/mol] |
| Cytosin | 1,2 | −1,72 | 243,2 |
| Harnstoff | 1,4 | −1,52 | 60,1 |
| Mannitol | 2 | −2,11 | 182,2 |
| Thioharnstoff | 5 | −0,96 | 76,12 |
| Ethylenglycol | 18 | −1,3 | 62,1 |
| Acetamid | 23 | −1,1 | 59,1 |
| Methanol | 103 | −0,52 | 32 |
| Propylenglycol | 27 | −0,92 | 76,1 |
| Ethanol | 107 | −0,18 | 46,1 |
| Butanol | 117 | 0,93 | 74,1 |
| Benzylalkohol | 94 | 1,1 | 108,1 |
| Phenobarbital | 56 | 1,42 | 232,2 |
| Phenazon | 83 | 0,38 | 188,2 |
| Koffein | 103 | 0,02 | 194,2 |
| Phenytoin | 71 | 2,4 | 252,3 |
| Estradiol | 94 | 2,61 | 272,4 |
| Testosteron | 85 | 3,28 | 288,4 |
| Heroin | 87 | 1,14 | 369,4 |
| Morphin | 2,6[158] | −0,2[175] | 285,3 |
| Nikotin | 120[176] | 0,7[177] | 162,2 |
nach: ,[178] Daten, wenn nicht anders gekennzeichnet, aus:[103]
Brain-Efflux-Index
[Bearbeiten | Quelltext bearbeiten]Bei diesem 1995 entwickelten Verfahren wird der Efflux einer Substanz aus dem Gehirn über die Blut-Hirn-Schranke ins Blut bestimmt.[179][180]
Wie beim Brain-Uptake-Index wird die radioaktiv markierte Testsubstanz zusammen mit einer ebenfalls radioaktiv markierten Referenzverbindung per Mikroinjektion direkt in das Gehirn des Versuchstiers injiziert. Bei der Referenzverbindung wird allerdings ein nichtpermeabler Tracer – meist Inulin – verwendet. Auch hier wird das Versuchstier nach einer bestimmten Zeit dekapitiert und das Gehirn isoliert. Die Radioaktivität wird dann auf der gleichen Seite des Gehirns (ipsilateral) vermessen. Aus dem Anteil der Testsubstanz, der die Blut-Hirn-Schranke passiert und im Blut zirkuliert, und dem im Gehirn verbliebenen Anteil errechnet sich dann der Brain-Efflux-Index (BEI):
- .[11]
Gehirnperfusion
[Bearbeiten | Quelltext bearbeiten]Bei der Perfusionstechnik wird die zu untersuchende, radioaktiv markierte Substanz in die äußere Halsschlagader des Versuchstiers perfundiert. Danach wird das Tier getötet und das Gehirn entnommen. Das Gehirn wird homogenisiert und die darin befindliche Radioaktivität gemessen. Der Vorteil dieser Methode liegt darin, dass ein möglicher Abbau der Testsubstanz im Blut, beispielsweise durch darin enthaltene Enzyme, weitgehend verhindert wird.[180] Als Versuchstiere sind Meerschweinchen besonders geeignet, da die Halsschlagader nicht zwischen Nacken und Gehirn verzweigt ist, wie dies beispielsweise bei der Ratte der Fall ist. Dies ermöglicht es, die Perfusionsdauer auf bis zu 30 Minuten zu erhöhen, während bei der Ratte nur 20 Sekunden möglich sind.[181] Der operative Aufwand dieser Methode ist ausgesprochen hoch. Deshalb wird sie im Wesentlichen nur bei Substanzen angewendet, die keine ausreichende Stabilität im Plasma haben oder nur ein sehr geringes Perfusionsvermögen zum Gehirn besitzen.[11]
Eine verbesserte Variante ist das Kapillar-Verarmungsverfahren (engl. capillary depletion method). Dabei werden durch Zentrifugation die Kapillaren vom Hirngewebe abgetrennt.[182] Dadurch kann zwischen Transzytose beziehungsweise Diffusion, also der tatsächlichen Permeation ins Gehirn, und einer möglichen Endozytose im Endothel unterschieden werden.[11]
Indikator-Diffusionstechnik
[Bearbeiten | Quelltext bearbeiten]Bei der Indikator-Diffusionstechnik (engl. indicator diffusion technique) wird der zu untersuchende Wirkstoff zusammen mit einer Referenzsubstanz, die kein Permeationsvermögen hat, in die äußere Halsschlagader appliziert. Beide Substanzen müssen dabei nicht radioaktiv markiert sein. Aus dem Blutrückfluss, beispielsweise in der Vena jugularis interna, lässt sich die Konzentration beider Substanzen durch Blutentnahme und Analyse des Plasmas bestimmen. Aus der Abnahme der Testsubstanz im Blutrückfluss lässt sich die Permeation der Substanz in das Gehirn berechnen.[183]
Die Indikator-Diffusionstechnik ist beim Gehirn nur für Substanzen geeignet, die ein hohes Permeationsvermögen für dieses Organ besitzen.[184]
Quantitative Autoradiographie
[Bearbeiten | Quelltext bearbeiten]siehe Hauptartikel: Autoradiographie

Die quantitative Autoradiografie (QAR) wurde in den 1970er Jahren entwickelt.[185] Dabei wird die – meist mit 14C – radioaktiv markierte Substanz intravenös appliziert. Zu einem bestimmten Zeitpunkt werden die Organe isoliert und die getrockneten Gefrierschnitte auf einen Röntgenfilm oder eine hochauflösende szintigraphische Detektorplatte gelegt. Über den Schwärzungsgrad, beziehungsweise die detektierte Strahlendosis, kann mittels vergleichender Versuche mit Substanzen sehr geringer Permeabilität – beispielsweise mit 125I-markiertem Albumin – die Aufnahme der Substanz im Gehirn, aber auch in anderen Organen, gemessen werden. Wird in einer separaten Messung die lokale Perfusion bestimmt, lässt sich das Permeabilitätsoberflächenprodukt berechnen.[186]
Intrazerebrale Mikrodialyse
[Bearbeiten | Quelltext bearbeiten]Bei der intrazerebralen Mikrodialyse wird eine halbdurchlässige Membran in das Gehirngewebe implantiert. Über einen Mikrodialysekatheter, der sich im Inneren der Membran befindet, können Substanzen perfundiert werden. Anschließend können über den gleichen Katheter Proben des Perfusates entnommen und analysiert werden.
Im Versuchstier können damit vielfältige Untersuchungen und Versuche an der Blut-Hirn-Schranke durchgeführt werden. Ein Beispiel hierfür ist das weiter unten beschriebene Öffnen der Blut-Hirn-Schranke durch hypertonische Lösungen.[187] Die Methode ist für die kontinuierliche Flüssigkeitsentnahme geeignet. So können von intravenös oder oral verabreichten Substanzen Konzentrations-Zeit-Profile erstellt werden.[188][189]
Verschiedenste Experimente zur Erforschung von Transportmechanismen an der Blut-Hirn-Schranke lassen sich mit der intrazerebralen Mikrodialyse durchführen.[11][187][190][191]
In der Humanmedizin wird die intrazerebrale Mikrodialyse bei Schlaganfällen zum neurochemischen Monitoring angewendet.[192][193]
Bildgebende Verfahren
[Bearbeiten | Quelltext bearbeiten]Mit Hilfe der bildgebenden Verfahren ist eine nichtinvasive Darstellung und Messung der Durchlässigkeit der Blut-Hirn-Schranke mit verschiedenen Substanzen möglich. Diese Verfahren werden zum Teil in der klinischen Praxis in der Humanmedizin angewendet. Zur Anwendung kommen dabei die Positronen-Emissions-Tomographie (PET), die Magnetresonanzspektroskopie (MRS) und die Magnetresonanztomographie (MRT).
- PET
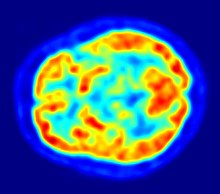
Mit der Positronen-Emissions-Tomographie werden zur Untersuchung der Blut-Hirn-Schranke im Wesentlichen die Efflux-Prozesse von potenziellen Wirkstoffen mit P-Glykoprotein dargestellt.[194] Das Verständnis der Funktion und der Beeinflussung von P-Glykoprotein an der Blut-Hirn-Schranke ist für die Entwicklung von Neuropharmaka von großer Bedeutung.[195] Diese rein wissenschaftlichen Untersuchungen werden mit Substanzen durchgeführt, die mit einem Positronen-Emitter (Beta-Plus-Zerfall (β+)) markiert sind. Dafür wird hauptsächlich das Isotop 11C verwendet. Bei fluorhaltigen Verbindungen wird bevorzugt das kurzlebige Isotop 18F eingesetzt. Wegen der sehr kurzen Halbwertszeit von 20,39 für 11C beziehungsweise 110 Minuten bei 18F können solche Versuche nur an Forschungseinrichtungen durchgeführt werden, in deren Nähe ein Zyklotron steht. Beispiele für entsprechend markierte und untersuchte Verbindungen sind Verapamil,[196] Carazolol,[194] Loperamid[197] und Carvedilol.[195] Verapamil ist dabei von besonderem pharmakologischen Interesse, da es in der Lage ist, P-Glykoprotein zu inhibieren.
Die PET ist eine der wenigen Methoden, die einen direkten In-vivo-Vergleich zwischen den in der präklinischen Phase verwendeten Modellorganismen und dem Menschen bezüglich der Wechselwirkung zwischen Wirkstoff und P-Glykoprotein ermöglicht.[198]
- Magnetresonanztomographie
Die Magnetresonanztomographie (MRT) ist als bildgebendes Verfahren zu unempfindlich, um die Passage von Wirkstoffen in das Gehirn darzustellen. Völlig anders ist die Situation bei einer geschädigten Blut-Hirn-Schranke. In diesen Fällen spielt die kontrastmittelunterstützte MRT als diagnostisches Verfahren bei verschiedenen neurodegenerativen Erkrankungen und Krebserkrankungen im Bereich des Gehirns eine wichtige Rolle. Dies wird im Kapitel der mittelbar mit der Blut-Hirn-Schranke assoziierten Erkrankungen ausführlicher beschrieben.
- Magnetresonanzspektroskopie

Die Magnetresonanzspektroskopie (MRS) ist ein auf der Kernspinresonanz basierendes Verfahren, das in einem Magnetresonanztomographen die Durchführung einer Kernspinresonanzspektroskopie ermöglicht. Dabei können bestimmte Substanzen, beziehungsweise deren Stoffwechselprodukte, im Gehirn spektroskopisch nachgewiesen und quantifiziert werden. Gegenüber der auf dem Protonenspin des Wassers basierenden Magnetresonanztomographie sind hier andere Atomkerne von Interesse. Dies sind insbesondere 19F, 13C, 31P und nichtwässrige Protonen. Im Vergleich zu den in wesentlich größeren Mengen vorhandenen Protonen des Wassers liefern diese meist nur in Spuren vorhandenen Kerne entsprechend schwache Signale. Die räumliche Auflösung entspricht einem Volumenelement von ungefähr 1 cm³. MRS und MRT lassen sich leicht miteinander kombinieren. Die MRT liefert dabei die anatomische Struktur und die MRS die entsprechende räumlich aufgelöste Analytik zur Anatomie. Mit der MRS lässt sich beispielsweise die Pharmakokinetik Fluor-haltiger Wirkstoffe, wie der Neuroleptika Trifluoperazin und Fluphenazin, im Gehirn eines Menschen beobachten und messen.[200] Dabei lässt sich mit der Magnetresonanzspektroskopie quantitativ zwischen dem Wirkstoff und seinen Metaboliten unterscheiden. Ebenso kann zwischen freiem und gebundenem Wirkstoff differenziert werden.[201][202]
Nachteilig bei der MRS sind die durch die geringe Empfindlichkeit der Methode notwendigen langen Messzeiten und die geringe räumliche Auflösung. Letztere ist insbesondere bei Kleintierversuchen problematisch.[189]
Konzepte zur Überwindung der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]siehe Hauptartikel: Konzepte zur Überwindung der Blut-Hirn-Schranke
Wie im Kapitel der Transportprozesse gezeigt wurde, sind nur wenige Substanzen in der Lage, die Blut-Hirn-Schranke zu überwinden, weshalb viele potenzielle Neuropharmaka letztlich an der Blut-Hirn-Schranke scheitern. 98 % dieser Substanzen können die Blut-Hirn-Schranke nicht überwinden.[203]
Es wird daher seit Jahrzehnten intensiv an Methoden geforscht, die einen Wirkstofftransport in das Gehirn unter Umgehung oder – idealerweise selektiver – Öffnung der Blut-Hirn-Schranke ermöglichen sollen.[204][205] Eine Reihe von Strategien zur Überwindung der Blut-Hirn-Schranke wurden dabei entwickelt oder befinden sich noch im Entwicklungsstadium.[206][207]
Störungen der Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]Hauptartikel: Störung der Blut-Hirn-Schranke
Störungen der Blut-Hirn-Schranke können durch eine Reihe von verschiedenen Erkrankungen hervorgerufen werden. Die Blut-Hirn-Schranke kann aber auch selbst der Ausgangspunkt für einige sehr seltene neurologische Erkrankungen sein, die genetisch bedingt sind.
Die Störung der Schutzwirkung der Blut-Hirn-Schranke ist eine Komplikation vieler neurodegenerativer Erkrankungen und Gehirnverletzungen. Auch einige Erkrankungen in der Peripherie, wie beispielsweise Diabetes mellitus oder Entzündungen, wirken sich schädlich auf die Funktion der Blut-Hirn-Schranke aus.[208]
Andere Erkrankungen wiederum stören die Funktion der Endothelien von „innen heraus“, das heißt, die Integrität der Blut-Hirn-Schranke wird durch Einflüsse, die aus der extrazellulären Matrix herauskommen, beeinträchtigt. Ein Beispiel hierfür ist das Glioblastom.[209]
Dagegen manifestiert sich eine Reihe von Erkrankungen im Gehirn dadurch, dass bestimmte Erreger die Blut-Hirn-Schranke überwinden können. Dazu gehören beispielsweise das HI-Virus, das Humane T-lymphotrope Virus 1, das West-Nil-Virus und Bakterien, wie Neisseria meningitidis oder Vibrio cholerae.[209]
Im Fall der Multiplen Sklerose sind die „Erreger“ Zellen der körpereigenen Immunabwehr, die die Blut-Hirn-Schranke überwinden. Ebenso überwinden bei einigen nicht-zerebralen Tumoren metastasierende Zellen die Blut-Hirn-Schranke und können zu Metastasen im Gehirn führen.[209]
Exogene Einwirkungen auf die Blut-Hirn-Schranke
[Bearbeiten | Quelltext bearbeiten]Alkohol
[Bearbeiten | Quelltext bearbeiten]Alkoholmissbrauch ist ein Hauptrisikofaktor für neuroethologische Erkrankungen, Entzündungserkrankungen und für die Anfälligkeit gegenüber bakteriellen Infektionen. Darüber hinaus schädigt der chronische Alkoholkonsum die Blut-Hirn-Schranke,[178][210][211] worin ein wesentlicher Einflussfaktor für die Entstehung einiger neurodegenerativer Erkrankungen gesehen wird.[212] Die Schädigung der Blut-Hirn-Schranke ist sowohl durch neuropathologische Untersuchungen von Alkoholabhängigen als auch durch Tierversuche belegt.[213]
Im Tierversuch wurde festgestellt, dass das durch den Alkoholkonsum aktivierte Enzym Myosin-leichte-Ketten-Kinase (MLCK) in den Endothelien zu einer Phosphorylierung mehrerer Tight-Junction- beziehungsweise Zytoskelett-Proteine führt, wodurch die Integrität der Blut-Hirn-Schranke in Mitleidenschaft gezogen wird.[214] Darüber hinaus führt der durch den Alkohol hervorgerufene oxidative Stress zu einer weiteren Schädigung der Blut-Hirn-Schranke.[215]
Nicht der Alkohol selbst, sondern seine Metaboliten aktivieren das MLCK-Enzym in den Endothelien. Die Funktionsstörung der Blut-Hirn-Schranke erleichtert die Migration von Leukozyten in das Gehirn, wodurch neuroinflammatorische Erkrankungen begünstigt werden.[213]
Nikotin
[Bearbeiten | Quelltext bearbeiten]Chronischer Nikotinmissbrauch erhöht nicht nur das Risiko eines Bronchialkarzinoms, sondern auch das Risiko einer kardiovaskulären Erkrankung. Zwischen kardiovaskulären Risikofaktoren besteht wiederum ein direkter Zusammenhang mit einem erhöhten Risiko einer Demenz. In mehreren Metastudien wurde festgestellt, dass Raucher ein signifikant höheres Risiko für eine Demenz durch Alzheimer-Krankheit haben als Nichtraucher. Das Risiko für eine vaskuläre Demenz und leichte kognitive Beeinträchtigungen ist nicht oder nur geringfügig erhöht.[216] Die chronische Gabe von Nikotin verändert im Tierversuch sowohl die Funktion als auch den Aufbau der Blut-Hirn-Schranke der Versuchstiere.[217] Die Modellsubstanz Sucrose kann die Endothelien signifikant leichter passieren, was im Wesentlichen auf eine veränderte Verteilung des Tight-Junction-Proteins ZO-1[218] und eine reduzierte Aktivität von Claudin-3 zurückzuführen ist.[219] Des Weiteren wurden im Endothel der Blut-Hirn-Schranke nach der chronischen Gabe von Nikotin eine verstärkte Bildung von Mikrovilli, abgeregelte Na+K+2Cl−-Symporter und abgeregelte Natrium-Kalium-Pumpen beobachtet.[217]
In epidemiologischen Studien wurde für Raucher ein signifikant höheres Risiko für die Erkrankung an einer bakteriellen Meningitis im Vergleich zu Nichtrauchern festgestellt. Nikotin verändert die Aktinfilamente des Zytoskeletts der Endothelien, wodurch offensichtlich die Passage von Pathogenen wie beispielsweise E. coli zum Gehirn erleichtert wird.[220]
Für einige diffusionsbegrenzte Verbindungen wie beispielsweise den Nikotinantagonisten Methyllycaconitin (MLA), der an den Nikotinacetylcholinrezeptor (nAChrs) bindet, wird die Blut-Hirn-Passage dagegen bei chronischer Nikotineinnahme verschlechtert.[221]
Ein Impfstoff auf der Basis eines nikotinspezifischen Immunglobulin G ist in der Entwicklung. Mit diesem Impfstoff soll die Bildung von Antikörpern stimuliert werden, die gezielt Nikotin binden und so die Passage durch die BHS vereiteln.[222][223][224][225]
Elektromagnetische Wellen (Mobilfunk)
[Bearbeiten | Quelltext bearbeiten]Die gesundheitlich negativen Wirkungen elektromagnetischer Strahlung im Mega- bis Gigahertz-Bereich bei hoher Energiedichte sind belegt. Demgegenüber werden Wirkungen derselben mit geringerer Energiedichte, wie sie hauptsächlich im Mobil- und Datenfunk benutzt wird, kontrovers diskutiert. Die Auswirkungen auf die Blut-Hirn-Schranke sind dabei auch ein Thema.[226]
Bei hoher Energiedichte elektromagnetischer Strahlung wird in betroffenem Körpergewebe eine signifikante Erwärmung beobachtet. Im Schädel kann diese Erwärmung die Blut-Hirn-Schranke beeinflussen und permeabler machen. Solche Effekte werden auch durch die Einwirkung von Wärmequellen an peripheren Körperstellen nachgewiesen.[227] Bei den im Mobilfunk verwendeten Leistungen lässt sich das Gehirn um maximal 0,1 K erwärmen (15-minütiges Mobilfunkgespräch mit maximaler Sendeleistung). Durch ein warmes Bad oder körperliche Anstrengung kann das Gehirn schadlos stärker erwärmt werden.[228] In wissenschaftlichen Studien seit Beginn der 1990er Jahre,[229] insbesondere aus dem Arbeitskreis des schwedischen Neurochirurgen Leif G. Salford an der Universität Lund, wurden Ergebnisse erzielt, die eine Öffnung der Blut-Hirn-Schranke im nicht-thermischen Bereich, nach der Exposition mit GSM-Frequenzen, beschrieben.[230][231][232][233] Später kamen in-vitro-Versuche an Zellkulturen zu ähnlichen Ergebnissen.[234]
Andere Arbeitsgruppen können die Ergebnisse von Salford nicht bestätigen.[97][235] Auch wird von anderen Arbeitskreisen insbesondere die angewandte Methodik in Frage gestellt.[97]
Humandiagnostik
[Bearbeiten | Quelltext bearbeiten]Kontrastmittelverstärkte Magnetresonanztomographie
[Bearbeiten | Quelltext bearbeiten]


Bereits kurz nach der Entwicklung von Gadopentetat-Dimeglumin (Gd-DTPA), dem ersten Kontrastmittel für die Kernspintomographie, 1984,[236] wurde das Potenzial der kontrastmittelverstärkten Magnetresonanztomographie für die Diagnose von lokalen Störungen der Blut-Hirn-Schranke erkannt.[237] Gd-DTPA ist als hochpolares Molekül viel zu hydrophil, um die gesunde Blut-Hirn-Schranke passieren zu können. Veränderungen an den Tight Junctions, wie sie beispielsweise durch Glioblastome ausgelöst werden, ermöglichen den parazellulären Transport dieses Kontrastmittels in das Interstitium. Dort verstärkt es durch die Wechselwirkung mit den Protonen des umgebenden Wassers den Kontrast und macht so die defekten Bereiche der Blut-Hirn-Schranke sichtbar. Da diese Blutgefäße für die Versorgung des Tumors zuständig sind und sich zu diesem in unmittelbarer Nachbarschaft befinden, lässt sich so das Ausmaß des Tumors darstellen.
Bei einem akuten ischämischen Schlaganfall kann die Störung der Blut-Hirn-Schranke ebenfalls durch kontrastmittelverstärkte MRT zur Diagnosestellung herangezogen werden.[238]
Durch die Bestimmung der Relaxationszeit kann die Menge an Gd-DTPA im Interstitium quantifiziert werden.[239]
Andere bildgebende Verfahren
[Bearbeiten | Quelltext bearbeiten]Mittels radioaktiv markierter Tracer, die die gesunde Blut-Hirn-Schranke normalerweise nicht passieren, können ebenfalls Untersuchungen zur Überprüfung der Funktion der Blut-Hirn-Schranke am Menschen vorgenommen werden. Dabei können prinzipiell sowohl die Single-Photon-Emissionscomputertomographie (SPECT) als auch die Positronen-Emissions-Tomographie (PET) angewendet werden. So kann beispielsweise bei Patienten mit einem akuten Schlaganfall eine erhöhte Aufnahme von 99mTc-Hexamethylpropylaminoxim (HMPAO) im Gehirn nachgewiesen werden.[240][241]
Mit Hilfe der Computertomographie (CT) können Defekte der Blut-Hirn-Schranke durch die Diffusion von geeigneten Kontrastmitteln aus den Kapillaren in das Interstitium quantifiziert werden.[242][243][244]
Entdeckungsgeschichte
[Bearbeiten | Quelltext bearbeiten]


Der erste Beweis für die Existenz der Blut-Hirn-Schranke stammt von dem deutschen Chemiker Paul Ehrlich. Er stellte 1885 bei der Injektion von wasserlöslichen sauren Vitalfarbstoffen in den Blutkreislauf von Ratten fest, dass alle Organe außer Gehirn und Rückenmark von dem Farbstoff angefärbt waren.[245]
Er zog daraus 1904 den falschen Schluss, dass eine geringe Affinität des Gehirngewebes zu dem injizierten Farbstoff die Ursache für diesen Befund sei.[246]
Edwin Goldmann, ein über viele Jahre enger Mitarbeiter seines Mentors Paul Ehrlich[247], injizierte 1909 den fünf Jahre zuvor von Paul Ehrlich erstmals synthetisierten Di-Azofarbstoff Trypanblau intravenös. Dabei bemerkte er, dass der Plexus choroideus im Gegensatz zum umgebenden Gehirngewebe merklich angefärbt war.[248] 1913 injizierte er den gleichen Farbstoff direkt in die Rückenmarksflüssigkeit von Hunden und Hasen. Dabei wurde das gesamte Zentralnervensystem (Gehirn und Rückenmark) angefärbt, aber sonst kein anderes Organ.[249] Goldmann schloss daraus, dass Liquor cerebrospinalis und Plexus choroideus eine wichtige Funktion für den Nährstofftransport in das Zentralnervensystem haben. Des Weiteren vermutete er für neurotoxische Substanzen eine Schrankenfunktion.[11]
1898 führten Artur Biedl und Rudolf Kraus Versuche mit Gallensäuren durch. Bei systemischer Applikation in die Blutbahn waren diese Verbindungen untoxisch. Bei der Injektion in das Gehirn waren sie jedoch neurotoxisch, mit Reaktionen bis zum Koma.[250]
Max Lewandowsky benutzte 1900 bei vergleichbaren Versuchen Kaliumhexacyanidoferrat(II) (gelbes Blutlaugensalz) und kam zu ähnlichen Ergebnissen wie Biedl und Kraus. Lewandowsky verwendete dabei erstmals den Begriff der „Blut-Hirn-Schranke“.[10][251]
1890 postulierten Charles Smart Roy und der spätere Nobelpreisträger Charles Scott Sherrington, dass das Gehirn einen intrinsischen Mechanismus habe, bei dem die vaskuläre Versorgung mit den lokalen Schwankungen der funktionalen Aktivität korrespondiert.
“The brain possesses an intrinsic mechanism by which its vascular supply can be varied locally in correspondence with local variations of functional activity.”
Lina Stern, erstes weibliches Mitglied der Russischen Akademie der Wissenschaften, leistete wesentliche Beiträge zur Erforschung der Blut-Hirn-Schranke, welche sie 1921 als haemato-encephalische Schranke bezeichnete.[253]
Die Differenzierung in Blut-Hirn- und Blut-Liquor-Schranke nahmen in den 1930er Jahren Friedrich Karl Walter[254] und Hugo Spatz[255] vor. Sie postulierten, dass der Fluss des Liquors für den Gasaustausch im Zentralnervensystem allein völlig unzureichend sei.[11]
Obwohl die Versuche von Goldmann und Ehrlich die Existenz einer Barriere zwischen Blutkreislauf und Zentralnervensystem nahelegten, gab es bis in die 1960er Zweifel an deren Existenz. Ein Kritikpunkt an Goldmanns Versuch war dabei, dass sich Blut und Liquor, die beiden Flüssigkeiten, in die die Farbstoffe injiziert wurden, erheblich unterscheiden und so das Diffusionsverhalten und die Affinität zum Nervengewebe beeinflusst werden. Erschwert wurde das Verständnis noch durch den experimentellen Befund, dass basische Azofarbstoffe das Nervengewebe anfärbten, also die Blut-Hirn-Schranke überwanden, während die sauren Farbstoffe dies nicht taten. Ulrich Friedemann schloss daraus, dass die elektrochemischen Eigenschaften der Farbstoffe dafür verantwortlich seien. Die zerebralen Kapillaren seien für ungeladene oder beim pH-Wert von Blut positive geladene Substanzen durchlässig und für saure undurchlässig.[256] Diese These erwies sich in der Folgezeit, als eine Vielzahl von Substanzen auf ihre Permeabilität an der Blut-Hirn-Schranke untersucht wurden, jedoch als unzureichend. In den nachfolgenden Erklärungsmodellen wurde eine Vielzahl von Parametern, wie molare Masse, Molekülgröße, Bindungsaffinitäten, Dissoziationskonstanten, Fettlöslichkeit, elektrische Ladung und die verschiedensten Kombinationen daraus, diskutiert.[10][257]
Das heutige Verständnis des Grundaufbaus der Blut-Hirn-Schranke basiert auf elektronenmikroskopischen Aufnahmen von Mäusegehirnen, die am Ende der 1960er Jahre durchgeführt wurden.[114][258] Thomas S. Reese und Morris J. Karnovsky injizierten in ihren Versuchen Meerrettichperoxidase intravenös in die Versuchstiere. Das Enzym fanden sie bei der elektronenmikroskopischen Betrachtung nur im Lumen der Blutgefäße und in mikropinozytischen Vesikeln innerhalb der Endothelzellen. Außerhalb des Endothels, in der extrazellulären Matrix, fanden sie keine Peroxidase. Sie vermuteten, dass Tight Junctions zwischen den Endothelzellen den Übergang zum Gehirn verhindern.[1][259]
Literatur
[Bearbeiten | Quelltext bearbeiten]- D. Kobiler et al.: Blood-brain Barrier. Verlag Springer, 2001, ISBN 0-306-46708-9.
- A. G. De Boer, W. Sutanto: Drug Transport Across the Blood-brain Barrier. CRC Press, 1997, ISBN 90-5702-032-7.
- W. M. Pardridge: Introduction to the Blood-brain Barrier. Cambridge University Press, 1998, ISBN 0-521-58124-9.
- E. M. Taylor: Efflux Transporters and the Blood-brain Barrier. Nova Publishers, 2005, ISBN 1-59454-625-8.
- D. J. Begley et al.: The Blood-brain Barrier and Drug Delivery to the CNS. Informa Health Care, 2000, ISBN 0-8247-0394-4.
- E. de Vries, A. Prat: The Blood-brain Barrier and Its Microenvironment. Taylor & Francis, 2005, ISBN 0-8493-9892-4.
- M. Bradbury: The Concept of a Blood-Brain Barrier. Wiley-Interscience, 1979, ISBN 0-471-99688-2.
- P. Ramge: Untersuchungen zur Überwindung der Blut-Hirn-Schranke mit Hilfe von Nanopartikeln. Shaker Verlag, 1999, ISBN 3-8265-4974-0.
- P. Brenner: Die Struktur der Blut-Hirn- und der Blut-Liquor-Schranke. Dissertation, LMU München, 2006
- Yasunobu Arima et al.: Regional Neural Activation Defines a Gateway for Autoreactive T Cells to Cross the Blood-Brain Barrier. In: Cell. 148, 2012, S. 447–457, doi:10.1016/j.cell.2012.01.022.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Norman R. Saunders et al.: The rights and wrongs of blood-brain barrier permeability studies: a walk through 100 years of history. In: Frontiers in Neuroscience. Band 8, 16. Dezember 2014, doi:10.3389/fnins.2014.00404, PMID 25565938.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j S. Wolf et al.: Die Blut-Hirn-Schranke: Eine Besonderheit des cerebralen Mikrozirkulationssystems. In: Naturwissenschaften 83, 1996, S. 302–311. doi:10.1007/BF01152211.
- ↑ W. Risau et al.: Immune function of the blood-brain barrier: in complete presentation of protein (auto-)antigens by rat brain microvascular endothelium in vitro. In: Journal of Cell Biology 110, 1990, S. 1757–1766. PMID 1692329.
- ↑ a b c B. Bauer: In vitro Zellkulturmodelle der Blut-Hirn-Schranke zur Untersuchung der Permeation und P-Glykoprotein-Interaktion von Arzneistoffen. Dissertation, Ruprecht-Karls-Universität Heidelberg, 2002.
- ↑ a b c d e f g h i j S. Ohtsuki: New aspects of the blood-brain barrier transporters; its physiological roles in the central nervous system. In: Biol Pharm Bull. 27, 2004, S. 1489–1496. PMID 15467183 (Review).
- ↑ a b c d e M. Bundgaard. N. J. Abbott: All vertebrates started out with a glial blood-brain barrier 4-500 million years ago. In: Glia. 56, 2008, S. 699–708. PMID 18338790.
- ↑ a b c d e W. M. Pardridge: Molecular biology of the blood–brain barrier. In: Mol Biotechnol, 30, 2005, S. 57–69. PMID 15805577 (Review).
- ↑ J. C. Lee: Evolution in the concept of the blood-brain barrier phenomen. In: Progress in neuropathology. Band 1. Verlag Grune und Stratton, 1971, ISBN 0-88167-188-6, S. 84–145.
- ↑ a b c M. Pavelka, J. Roth: Funktionelle Ultrastruktur. Verlag Springer, ISBN 3-211-83563-6, S. 234–235.
- ↑ J. Cervos-Navarro: Elektronenmikroskopische Befunde an den Kapillaren der Hirnrinde. In: Arch Psychiatr Nervenkr 204, 1963, S. 484–504. PMID 14082797.
- ↑ a b c d B. T. Hawkins und T. P. Davis: The blood-brain barrier/neurovascular unit in health and disease. In: Pharmacol Rev 57, 2005, S. 173–185. PMID 15914466 (Review).
- ↑ a b c d e f g h i j k S. Nobmann: Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke. Dissertation, Ruprecht-Karls-Universität Heidelberg, 2001.
- ↑ R. S. el-Bacha, A. Minn: Drug metabolizing enzymes in cerebrovascular endothelial cells afford a metabolic protection to the brain. In: Cell Mol Biol 45, 1999, S. 15–23. PMID 10099836 (Review).
- ↑ M. Chat et al.: Drug metabolizing enzyme activities and superoxide formation in primary and immortalized rat brain endothelial cells. In: Life Sci 62, 1998, S. 151–163. PMID 9488113.
- ↑ A. Minn et al.: Drug metabolizing enzymes in the brain and cerebral microvessels. In: Brain Res Brain Res Rev 116, 1991, S. 65–82. PMID 1907518 (Review).
- ↑ a b c d Y. Takahura et al.: Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells. In: Adv Pharmacol 22, 1991, S. 137–165. PMID 1958501 (Review).
- ↑ S. Meresse et al.: Bovine brain endothelial cells expres tight junctions and monoamine oxidase activity in long-term culture. In: J Neurochem 53, 1989, S. 1363–1371. PMID 2571674.
- ↑ R. Perrin et al.: Distribution of cytochrom P450 activities towards alkoxyresorufin derivates in rat brain regions, subcellular fractions and isolated cerebral microvessels. In: Biochem Pharmacol 40, 1990, S. 2145–2151. PMID 2242042.
- ↑ R. Bendayan et al.: Functional expression and localization of P-glycoprotein at the blood brain barrier. In: Microsc Res Tech 57, 2002, S. 365–380. PMID 12112443 (Review).
- ↑ Y. Su, P. J. Sinko: Drug delivery across the blood-brain barrier: why is it difficult? how to measure and improve it? In: Expert Opin Drug Deliv 3, 2006, S. 419–435. PMID 16640501 (Review).
- ↑ a b H. Fischer et al.: Blood–brain barrier permeation: molecular parameters governing passive diffusion. In: J Membr Biol 165, 1998, S. 201–211. PMID 9767674.
- ↑ a b U. Fagerholm: The highly permeable blood–brain barrier: an evaluation of current opinions about brain uptake capacity. In: Drug Discovery Today 12, 2007, S. 1076–1082. PMID 18061888 (Review).
- ↑ B. Nico et al.: Role of aquaporin-4 water channel in the development and integrity of the blood-brain barrier. In: J Cell Sci 114, 2001, S. 1297–1307. PMID 11256996.
- ↑ a b A. M. Butt et al.: Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. In: J Physiol 429, 1990, S. 47–62. PMID 2277354.
- ↑ P. Claude, D. A. Goodenough: Fracture faces of zonae occludentes from tight and leaky epithelia. In: J Cell Biol, 58, 1973, S. 390–400. PMID 4199658.
- ↑ H. Wolburg et al.: Modulation of tight junction structure in blood-brain barrier endothelial cells. Effects of tissue culture, second messengers and cocultured astrocytes. In: J Cell Sci 107, 1994, S. 1347–1357. PMID 7929640.
- ↑ a b H. B. Newton: Advances in strategies to improve drug delivery to brain tumors. In: Expert Rev Neurother 6, 2006, S. 1495–1509. PMID 17078789 (Review).
- ↑ J. L. Madara: Tight junction dynamics: is paracellular transport regulated? In: Cell 53, 1988, S. 497–498. PMID 3286009.
- ↑ H. C. Bauer et al.: Proteins of the tight junctions in the blood-brain barrier. In: Blood-spinal Cord and Brain Barriers in Health and Disease. Verlag Elsevier, 2004, S. 1–10.
- ↑ R. Cecchell et al.: Modelling of the blood–brain barrier in drug discovery and development. In: Nat Rev Drug Discov, 6, 2007, S. 650–661. PMID 17667956 (Review).
- ↑ K. Matter, M. S. Balda: Holey barrier: claudins and the regulation of brain endothelial permeability. In: J Cell Biol, 161, 2003, S. 459–460. PMID 12743096 (Review).
- ↑ T. Nitta et al.: Size-selective loosening of the blood–brain barrier in claudin-5-deficient mice. In: J Cell Biol, 161, 2003, S. 653–660. PMID 12743111.
- ↑ a b P. Dore-Duffy: Pericytes: pluripotent cells of the blood brain barrier. In: Curr Pharm Des 14, 2008, S. 1581–1593. PMID 18673199 (Review).
- ↑ R. Balabanov, P. Dore-Duffy: Role of the CNS microvascular pericyte in the blood-brain barrier. In: J Neurosci Res 53, 1998, S. 637–644. PMID 9753191 (Review).
- ↑ a b c d H.K. Rucker et al.: Cellular mechanisms of CNS pericytes. In: Brain Res Bull 51, 2000, S. 363–369. PMID 10715555 (Review).
- ↑ P. A. D’Amore: Culture and Study of Pericytes. In: Cell Culture Techniques in Heart and Vessel Research. Verlag Springer, 1990, ISBN 3-540-51934-3, S. 299.
- ↑ N. J. Abbott: Neurobiology: Glia and the blood-brain barrier. In: Nature, 325, 1987, S. 195. PMID 3808015.
- ↑ C. H. Lai, K. H. Kuo: The critical component to establish in vitro BBB model: Pericyte. In: Brain Res Brain Res Rev, 50, 2005, S. 258–265. PMID 16199092 (Review).
- ↑ a b D. Shepro, N.M. Morel: Pericyte physiology. In: FASEB J, 7, 1993, S. 1031–1038. PMID 8370472 (Review).
- ↑ K. Fujimoto: Pericyte-endothelial gap junctions in developing rat cerebral capillaries: A fine structural study. In: Anat Rec 242, 1995, S. 562–565. PMID 7486026.
- ↑ L. Diaz-Flores: Microvascular pericytes: A review of their morphological and functional characteristics. In: Histol Histopath 6, 1991, S. 269–286. PMID 1802127 (Review).
- ↑ D. E. Sims: Recent advances in pericyte biology—Implications for health and disease. In: Can J Cardiol 7, 1991, S. 431–443. PMID 1768982 (Review).
- ↑ a b c D. E. Sims: Diversity within pericytes. In: Clin Exp Pharmacol Physiol 27, 2000, S. 842–846. PMID 11022980 (Review).
- ↑ I. M. Herman, P. A. D’Amore: Microvascular pericytes contain muscle and nonmuscle actins. In: J Cell Biol, 101, 1985, S. 43–52. PMID 3891763.
- ↑ K. K. Hirschi, P. A. D’Amore: Pericytes in the microvasculature. In: Cardiovasc Res, 32, 1996, S. 687–698. PMID 8915187 (Review).
- ↑ M. Mato et al.: Evidence for the possible function of the fluorescent granular perithelial cells in brain as scavengers of high-molecular-weight waste products. In: Experientia 40, 1984, S. 399–402. PMID 6325229.
- ↑ R. Balabanov et al.: CNS microvascular pericytes express macrophage-like function, cell surface integrin alphaM, and macrophage marker ED-2. In: Microvasc Res 52, 1996, S. 127–142. PMID 8901442.
- ↑ W. F. Hickey und H. Kimura: Perivascular microglial cells of the CNS are bone marrow-derived and present antigen in vivo. In: Science 239, 1988, S. 290–292. PMID 3276004.
- ↑ Z. Fabry et al.: Differential activation of Th1 and Th2 CD4+ cells by murine brain microvessel endothelial cells and smooth muscle/pericytes. In: J Immunol 151, 1993, S. 38–47. PMID 8100844.
- ↑ D. Krause et al.: Cerebral pericytes – a second line of defense in controlling blood-brain barrier peptide metabolism. In: Adv Exp Med Biol 331, 1993, S. 149–152. PMID 8101424.
- ↑ W. E. Thomas: Brain macrophages: on the role of pericytes and perivascular cells. In: Brain Res Brain Res Rev 31, 1999, S. 42–57. PMID 10611494 (Review).
- ↑ C. Iadecola: Neurovascular regulation in the normal brain and in Alzheimer’s disease. In: Nat Rev Neurosci 5, 2004, S. 347–360. PMID 15100718 (Review).
- ↑ B. Engelhardt: Development of the blood-brain barrier. In: Cell Tissue Res 314, 2003, S. 119–129. PMID 12955493 (Review).
- ↑ C. E. Johanson: Permeability and vascularity of the developing brain: cerebellum vs. cerebral cortex. In: Brain Res 190, 1980, S. 3–16. PMID 6769537.
- ↑ J. Neuhaus et al.: Induction of blood-brain barrier characteristics in bovine brain endothelial cells by rat astroglial cells in transfilter coculture. In: Ann N Y Acad Sci 633, 1991, S. 578–580. PMID 1789585.
- ↑ P. A. Stewart, M. J. Wiley: Developing nervous tissue induces formation of blood-brain barrier characteristics in invading endothelial cells: a study using quail–chick transplantation chimeras. In: Dev Biol, 84, 1981, S. 183–192. PMID 7250491.
- ↑ T. J. Raub et al.: Permeability of bovine brain microvessel endothelial cells in vitro: barrier tightening by a factor released from astroglioma cells. In: Exp Cell Res, 199, 1992, S. 330–340. PMID 1347502.
- ↑ a b c d N. J. Abbott: Astrocyte-endothelial interactions and blood-brain barrier permeability. In: J Anat 200, 2002, S. 629–638. PMID 12162730 (Review).
- ↑ a b O. B. Paulson, E. A. Newman: Does the release of potassium from astrocyte endfeet regulate cerebral blood flow? In: Science, 237, 1987, S. 896–898. PMID 3616619.
- ↑ N. J. Abbott et al.: Astrocyte-endothelial interactions at the blood-brain barrier. In: Nat Rev Neurosci, 7, 2006, S. 41–53. PMID 16371949 (Review).
- ↑ I. Björkhem, S. Meaney: Brain Cholesterol: Long Secret Life Behind a Barrier. In: Arterioscler Thromb Vasc Biol, 24, 2004, S. 806–815. PMID 14764421 (Review).
- ↑ H. M. Duvernoy, P. Y. Risold: The circumventricular organs: an atlas of comparative anatomy and vascularization. In: Brain Res Rev 56, 2007, S. 119–147. PMID 17659349 (Review).
- ↑ C. Lohmann: Die Blut-Hirn-Schranke in vitro: Regulation der Permeabilität durch Matrixmetalloproteasen. Dissertation, Westfälische Wilhelms-Universität Münster, 2003.
- ↑ W. M. Pardridge: Peptide Drug Delivery to the Brain. Raven Press, 1991, ISBN 0-88167-793-0, S. 123.
- ↑ W. L. Chiou, A. Barve: Linear correlation of the fraction of oral dose absorbed of 64 drugs between humans and rats. In: Pharm Res, 15, 1998, S. 1792–1795. PMID 9834005.
- ↑ J. T. Goodwin und D. E. Clark: In silico predictions of blood-brain barrier penetration: considerations to "keep in mind". In: J Pharmacol Exp Ther 315, 2005, S. 477–483. PMID 15919767 (Review).
- ↑ S. L. Lindstedt und P. J. Schaeffer: Use of allometry in predicting anatomical and physiological parameters of mammals. In: Lab Anim 36, 2002, S. 1–19. PMID 11833526.
- ↑ R. W. Leggett, L. R. Williams: A proposed blood circulation model for reference man. In: Health Phys, 69, 1995, S. 187–201. PMID 7622365.
- ↑ S. Willmann et al.: A physiological model for the estimation of the fraction dose absorbed in humans. In: J Med Chem 47, 2004, S. 4022–4031. PMID 15267240.
- ↑ U. Fagerholm et al.: Comparison between permeability coefficients in rat and human jejunum. In: Pharm Res, 13, 1996, S. 1336–1342. PMID 8893271.
- ↑ R. W. Leggett, L. R. Williams: Suggested reference values for regional blood volumes in humans. In: Health Phys, 60, 1991, S. 139–154. PMID 1989937.
- ↑ G. B. Wislocki: Experimental studies on fetal absorption. I. The vitally stained fetus. In: Contrib Embryol Carnegie Inst, 5, 1920, S. 45–52.
- ↑ S. Wakai, N. Hirokawa: Development of the blood–brain barrier to horseradish peroxidase in the chick embryo. In: Cell Tissue Res, 195, 1979, S. 195–203. PMID 737715.
- ↑ W. Risau et al.: Differentiation-dependent expression of proteins in brain endothelium during development of the blood–brain barrier. In: Dev Biol 117, 1986, S. 537–545. PMID 2875908.
- ↑ M. L. Reynolds et al.: Intracranial haemorrhage in the preterm sheep fetus. In: Early Hum Dev 3, 1979, S. 163–186. PMID 575326.
- ↑ L. Stern und R. Peyrot: Le fonctionnement de la barrière hémato-éncephalique aux divers stades de développement chez les diverses espèces animales. In: Compte Rendu des Societe de Biologie (Paris) 96, 1927, S. 1124–1126.
- ↑ L. Stern et al.: Le fonctionnement de la barrière hémato-éncephalique chez les nouveau-nés. In: Compte Rendu Soc Biol 100, 1929, S. 231–233.
- ↑ a b N. R. Saunders et al.: Barrier mechanisms in the brain, II. Immature brain. In: Clin Exp Pharmacol Physiol 26, 1999, S. 85–91. PMID 10065326 (Review).
- ↑ N. R. Saunders: Development of the blood–brain barrier to macromolecules. In: The Fluids and Barriers of the Eye and Brain Editor: M. B. Segal, Verlag MacMillan, 1991, ISBN 0-8493-7707-2, S. 128–155.
- ↑ U. Schumacher, K. Møllgård: The multidrug resistance P-glycoprotein (Pgp, MDR1) is an early marker of blood–brain barrier development in the microvessels of the developing human brain. In: Histochem Cell Biol, 108, 1997, S. 179–182. PMID 9272437.
- ↑ K. M. Dziegielewska et al.: Studies of the development of brain barrier systems to lipid insoluble molecules in fetal sheep. In: J Physiol, 292, 1979, S. 207–231. PMID 490348.
- ↑ R. K. Ferguson, D. M. Woodbury: Penetration of 14C-inulin and 14C-sucrose into brain, cerebrospinal fluid and skeletal muscle of developing rats. In: Exp Brain Res, 7, 1969, S. 181–194. PMID 5795246.
- ↑ M. D. Habgood et al.: The nature of the decrease in blood–cerebrospinal fluid barrier exchange during postnatal brain development in the rat. In: J Physiol 468, 1993, S. 73–83. PMID 8254533.
- ↑ C. E. Johanson: Ontogeny of the blood–brain barrier. In: Implications of the Blood–Brain Barrier and Its Manipulation Editor: E. A. Neuwelt, Plenum Press, 1989, S. 157–198.
- ↑ L. D. Braun et al.: Newborn rabbit blood–brain barrier is selectively permeable and differs substantially from the adult. In: J Neurochem 34, 1980, S. 147–152. PMID 7452231.
- ↑ E. M. Cornford et al.: Developmental modulations of blood–brain barrier permeability as an indicator of changing nutritional requirements in the brain. In: Pediatr Res 16, 1982, S. 324–328. PMID 7079003.
- ↑ D. P. Brenton, R. M. Gardiner: Transport of L-phenylalanine and related amino acids at the ovine blood–brain barrier. In: J Physiol, 402, 1988, S. 497–514. PMID 3236248.
- ↑ H. J. L. Frank et al.: Enhanced insulin binding to blood–brain barrier in vivo and to brain microvessels in vitro in newborn rabbits. In: Diabetes, 34, 1985, S. 728–733. PMID 3894116.
- ↑ N. R. Saunders: Barriers in the immature brain. In: Cell Mol Neurobiol, 20, 2000, S. 29–40. PMID 10690500 (Review).
- ↑ N. J. Abbott, M. Bundgaard: Electron-dense tracer evidence for a blood-brain barrier in the cuttlefish, Sepia officinalis. In: J Neurocytol, 21, 1992, S. 276–294. PMID 1588347.
- ↑ N. J. Abbott, Y. Pichon: The glial blood-brain barrier of crustacea and cephalopods: a review. In: J Physiol (Paris), 82, 1987, S. 304–313. PMID 3332691 (Review).
- ↑ a b N. J. Abbott: Dynamics of CNS barriers: evolution, differentiation, and modulation. In: Cell Mol Neurobiol 25, 2005, S. 5–23. PMID 15962506 (Review).
- ↑ N. J. Abbott: Comparative physiology of the blood-brain barrier. In: Physiology and pharmacology of the bloodbrain barrier Editor: M. W. B. Bradbury, Springer-Verlag, 1992, ISBN 0-387-54492-5, S. 371–396.
- ↑ T. Stork et al.: Organization and function of the blood-brain barrier in Drosophila. In: J Neurosci 28, 2008, S. 587–597. PMID 18199760.
- ↑ J. Fraher und E. Cheong: Glial-Schwann cell specialisations at the central-peripheral nervous system transition of a cyclostome: An ultrastructural study. In: Acta Anat 154, 1995, S. 300–314. PMID 8773716.
- ↑ N. J. Abbott et al.: Comparative physiology of the blood-brain barrier. In: The blood-brain barrier in health and disease. Editoren: A. J. Suckling et al., Verlag Ellis Horwood, 1986, S. 52–72.
- ↑ F. Miragall et al.: Expression of the tight junction protein ZO-1 in the olfactory system: Presence of ZO-1 on olfactory sensory neurons and glial cells. In: J Comp Neurol 341, 1994, S. 433–448. PMID 8201022.
- ↑ a b c N. Hettenbach: Einfluss chronischer elektromagnetischer Befeldung mit Mobilfunkstrahlen (GSM und UMTS) auf die Integrität der Blut-Hirn-Schranke von Ratten. Dissertation, Ludwig-Maximilians-Universität München, 2008.
- ↑ S. I. Rapoport: Blood-brain Barrier in Physiology and Medicine. Raven Press, 1976, ISBN 0-89004-079-6.
- ↑ a b c M. Fromm: Physiologie des Menschen – Transport in Membranen und Epithelien. (Herausgeber: R. F. Schmidt, F. Lang), Verlag Springer, ISBN 978-3-540-32908-4, S. 41–54.
- ↑ I. Sauer: Apolipoprotein E abgeleitete Peptide als Vektoren zur Überwindung der Blut-Hirn-Schranke. Dissertation FU Berlin, 2004. urn:nbn:de:kobv:188-2004003141
- ↑ a b R. D. Egleton, T. P. Davis: Development of neuropeptide drugs that cross the blood-brain barrier. In: NeuroRx 2, 2005, S. 44–53. PMID 15717056 (Review).
- ↑ W. H. Oldendorf: Lipid solubility and drug penetration of the blood-brain barrier. In: Proc Soc Exp Biol Med 147, 1974, S. 813–816. PMID 4445171.
- ↑ a b c R. Kaliszan und M. Markuszewski: Brain/blood distribution described by a combination of partition coefficient and molecular mass. In: International Journal of Pharmaceutics 145, 1996, S. 9–16. doi:10.1016/S0378-5173(96)04712-6.
- ↑ H. Träuble: Carriers and specificity in membranes. 3. Carrier-facilitated transport. Kinks as carriers in membranes. In: Neurosci Res Program Bull 9, 1971, S. 361–372. PMID 5164654.
- ↑ H. Träuble: Phasenumwandlungen in Lipiden. Mögliche Schaltprozesse in biologischen Membranen. In: Naturwissenschaften 58, 1971, S. 277–284. PMID 4935458 (Review).
- ↑ O. Vostowsky: Chemie der Naturstoffe - Lipoproteine und Membranen. Universität Erlangen, 2005, S. 42.
- ↑ W. Hoppe, R. D. Bauer: Biophysik. Verlag Birkhäuser, 1982, ISBN 0-387-11335-5, S. 447–448.
- ↑ A. Seelig und J. Seelig: The dynamic structure of fatty acyl chains in a phospholipid bilayer measured by deuterium magnetic resonance. In: Biochemistry 13, 1974, S. 4839–4845. PMID 4371820.
- ↑ A. Elbert: Die Permeation kleiner polarer Moleküle durch Phospholipidmodellmembranen. Dissertation, Universität Kaiserslautern, 1999. urn:nbn:de:bsz:386-kluedo-12797
- ↑ V. A. Levin: Relationship of octanol/water partition coefficient and molecular weight to rat brain capillary permeability. In: J Med Chem 23, 1980, S. 682–684. PMID 7392035.
- ↑ A. Seelig et al.: A method to determine the ability of drugs to diffuse throught the blood-brain barrier. In: PNAS 91, 1994, S. 68–72. PMID 8278409.
- ↑ a b G. A. Dhopeshwarkar und J. F. Mead: Uptake and transport of fatty acids into the brain and the role of the blood-brain barrier system. In: Adv Lipid Res 11, 1973, S. 109–142. PMID 4608446 (Review).
- ↑ G. Gerebtzoff, A. Seelig: In silico prediction of blood-brain barrier permeation using the calculated molecular cross-sectional area as main parameter. In: A J Chem Inf Model, 46, 2006, S. 2638–2650. PMID 17125204.
- ↑ a b W. W. Pardridge: The blood-brain barrier: bottleneck in brain drug development. In: NeuroRx 2, 2005, S. 3–14. PMID 15717053 (Review).
- ↑ a b W. H. Oldendorf: Measurement of brain uptake of radiolabeled substances using a tritiated water internal standard. In: Brain Res, 24, 1970, S. 372–376. PMID 5490302.
- ↑ D. Dolman et al.: Induction of aquaporin 1 but not aquaporin 4 messenger RNA in rat primary brain microvessel endothelial cells in culture. In: J Neurochem 93, 2005, S. 825–833. PMID 15857386.
- ↑ O. Bloch und G. T. Manley: The role of aquaporin-4 in cerebral water transport and edema. In: Neurosurg Focus 22, 2007, S. E3 PMID 17613234 (Review).
- ↑ A. S. Verkman: More than just water channels: unexpected cellular roles of aquaporins. In: J Cell Sci 118, 2005, S. 3225–3232. PMID 16079275 (Review).
- ↑ a b J. Badaut et al.: Aquaporins in the brain: from aqueduct to "multi-duct". In: Metab Brain Dis 22, 2007, S. 251–263. PMID 17701333 (Review).
- ↑ Farrell et al.: Blood-brain barrier glucose transporter is asymmetrically distributed on brain capillary endothelial lumenal and ablumenal membranes: An electron microscopic immunogold study. In: Proc. Natl. Acad. Sci. USA, Vol. 88, 1991, S. 5779–5783.
- ↑ A. Dahlin, J. Royall, J. G. Hohmann, J. Wang: Expression Profiling of the Solute Carrier (SLC) Gene Family in the Mouse Brain. In: J. Pharmacol. Exp. Ther. 329, 2009, S. .558–570 PMID 19179540 PMC 267287 (freier Volltext).
- ↑ D. Agus et al.: Vitamin C crosses the blood-brain barrier in the oxidized form through the glucose transporters. In: J Clin Invest 100, 1997, S. 2842–2848. PMID 9389750.
- ↑ E. M. Cornford und S. Hyman: Blood-brain barrier permeability to small and large molecules. In: Advanced Drug Delivery Reviews 36, 1999, S. 145–163. PMID 10837713 (Review).
- ↑ B. V. Zlokovic et al.: Transport of leucine-enkephalin across the blood-brain barrier in the perfused guinea pig brain. In: J Neurochem 49, 1987, S. 310–315. PMID 3585338.
- ↑ B. V. Zlokovic et al.: Kinetic analysis of leucine-enkephalin cellular uptake at the luminal side of the blood-brain barrier of an in situ perfused guinea-pig brain. In: J Neurochem 53, 1989, S. 1333–1340. PMID 2795003.
- ↑ B. V. Zlokovic et al.: Kinetics of arginine-vasopressin uptake at the bloodbrain barrier. In: Biochim Biophys Acta 1025, 1990, S. 191–198. PMID 2364078.
- ↑ S. A. Thomas et al.: The entry of [D-penicillamine2,5]enkephalin into the central nervous system: saturation kinetics and specificity. In: J Pharmacol Exp Ther 280, 1997, S. 1235–1240. PMID 9067309.
- ↑ V. V. Rao et al.: Choroid plexus epithelial expression of MDR1 P glycoprotein and multidrug resistance-associated protein contribute to the blood-cerebrospinal-fluid drug-permeability barrier. In: PNAS 96, 1999, S. 3900–3905. PMID 10097135.
- ↑ F. Thiebaut et al.: Immunohistochemical localization in normal tissues of different epitopes in the multidrug transport protein P170: evidence for localization in brain capillaries. In: J Histochem Cytochem 37, 1989, S. 159–164, PMID 2463300.
- ↑ D. J. Begley: ABC transporters and the blood-brain barrier. In: Curr Pharm Des 10, 2004, S. 1295–1312. PMID 15134482 (Review).
- ↑ S. Seetharaman et al.: Multidrug resistance-related transport proteins in isolated human brain microvessels and in cells cultured from these isolates. In: J Neurochem 70, 1998, S. 1151–1159. PMID 9489736.
- ↑ a b H. C. Cooray et al.: Localisation of breast cancer resistance protein in microvessel endothelium of human brain. In: Neuroreport 13, 2002, S. 2059–2063. PMID 12438926.
- ↑ T. Eisenblätter und H. J. Galla: A new multidrug resistance protein at the blood-brain barrier. In: Biochem Biophys Res Commun 293, 2002, S. 1273–1278. PMID 12054514.
- ↑ Y. Tanaka et al.: Ultrastructural localization of P-glycoprotein on capillary endothelial cells in human gliomas. In: Virchows Arch 425, 1994, S. 133–138. PMID 7952498.
- ↑ E. C. de Lange: Potential role of ABC transporters as a detoxification system at the blood-CSF barrier. In: Adv Drug Deliv Rev 56, 2004, S. 1793–1809. PMID 15381334 (Review).
- ↑ H. Wolosker et al.: Neurobiology through the looking-glass: D-serine as a new glial-derived transmitter. In: Neurochem Int, 41, 2002, S. 327–332. PMID 12176074 (Review).
- ↑ C. F. Zorumski und J. W. Olney: Excitotoxic neuronal damage and neuropsychiatric disorders In: Pharmacol Ther 59, 1993, S. 145–162. PMID 7904075 (Review).
- ↑ K. Hosoya et al.: Blood-brain barrier produces significant efflux of L-aspartic acid but not D-aspartic acid: in vivo evidence using the brain efflux index method. In: J Neurochem, 73, 1999, S. 1206–1211. PMID 10461913.
- ↑ M. Palacin et al.: Molecular biology of mammalian plasma membrane amino acid transporters. In: Physiol Rev, 78, 1998, S. 969–1054. PMID 9790568 (Review).
- ↑ W. Löscher und H. Potschka: Blood-brain barrier active efflux transporters: ATP-binding cassette gene family. In: NeuroRx, 2, 2005, S. 86–98. PMID 15717060 (Review).
- ↑ D. M. Tishler et al.: MDR1 gene expression in brain of patients with medically intractable epilepsy. In: Epilepsia, 36, 1995, S. 1–6. PMID 8001500.
- ↑ H. Kusuhara et al.: Molecular cloning and characterization of a new multispecific organic anion transporter from rat brain. ( des vom 29. April 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: J Biol Chem, 274, 1999, S. 13675–13680. PMID 10224140.
- ↑ B. Gao et al.: Localization of the organic anion transporting polypeptide 2 (Oatp2) in capillary endothelium and choroid plexus epithelium of rat brain. ( vom 5. September 2008 im Internet Archive) In: J Histochem Cytochem, 47, 1999, S. 1255–1264. PMID 10490454.
- ↑ L. Z. Bito: Blood-Brain Barrier: Evidence for Active Cation Transport between Blood and the Extraceliular Fluid of Brain. In: Science 165, 1969, S. 81–83. PMID 17840696.
- ↑ Y. Kido et al.: Functional relevance of carnitine transporter OCTN2 to brain distribution of L-carnitine and acetyl-L-carnitine across the blood-brain barrier. In: J Neurochem 79, 2001, S. 959–969. PMID 11739607.
- ↑ R. L. Roberts et al.: Receptor-mediated endocytosis of transferrin at the blood-brain barrier. In: J Cell Sci 104, 1993, S. 521–532. PMID 8505377.
- ↑ B. Dehouck et al.: Upregulation of the low density lipoprotein receptor at the blood-brain barrier: intercommunications between brain capillary endothelial cells and astrocytes. In: J Cell Biol 126, 1994, S. 465–473. PMID 8034745.
- ↑ K. R. Duffy et al.: Human blood-brain barrier insulin-like growth factor receptor. In: Metabolism 37, 1988, S. 136–140. PMID 2963191.
- ↑ M. W. Smith und M. Gumbleton: Endocytosis at the blood-brain barrier: from basic understanding to drug delivery strategies. In: J Drug Target 14, 2006, S. 191–214. PMID 16777679 (Review).
- ↑ F. Hervé et al.: CNS delivery via adsorptive transcytosis. In: AAPS J 10, 2008, S. 455–472. PMID 18726697 (Review).
- ↑ J. M. Scherrmann: Drug delivery to brain via the blood-brain barrier. In: Vascul Pharmacol 38, 2002, S. 349–354. PMID 12529929 (Review).
- ↑ I. Tamai et al.: Structure-internalization relationship for adsorptive-mediated endocytosis of basic peptides at the blood– brain barrier. In: J Pharmacol Exp Ther 280, 1997, S. 410–415. PMID 8996222.
- ↑ a b c d e f g h i j k l m n W. M. Pardridge: Blood-brain barrier delivery. In: Drug Discov Today 12, 2007, S. 54–61. PMID 17198973.
- ↑ a b c d e f H. Bronger et al.: ABCC drug efflux pumps and organic anion uptake transporters in human gliomas and the blood-tumor barrier. In: Cancer Res 65, 2005, S. 11419–11428. PMID 16357150.
- ↑ H. Kusuhara und Y. Sugiyama: Active efflux across the blood-brain barrier: role of the solute carrier family. In: NeuroRx 2, 2005, S. 73–85. PMID 15717059 (Review).
- ↑ J. M. Scherrmann: Expression and function of multidrug resistance transporters at the blood-brain barriers. In: Expert Opin Drug Metab Toxicol 1, 2005, S. 233–246. PMID 16922639 (Review).
- ↑ N. Bodor und P. Buchwald: Recent advances in the brain targeting of neuropharmaceuticals by chemical delivery systems. In: Adv Drug Deliv Rev 36, 1999, S. 229–254. PMID 10837718 (Review).
- ↑ a b c d e f U. Bickel: How to measure drug transport across the blood-brain barrier. In: NeuroRx 2, 2005, S. 15–26. PMID 15717054 (Review).
- ↑ a b J. Fenstermacher, L. Wei: Measuring local cerebral capillary permeability-surface area products by quantitative autoradiography. In: Introduction to the Blood-brain Barrier W. M. Pardridge (Editor), Cambridge University Press, 1998, ISBN 0-521-58124-9, S. 122–132.
- ↑ C. Crone und D. G. Levitt: Capillary permeability to small solutes. In: Handbook of Physiology American Physiological Society, 1984, S. 375–409.
- ↑ H. Pötzsch: Perfusionscomputertomographische Meßparameter im Kontext klinikopathologischer Eigenschaften von Plattenepithelkarzinomen der Mundhöhle und des Oropharynx. Dissertation, FU Berlin, 2007.
- ↑ A. M. Peters: Fundamentals of tracer kinetics for radiologists. In: Br J Radiol 71, 1998, S. 1116–1129. PMID 10434905 (Review).
- ↑ F. Lasbennes et al.: Capacity for energy metabolism in microvessels isolated from rat brain. In: Neurochem Res 9, 1984, S. 1–10. PMID 6325972.
- ↑ J. Huwyler und W. M. Pardridge: Examination of blood-brain barrier transferrin receptor by confocal fluorescent microscopy of unfixed isolated rat brain capillaries. In: J Neurochem 70, 1998, S. 883–886. PMID 9453586.
- ↑ D. S. Miller et al.: Xenobiotic transport across isolated brain microvessels studied by confocal microscopy. In: Mol Pharmacol 58, 2000, S. 1357–1367. PMID 11093774.
- ↑ a b M. Gumbleton et al.: Progress and limitations in the use of in vitro cell cultures to serve as a permeability screen for the blood-brain barrier. In: J Pharm Sci 90, 2001, S. 1681–1698. PMID 11745727 (Review).
- ↑ A. Reichel et al.: An overview of in vitro techniques for blood-brain barrier studies. In: Methods Mol Med 89, 2003, S. 307–324. PMID 12958429.
- ↑ R. Cecchelli et al.: In vitro model for evaluating drug transport across the blood-brain barrier. In: Adv Drug Deliv Rev 36, 1999, S. 165–178. PMID 10837714.
- ↑ D. Hoheisel et al.: Hydrocortisone reinforces the blood-brain properties in a serum free cell culture system. In: Biochem Biophys Res Commun 247, 1998, S. 312–315. PMID 9679029.
- ↑ S. B. Raymond et al.: Ultrasound Enhanced Delivery of Molecular Imaging and Therapeutic Agents in Alzheimer’s Disease Mouse Models. In: PLoS ONE 3, 2008, e2175. PMID 18478109.
- ↑ J. D. Fenstermacher et al.: Methods for quantifying the transport of drugs across the blood-brain system. In: Pharmacol Ther 14, 1981, S. 217–248. PMID 7031708.
- ↑ G. Molema, D. K. F. Meijer: Drug Targeting: Organ-specific Strategies. Wiley-VCH, 2001, ISBN 3-527-29989-0.
- ↑ J. E. Hardebo, B. Nilsson: Estimation of cerebral extraction of circulating compounds by the brain uptake index method: influence of circulation time, volume injection, and cerebral blood flow. In: Acta Physiol Scand 107, 1979, S. 153–159. PMID 525379.
- ↑ Y. Moriki et al.: Involvement of P-glycoprotein in blood-brain barrier transport of pentazocine in rats using brain uptake index method. In: Biol Pharm Bull 27, 2004, S. 932–935. PMID 15187451.
- ↑ L. J. Murphey und G. D. Olsen: Diffusion of morphine-6-beta-D-glucuronide into the neonatal guinea pig brain during drug-induced respiratory depression. In: J Pharmacol Exp Ther 271, 1994, S. 118–124. PMID 7965704.
- ↑ W. H. Oldendorf et al.: Blood-brain barrier penetration abolished by N-methyl quaternization of nicotine. In: PNAS 90, 1993, S. 307–311. PMID 8419935.
- ↑ D. Magnani: Untersuchungen der Fremdstoffbindung in permanenten Keratinozyten- und Melanozyten-Zelllinien sowie die Eignung von Primärkulturen aus humanen Haarfollikeln zur In-vitro-Messung der Fremdstoffaufnahme im Haar. Dissertation, Carl von Ossietzky Universität Oldenburg, 2005. urn:nbn:de:gbv:715-oops-1151
- ↑ a b E. M. Cornford et al.: Comparison of lipid-mediated blood-brain-barrier penetrability in neonates and adults. In: Am J Physiol-Cell Physiol 243, 1982, S. 161C–168C. PMID 7114247.
- ↑ A. Kakee et al.: Organic anion transport system acting as an efflux pump at the blood-brain barrier: demonstration by a newly developed brain efflux index (BEI) method. In: Proc Int Symp Control Release Bioact Mater 22, 1995, S. 16–18.
- ↑ a b I. Tamai, A. Tsuji: Drug delivery through the blood-brain barrier. In: Adv Drug Deliv Rev 19, 1996, S. 401–424. doi:10.1016/0169-409X(96)00011-7 (Review).
- ↑ B. V. Zlokovic et al.: Measurement of solute transport in the perfused guinea pig brain. Method application to N-methyl-alpha-aminoisobutyric acid. In: J Neurochem 46, 1986, S. 1444–1451. PMID 3083044.
- ↑ D. Triguero et al.: Capillary depletion method for quantification of blood-brain barrier transport of circulating peptides and plasma proteins. In: J Neurochem 54, 1990, S. 1882–1888. PMID 2338547.
- ↑ C. Crone: The permeability of capillaries in various organs as determined by use of the 'Indicator Diffusion' method. In: Acta Physiol Scand 58, 1963 S. 292–305. PMID 14078649.
- ↑ J. B. van Bree et al.: Drug transport across the blood-brain barrier, II. Experimental techniques to study drug transport. In: Pharma Weekbl Sci 14, 1992, S. 338–348. PMID 1475172 (Review).
- ↑ L. Sokoloff et al.: The [14C]deoxyglucose method for the measurement of local cerebral glucose utilization: theory, procedure, and normal values in the conscious and anesthetized albino rat. In: J Neurochem 28, 1977, S. 897–916. PMID 864466.
- ↑ J. D. Fenstermacher, L. Wei: Measuring local cerebral capillary permeability-surface area products by quantitative autoradiography. In: Introduction to the blood-brain barrier: methodology, biology and pathology Cambridge University Press, 1998, ISBN 0-521-58124-9, S. 122–132.
- ↑ a b E. C. M. de Lange et al.: The use of intacerebral microdialysis to determine the changes in blood-brain barrier transport characteristics. In: Pharm Res 12, 1995, S. 129–133. PMID 7724474.
- ↑ E. C. M. de Langeet al.: Critical factors of intracerebral microdialysis as a technique to determine the pharmacokinetics of drugs in rat brain. In: Brain Res 666, 1994, S. 1–8. PMID 7889356.
- ↑ a b E. C. M. de Lange et al.: Methodological considerations of intracerebral microdialysis in pharmacokinetic studies on drug transport across the blood-brain barrier. In: Brain Res Brain Res Rev 25, 1997, S. 27–49. PMID 9370049 (Review).
- ↑ E. C. M. de Lange et al.: BBB transport and P-glycoprotein functionality using MDR1A (-/-) and wild-type mice. Total brain versus microdialysis concentration profiles of rhodamine-123. In: Pharm Res 15, 1998, S. 1657–1665. PMID 9833984.
- ↑ T. Terasaki et al.: In vivo transport of a dynorphin-like analgesic peptide, E 2078, through the blood-brain barrier: an application of microdialysis. In: J Pharmacol Exp Ther 251, 1991, S. 815–820. PMID 1681528.
- ↑ C. Berger et al.: Zerebrale Mikrodialyse beim Schlaganfall. In: Der Nervenarzt 75, 2004, S. 113–123. PMID 14770280.
- ↑ G. Paterno: Die zerebrale Mikrodialyse (PDF; 186 kB) ein Praxisbericht, September 2001.
- ↑ a b S. Syvänen et al.: Species differences in blood-brain barrier transport of three PET radioligands with emphasis on P-glycoprotein transport. In: Drug Metab Dispos 37, 2009, S. 635–643. PMID 19047468.
- ↑ a b J. Bart et al.: New positron emission tomography tracer (11)C-carvedilol reveals P-glycoprotein modulation kinetics. In: Br J Pharmacol 145, 2005, S. 1045–1051. PMID 15951832.
- ↑ N. H. Hendrikse et al.: A new in vivo method to study P-Glycoprotein transport in tumors and the blood-brain barrier. In: Cancer Res 59, 1999, S. 2411–2416. PMID 10344751.
- ↑ S. S. Zoghbi et al.: 11C-loperamide and its N-desmethyl radiometabolite are avid substrates for brain permeability-glycoprotein efflux. In: J Nucl Med 49, 2008, S. 649–656. PMID 18344435.
- ↑ V. Josserand et al.: Evaluation of Drug Penetration into the Brain: A Double Study by in Vivo Imaging with Positron Emission Tomography and Using an in Vitro Model of the Human Blood-Brain Barrier. In: J Pharmacol Exp Ther 316, 2006, S. 79–86. PMID 16210395.
- ↑ D. Matsuzawa et al.: Negative Correlation between Brain Glutathione Level and Negative Symptoms in Schizophrenia: A 3T 1H-MRS Study. In: PLoS ONE 3, 2008, e1944. PMID 18398470.
- ↑ M. Bartels et al.: 19F Nuclear Magnetic Resonance Spectroscopy of neuroleptics: The first in vivo pharmacokinetics of trifluoperazine in the rat brain and the first in vivo spectrum of fluphenazine in the human brain. In: Biol Psychiatry 30, 1991, S. 656–662. PMID 2386658.
- ↑ J. J. H. Ackerman et al.: Mapping of metabolites in whole animals by 31P NMR using surface coils. In: Nature 283, 1990, S. 167–170. PMID 7350541.
- ↑ J. W. Prichard et al.: Cerebral metabolic studies in vivo by 31P NMR. In: PNAS 80, 1983, S. 2748–2751. PMID 6573678.
- ↑ W. M. Pardridge: Blood-brain barrier drug targeting: the future of brain drug development. In: Mol Interv 3, 2003, S. 90–105. PMID 14993430 (Review).
- ↑ D. J. Begley: Delivery of therapeutic agents to the central nervous system: the problems and the possibilities. In: Pharmacol Ther, 104, 2004, S. 29–45. PMID 15500907 (Review).
- ↑ W. M. Pardridge: Why is the global CNS pharmaceutical market so under-penetrated? In: Drug Discovery Today, 7, 2002, S. 5–7. PMID 11790589.
- ↑ A. G. de Boer, P. J. Gaillard: Strategies to improve drug delivery across the blood-brain barrier. In: Clin Pharmacokinet, 46, 2007, S. 553–576. PMID 17596102 (Review).
- ↑ A. G. de Boer und P. J. Gaillard: Drug targeting to the brain. In: Annu Rev Pharmacol Toxicol, 47, 2007, S. 323–355. PMID 16961459 (Review).
- ↑ B. T. Hawkins, R. D. Egleton: Pathophysiology of the blood-brain barrier: animal models and methods. In: Curr Top Dev Biol 80, 2008, S. 277–309. PMID 17950377 (Review).
- ↑ a b c N. Weiss, F. Miller, S. Cazaubon, P. O. Couraud: The blood-brain barrier in brain homeostasis and neurological diseases. In: Biochim. Biophys. Acta 1788, 2009, S. 842–857 PMID 19061857 (Review).
- ↑ I. Elmas et al.: Effects of profound hypothermia on the blood-brain barrier permeability in acute and chronically ethanol treated rats. In: Forensic Science International 119, 2001, S. 212–216. PMID 11376985.
- ↑ S. C. Phillips, B. G. Cragg: Weakening of the blood-brain barrier by alcohol-related stresses in the rat. In: J Neurol Sci, 54, 1982, S. 271–278., PMID 7201507.
- ↑ A. K. Singh et al.: Effects of chronic ethanol drinking on the blood brain barrier and ensuing neuronal toxicity in alcohol-preferring rats subjected to intraperitoneal LPS injection. In: Alcohol Alcohol, 42, 2007, S. 385–399. PMID 17341516.
- ↑ a b J. Haorah et al.: Alcohol-induced blood-brain barrier dysfunction is mediated via inositol 1,4,5-triphosphate receptor (IP3R)-gated intracellular calcium release. In: J Neurochem, 100, 2007, S. 324–336, PMID 17241155.
- ↑ J. Haorah et al.: Ethanol-induced activation of myosin light chain kinase leads to dysfunction of tight junctions and blood-brain barrier compromise. Alcoholism. In: Clinical and Experimental Research 29, 2005, S. 999–1009. PMID 15976526.
- ↑ J. Haorah et al.: Alcoholinduced oxidative stress in brain endothelial cells causes bloodbrain barrier dysfunction. ( vom 16. März 2010 im Internet Archive) In: Journal of Leukocyte Biology, 78, 2005, S. 1223–1232. PMID 16204625.
- ↑ R. Peters et al.: Smoking, dementia and cognitive decline in the elderly, a systematic review. In: BMC Geriatr 8, 2008, S. 36. PMID 19105840 (Review).
- ↑ a b P. R. Lockman et al.: Brain uptake kinetics of nicotine and cotinine after chronic nicotine exposure. In: J Pharmacol Exp Ther 314, 2005, S. 636–642. PMID 15845856.
- ↑ T. J. Abbruscato et al.: Nicotine and cotinine modulate cerebral microvascular permeability and protein expression of ZO-1 through nicotinic acetylcholine receptors expressed on brain endothelial cells. In: J Pharm Sci 91, 2002, S. 2525–2538. PMID 12434396.
- ↑ B. T. Hawkins et al.: Nicotine increases in vivo blood-brain barrier permeability and alters cerebral microvascular tight junction protein distribution. In: Brain Res 1027, 2004, S. 48–58. PMID 15494156.
- ↑ Y. H. Chen et al.: Enhanced Escherichia coli invasion of human brain microvascular endothelial cells is associated with alternations in cytoskeleton induced by nicotine. In: Cell Microbiol 4, 2002, S. 503–514. PMID 12174085.
- ↑ P. R. Lockman et al.: Chronic nicotine exposure alters blood-brain barrier permeability and diminishes brain uptake of methyllycaconitine. In: J Neurochem 94, 2005, S. 37–44. PMID 15953347.
- ↑ M. Kotlyar und D. K. Hatsukami: Managing nicotine addiction. ( des vom 6. Juli 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: J Dent Educ 66, 2002, S. 1061–1073. PMID 12374267.
- ↑ P. R. Pentel et al.: A nicotine conjugate vaccine reduces nicotine distribution to brain and attenuates its behavioral and cardiovascular effects in rats. In: Pharmacol Biochem Behav 65, 2000, S. 191–198. PMID 10638653.
- ↑ D. E. Keyler et al.: Maternal vaccination against nicotine reduces nicotine distribution to fetal brain in rats. In: J Pharmacol Exp Ther 305, 2003, S. 587–592. PMID 12606612.
- ↑ M. G. LeSage et al.: Effects of a nicotine conjugate vaccine on the acquisition and maintenance of nicotine self-administration in rats. In: Psychopharmacology 184, 2006, S. 409–416. PMID 15991003.
- ↑ D. A. D’Andrea et al.: Microwave effects on the nervous system. In: Bioelectromagnetics 6, 2003, S. 107–147. PMID 14628310 (Review).
- ↑ T. H. Patel et al.: Blood brain barrier (BBB) dysfunction associated with increased expression of tissue and urokinase plasminogen activators following peripheral thermal injury. In: Neurosci Lett 444, 2008, S. 222–226. PMID 18718505.
- ↑ I. Ruppe: Aufbau und Funktion der Blut-Hirn-Schranke. ( vom 16. Februar 2010 im Internet Archive) (PDF; 113 kB) In: Newsletter 1, 2003, S. 15–17.
- ↑ B. R. Persson et al.: Increased permeability of the blood-brain barrier induced by magnetic and electromagnetic fields. In: Ann N Y Acad Sci649, 1992, S. 356–358. PMID 1580510.
- ↑ L. G. Salford et al.: Nerve cell damage in mammalian brain after exposure to microwaves from GSM mobile phones. In: Environ Health Perspect 111, 2003, S. 881–883. PMID 12782486.
- ↑ H. Nittby et al.: Radiofrequency and extremely low-frequency electromagnetic field effects on the blood-brain barrier. In: Electromagn Biol Med 27, 2008, S. 103–126. PMID 18568929 (Review).
- ↑ J. L. Eberhardt et al.: Blood-brain barrier permeability and nerve cell damage in rat brain 14 and 28 days after exposure to microwaves from GSM mobile phones. In: Electromagn Biol Med 27, 2008, S. 215–229. PMID 18821198.
- ↑ L. G. Salford et al.: Permeability of the blood-brain barrier induced by 915 MHz electromagnetic radiation, continuous wave and modulated at 8, 16, 50, and 200 Hz. In: Microsc Res Tech 27, 1994, S. 535–542. PMID 8012056.
- ↑ A. Schirmacher et al.: Electromagnetic fields (1.8 GHz) increase the permeability to sucrose of the blood–brain barrier in vitro. In: Bioelectromagnetics 21, 2000, S. 338–345. PMID 10899769.
- ↑ H. Franke et al.: Electromagnetic fields (GSM 1800) do not alter blood-brain barrier permeability to sucrose in models in vitro with high barrier tightness. In: Bioelectromagnetics 26, 2005, S. 529–535. PMID 16142784.
- ↑ H. J. Weinmann et al.: Characteristics of Gadolinium-DTPA Complex: A Potential NMR Contrast Agent. In: Am J Roentgenol 142, 1984, S. 619–624. PMID 6607655.
- ↑ R. C. Brasch et al.: Contrast-enhanced NMR imaging: animal studies using gadolinium-DTPA complex. In: Am J Roentgenol 142, 1984, S. 625–630. PMID 6607656.
- ↑ V. M. Runge et al.: Visualization of Blood-Brain Barrier Disruption on MR Images of Cats with Acute Cerebral Infarction: Value of Administering a High Dose of Contrast Material. In: AJR Am J Roentgenol 162, 1994, S. 431–435. PMID 8310940.
- ↑ M. A. Ibrahim et al.: Magnetic resonance imaging relaxation times and gadolinium-DTPA relaxivity values in human cerebrospinal fluid. In: Invest Radiol 33, 1998, S. 153–162. PMID 9525754.
- ↑ A. V. Alexandrov et al.: Clinical significance of increased uptake of HMPAO on brain SPECT scans in acute stroke. In: J Neuroimaging, 6, 1996, S. 150–155. PMID 8704289 (Review).
- ↑ J. C. Masdeu, J. Arbizu: Brain single photon emission computed tomography: technological aspects and clinical applications. In: Semin Neurol 28, 2008, S. 423–434. PMID 18843571 (Review).
- ↑ M. Essig: Bildgebende CT-Diagnostik beim Schlaganfall. In: Visions 12, 2005, S. 15–17.
- ↑ K. A. Miles: Perfusion CT for the assessment of tumour vascularity: which protocol? In: Br J Radiol 76, 2003, S. 36–42. PMID 15456712.
- ↑ D. A. Leggett et al.: Blood-brain barrier and blood volume imaging of cerebral glioma using functional CT: a pictorial review. In: Eur J Radiol 30, 1999, S. 185–190. PMID 10452716 (Review).
- ↑ P. Ehrlich: Das Sauerstoff-Bedürfniss des Organismus: Eine farbenanalytische Studie. August Hirschwald, Berlin, 1885, 167 S. (die Habilitationsschrift von Paul Ehrlich).
- ↑ P. Ehrlich: Ueber die Beziehungen von chemischer Constitution, Verteilung und Pharmakologischer Wirkung. Gesammelte Arbeiten zur Immunitaetsforschung. August Hirschwald, Berlin, 1904, S. 574.
- ↑ R. Adam, AC Hüntelmann: Pioneers in Neurology - Edwin Ellen Goldmann. In: J Neurology. Band 270, Nr. 5, 2023, S. 2812–2814, PMID 36976327.
- ↑ E. E. Goldmann: Die äußere und innere Sekretion des gesunden und kranken Organismus im Lichte der vitalen Färbung. In: Beitr Klin Chirurg 64, 1909, S. 192–265.
- ↑ E. E. Goldmann: Vitalfärbung am Zentralnervensystem. In: Abh. K. Preuss. Akad. Wiss. Phys. Med. 1, 1913, S. 1–60.
- ↑ A. Biedl, R. Kraus: Über eine bisher unbekannte toxische Wirkung der Gallensäuren auf das zentrale Nervensystem. In: Zentralblatt Innere Medizin, 19, 1898, S. 1185–1200.
- ↑ M. Lewandowsky: Zur Lehre von der Cerebrospinal Flüssigkeit. In: Zentralblatt Klinische Medizin, 40, 1900, S. 480–494.
- ↑ C. S. Roy, C. S. Sherrington: On the regulation of the blood supply of the brain. (PDF; 3,7 MB) In: J Physiol, 11, 1890, S. 85–108.
- ↑ A. A. Vein: Lina Stern: Science and fate.
- ↑ F. K. Walter: Die allgemeinen Grundlagen des Stoffaustausches zwischen dem Zentralnervensystem und dem übrigen Körper. In: Arch Psychiatr Nervenkr 101, 1930, S. 195–230.
- ↑ H. Spatz: Die Bedeutung der vitalen Färbung für die Lehre vom Stoffaustausch zwischen dem Zentralnervensystem und dem übrigen Körper. In: Arch Psychiatr Nervenkr 101, 1933, S. 267–358.
- ↑ U. Friedemann: Blood-brain barrier. In: Physiol Rev 22, 1942, S. 125–145.
- ↑ R. D. Tschirgi: Blood-brain barrier: fact or fancy? In: Fed Proc 21, 1962, S. 665–671. PMID 13922779.
- ↑ G. Miller: Drug targeting. Breaking down barriers. In: Science 297, 2002, S. 1116–1118. PMID 12183610.
- ↑ T. S. Reese, M. J. Karnovsky: Fine structural localization of a blood-brain barrier to exogenous peroxidase. In: J Cell Biol 34, 1967, S. 207–217. PMID 6033532.



