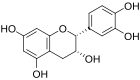
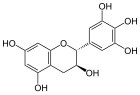
Catechine

Catechine (Flavan-3-ole, Flavanole) sind polyphenolische Pflanzenmetaboliten aus der Gruppe der Flavonoide und zählen daher allgemeinhin zu den sekundären Pflanzenstoffen. Sie leiten sich vom Flavan-3-ol ab. Besondere Bedeutung haben sie aufgrund eines hohen antioxidativen Potentials.
Vertreter
[Bearbeiten | Quelltext bearbeiten]Catechine sind als hydrierte Flavone oder Anthocyanidine und als Derivate des Chromans aufzufassen. Die am häufigsten vorkommenden vier Substanzen der Gruppe lassen sich jeweils in zwei Isomerenpaare aufteilen: (+)-Catechin und (−)-Epicatechin mit der Summenformel C15H14O6 und der molaren Masse 290 g/mol sowie (+)-Gallocatechin und (−)-Epigallocatechin mit der Summenformel C15H14O7 und der molaren Masse 306 g/mol finden sich relativ häufig in verschiedenen Pflanzenspezies.[1] Daneben kommen (−)-Robinetinidol, (+)-Fisetinidol, (−)-Fisetinidol, (+)-Afzelechin, (+)-Epiafzelechin und (−)-Epiafzelechin, meist auf wenige Pflanzenarten begrenzt, vor.[2] Die einzelnen Verbindungen unterscheiden sich durch Zahl und Stellung ihrer Hydroxygruppen.
-
(+)-Catechin
-
(−)-Epicatechin
-
(+)-Gallocatechin
-
(−)-Epigallocatechin
| Isomere des 2-(3,4-Dihydroxyphenyl)-3,4-dihydro-1-(2H)-benzopyran-3,5,7-triols | |||||||
| Name | (+)-Catechin | (−)-Catechin | (−)-Epicatechin | (+)-Epicatechin | |||
| Konfiguration | 2R,3S | 2S,3R | 2R,3R | 2S,3S | |||
| trans | cis | ||||||
| Andere Namen | Cianidanol (INN) | l-Acacatechin | |||||
| Strukturformel | 
|

|
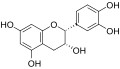
|

| |||
| CAS-Nummer |
|
|
490-46-0 | 35323-91-2 | |||
| PubChem | 9064 | 73160 | 72276 | 182232 | |||
| Summenformel | C15H14O6 | ||||||
| Molare Masse | 290,27 g·mol−1 | ||||||
| Aggregatzustand | fest | ||||||
| Schmelzpunkt | 240 °C (Zersetzung)[3] | ||||||
| GHS- Kennzeichnung |
|
|
|
||||
| H- und P-Sätze | 315‐319 | keine H-Sätze | 315‐319‐335 | ||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||
| 264‐280‐302+352‐332‐313 362‐364‐305+351+338‐337+313 |
keine P-Sätze | 261‐305+351+338 | |||||
Vorkommen, Eigenschaften und Bedeutung
[Bearbeiten | Quelltext bearbeiten]
Catechine kommen als Zwischenstufen der Biosynthese anderer sekundärer Pflanzenstoffe (Flavonoide) in vielen pflanzlichen Geweben zusammen mit weiteren Polyphenolen (meist Epigallocatechin) vor. Sie bilden die monomeren Bausteine der kondensierten Proanthocyanidine, einer Reihe natürlicher Gerbstoffe, z. B. im schwarzen Tee oder Kakao, wo sie auch zur Geschmacksbildung beitragen.[1] Bis zu diesem Kondensationsgrad weisen die Catechingerbstoffe eine Löslichkeit in reinem Ethanol auf, was besonders für die Arzneimittelherstellung wichtig ist. Die Catechingerbstoffe gehören zu den nichthydrolysierbaren Gerbstoffen. Andere Bezeichnungen für Catechingerbstoffe sind „kondensierte Gerbstoffe“ oder „kondensierte Anthocyanidine“. Das Brenzcatechin (1,2-Dihydroxybenzol) gehört nicht in diese Stoffgruppe, ist jedoch struktureller Bestandteil der Catechine.
Man findet Catechine darüber hinaus in vielen anderen Teesorten, darunter Weißtee, Grüntee (Epigallocatechingallat, ein Ester der Gallussäure mit Epigallocatechin) und Oolong. Hier sind die Gehalte sogar relativ höher, da die Polyphenoloxidase des schwarzen Tees eine gewisse Menge der Catechine zu Theaflavinen fermentiert. Catechine kommen auch in Gemüse und Wein sowie im Holz der namensgebenden Gerber-Akazie Acacia catechu[6] vor. Auch sehr viele Obstsorten – wie Äpfel, Aprikosen, Birnen, Brombeeren, Erdbeeren, Himbeeren, schwarze Johannisbeeren, Pfirsiche, Pflaumen, Quitten, Sauerkirschen, Stachelbeeren, Süßkirschen und Weintrauben – enthalten Catechine.[1]
Nachweisreaktionen
[Bearbeiten | Quelltext bearbeiten]- Qualitativ
- Reaktion von Catechinen mit Vanillin und HCl. Bei dieser Reaktion entsteht eine charakteristische Rotfärbung durch die Kondensation von Catechin mit Vanillin.
- Nachweis auf Phenole mit Eisen(III)-chlorid: Es kommt zu einer Grünfärbung. Diese Färbung weist auf die Brenzcatechin-Struktur hin, denn Brenzcatechin ergibt mit Eisen(III)-Ionen selbst eine Grünfärbung.
- Nachweis mit Wolframatophosphorsäure auf Phenole: Diese reduzieren Wolframatophosphorsäure zu blauem Wolframoxid, das leicht an seiner intensiven Färbung erkannt werden kann.
- Erhitzen mit Mineralsäuren und daraus entstehende Rotfärbung.
- Quantitativ
- Die Gehaltsbestimmung kann mit der Wolframphosphorsäure-Hautpulver-Methode oder gravimetrisch erfolgen.
Physiologische Wirkung beim Menschen
[Bearbeiten | Quelltext bearbeiten]Catechin-haltige Pflanzen, zum Beispiel die Gerber-Akazie wurden ursprünglich wegen ihrer adstringierenden Wirkung verwendet[7]. Heute gibt es Hinweise, dass catechin-haltige Pflanzen und Pflanzenextrakte, wie zum Beispiel Kakao oder grüner Tee, durch Vasodilatation die Durchblutung fördern können.[8][9] Diese Aussagen beruhen jedoch hauptsächlich auf kurzen Interventionsstudien und es gibt derzeit (2017) keine Daten zur Langzeitwirkung.

Catechine werden bereits bei der Aufnahme im Jejunum,[12] und ebenso in der Leber metabolisiert, hauptsächlich durch Glucuronidierung, Sulphatierung und Methylierung.[13] Weiterhin werden Catechine durch die Darmflora metabolisiert, wobei eines der spezifischen Hauptprodukte[14] 5-(3′,4′-Dihydroxyphenyl)-γ-valerolacton ist. 5-(3′,4′-Dihydroxyphenyl)-γ-valerolacton wird ebenfalls in der Leber metabolisiert. Beim Metabolismus gibt es große speziesspezifische Unterschiede zwischen Mensch, Maus und Ratte.[15]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Catechine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Oktober 2011.
- ↑ Catechine. In: Lexikon der Biochemie. Spektrum der Wissenschaft Verlagsgesellschaft, abgerufen am 13. Juli 2024.
- ↑ a b Datenblatt (−)-Epicatechin, ≥98% (HPLC), from green tea bei Sigma-Aldrich, abgerufen am 27. Juli 2017 (PDF).
- ↑ Eintrag zu (+)-Catechin Hydrate bei TCI Europe, abgerufen am 27. Juli 2017.
- ↑ Datenblatt (−)-Catechin, ≥97% (HPLC), from green tea bei Sigma-Aldrich, abgerufen am 27. Juli 2017 (PDF).
- ↑ Wissenschaft-Online-Lexika: Eintrag zu „Acacia-Arten“ im Lexikon der Arzneipflanzen und Drogen, abgerufen am 4. Oktober 2011.
- ↑ Johann Schroeder: Pharmacopoeia medico-chymica: sive thesaurus pharmacologeus. Hrsg.: Johannis Gerlini. Ulmae Suevorum 1655.
- ↑ Lee Hooper, Colin Kay, Asmaa Abdelhamid, Paul A. Kroon, Jeffrey S. Cohn: Effects of chocolate, cocoa, and flavan-3-ols on cardiovascular health: a systematic review and meta-analysis of randomized trials. In: The American Journal of Clinical Nutrition. Band 95, Nr. 3, 1. März 2012, S. 740–751, doi:10.3945/ajcn.111.023457, PMID 22301923 (nutrition.org [abgerufen am 12. September 2017]).
- ↑ Sabine Ellinger, Andreas Reusch, Peter Stehle, Hans-Peter Helfrich: Epicatechin ingested via cocoa products reduces blood pressure in humans: a nonlinear regression model with a Bayesian approach. In: The American Journal of Clinical Nutrition. Band 95, Nr. 6, 1. Juni 2012, S. 1365–1377, doi:10.3945/ajcn.111.029330, PMID 22552030 (nutrition.org [abgerufen am 12. September 2017]).
- ↑ Gina Borges, Justin J.J. van der Hooft, Alan Crozier: A comprehensive evaluation of the [2-14C](−)-epicatechin metabolome in rats. In: Free Radical Biology and Medicine. Band 99, S. 128–138, doi:10.1016/j.freeradbiomed.2016.08.001 (elsevier.com [abgerufen am 12. September 2017]).
- ↑ Javier I. Ottaviani, Gina Borges, Tony Y. Momma, Jeremy P. E. Spencer, Carl L. Keen: The metabolome of [2-14C](−)-epicatechin in humans: implications for the assessment of efficacy, safety and mechanisms of action of polyphenolic bioactives. In: Scientific Reports. Band 6, Nr. 1, 1. Juli 2016, doi:10.1038/srep29034 (nature.com [abgerufen am 12. September 2017]).
- ↑ Lucas Actis-Goretta, Antoine Lévèques, Maarit Rein, Alexander Teml, Christian Schäfer: Intestinal absorption, metabolism, and excretion of (−)-epicatechin in healthy humans assessed by using an intestinal perfusion technique. In: The American Journal of Clinical Nutrition. Band 98, Nr. 4, 1. Oktober 2013, S. 924–933, doi:10.3945/ajcn.113.065789, PMID 23864538 (nutrition.org [abgerufen am 12. September 2017]).
- ↑ Javier I. Ottaviani, Tony Y. Momma, Gunter K. Kuhnle, Carl L. Keen, Hagen Schroeter: Structurally related (−)-epicatechin metabolites in humans: Assessment using de novo chemically synthesized authentic standards. In: Free Radical Biology and Medicine. Band 52, Nr. 8, S. 1403–1412, doi:10.1016/j.freeradbiomed.2011.12.010 (elsevier.com [abgerufen am 12. September 2017]).
- ↑ N. P. Das: Studies on flavonoid metabolism. Absorption and metabolism of (+)-catechin in man. In: Biochemical Pharmacology. Band 20, Nr. 12, Dezember 1971, S. 3435–3445, PMID 5132890.
- ↑ Javier I. Ottaviani, Gina Borges, Tony Y. Momma, Jeremy P. E. Spencer, Carl L. Keen: The metabolome of [2-14C](−)-epicatechin in humans: implications for the assessment of efficacy, safety and mechanisms of action of polyphenolic bioactives. In: Scientific Reports. Band 6, Nr. 1, 1. Juli 2016, doi:10.1038/srep29034 (nature.com [abgerufen am 12. September 2017]).