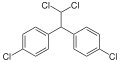
Dichlordiphenyltrichlorethan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Dichlordiphenyltrichlorethan | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C14H9Cl5 | |||||||||||||||||||||
| Kurzbeschreibung |
farblos, charakteristischer Geruch, brennbar, in Reinform Kristalle, technisches Produkt wachsartig[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 354,49 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung[2] | |||||||||||||||||||||
| Dampfdruck |
0,025 mPa (20 °C)[1] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
1 mg·m−3[2] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Dichlordiphenyltrichlorethan, abgekürzt DDT, ist ein Insektizid, das seit Anfang der 1940er-Jahre als Kontakt- und Fraßgift eingesetzt wird. Wegen seiner guten Wirksamkeit gegen Insekten, der geringen Toxizität für Säugetiere und des einfachen Herstellungsverfahrens war es jahrzehntelang das weltweit meistverwendete Insektizid. Allerdings reicherte es sich wegen seiner chemischen Stabilität und guten Fettlöslichkeit im Gewebe von Menschen und Tieren am Ende der Nahrungskette an.
Im Laufe der Zeit wurde festgestellt, dass DDT und einige seiner Abbauprodukte hormonähnliche Wirkungen zeigen. Greifvögel legten Eier mit dünneren Schalen, was zu erheblichen Bestandseinbrüchen führte. DDT geriet unter Verdacht, beim Menschen Krebs auslösen zu können. Aus diesen Gründen wurde die Verwendung von DDT von den meisten westlichen Industrieländern in den 1970er-Jahren verboten. In Ländern, die das Stockholmer Übereinkommen aus dem Jahr 2004 ratifiziert haben, ist die Herstellung und Verwendung von DDT nur noch zur Bekämpfung von krankheitsübertragenden Insekten, insbesondere den Überträgern der Malaria, zulässig.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Entdeckung
[Bearbeiten | Quelltext bearbeiten]Erstmals synthetisiert wurde DDT im Jahre 1874 durch den österreichischen Chemiker Othmar Zeidler unter Leitung von Adolf von Baeyer. Die insektizide Wirkung wurde allerdings erst 1939 von dem Schweizer Paul Hermann Müller entdeckt, der hierfür 1948 den Nobelpreis in Medizin erhielt. Müller war Mitarbeiter einer Forschungsgruppe bei der J. R. Geigy AG, die an Schmeißfliegen ein Screening verschiedener Chemikalien auf ihre insektizide Wirksamkeit durchführte. Geigy brachte DDT 1942 unter den Handelsnamen Gesarol (Mittel zum Pflanzenschutz und gegen Vorratsschädlinge) und Neocid (Hygienebereich) auf den Markt.
Kriegsjahre
[Bearbeiten | Quelltext bearbeiten]Im Deutschen Reich interessierte man sich besonders wegen der Wirksamkeit gegen den Kartoffelkäfer für DDT. Das Reichsministerium für Ernährung und Landwirtschaft gab 1942 eine Bestellung über 10.000 t Gesarol auf, was etwa 500 t Reinsubstanz entsprach. Da das die eigenen Kapazitäten überschritt, schloss Geigy 1943 einen Lizenzvertrag mit der Schering AG. Im April 1943 begann auch das Geigy-Zweigwerk im badischen Grenzach, DDT herzustellen. Bei der Wehrmacht wurde Ende 1942 zur Läusebekämpfung das Präparat Lauseto der I.G. Farben eingeführt. Anfang 1944 ergab eine Analyse in den Laboren von Schering, dass dieses 15 % DDT enthielt. Die I.G. Farben sicherte Geigy daraufhin die Zahlung von Lizenzgebühren für Lauseto und ihr neuentwickeltes Fliegenmittel Gix zu. Das Produktionsvolumen von DDT im Deutschen Reich wurde nie ausgeschöpft, da die I.G. Farben das für die Herstellung benötigte Chloral nicht in den erforderlichen Mengen lieferte.[5] Ersatzweise wurden andere Produkte, z. B. auf Blausäurebasis (wie etwa Zyklon B) in der Schädlingsbekämpfung eingesetzt.
In den Vereinigten Staaten von Amerika waren schon vor 1941 durch Fortschritte in Medizin und Gesundheitsvorsorge alle lebensbedrohenden ansteckenden Krankheiten weitestgehend unter Kontrolle. Nach dem Eintritt der USA in den Zweiten Weltkrieg mussten die US-Soldaten auch in den Kriegsgebieten vor dort verbreiteten Krankheiten wie Malaria oder Typhus geschützt werden. Hier sollte sich die Verwendung von DDT als einfache Lösung einer ganzen Reihe komplexer Probleme erweisen.[6]

Das amerikanische Department of Agriculture erhielt etwa Mitte des Jahres 1942 einige Proben Gesarol von Geigy. Während der Jahre 1942 und 1943 wurde DDT in den USA intensiv auf seine Wirksamkeit und eventuelle schädliche Auswirkungen untersucht. Ab Mitte 1944 wurden verstärkt Methoden zur effizienten Herstellung und Ausbringung entwickelt. Ende des Jahres 1944 wurden monatlich etwa 900 Tonnen DDT für das US-Militär hergestellt, bei Kriegsende waren es etwa 1350 Tonnen im Monat.[7]
Einer der ersten großen Einsätze von DDT war zur Läusebekämpfung bei einer Fleckfieber-Epidemie, die 1943/44 in Neapel ausgebrochen war. Durch eine systematische und konsequente Bekämpfung der krankheitsübertragenden Läuse mit Pyrethrum und DDT konnte die Seuche eingedämmt werden. Mit Hilfe eines damals neuen Verfahrens konnten große Teile der Bevölkerung rasch entlaust werden; dabei wurde das Insektenpulver mit einem Pulverzerstäuber am Kragen zwischen die Lagen der Kleidung geblasen.[8] Die Presse schrieb den Erfolg hauptsächlich DDT zu, es galt fortan als „Wundermittel“ gegen insektenübertragene Krankheiten.[9]
Der Großteil des DDT wurde zur Malariavorbeugung im Südpazifik verwendet. Vom Flugzeug aus wurden ganze Inseln mit DDT-Lösung eingesprüht, die Aufwandmenge war mit 220 bis 280 g DDT/ha niedrig.[9] Zur Ausrüstung der in Südostasien eingesetzten amerikanischen Soldaten gehörte eine Sprühdose mit DDT oder Pyrethrum, um Behelfsunterstände mückenfrei zu machen. Gegen Kriegsende war DDT für das US-Militär zum Standardmittel zur Entwesung von Soldaten, Kriegsgefangenen und der Zivilbevölkerung geworden.[7]
Landwirtschaft
[Bearbeiten | Quelltext bearbeiten]
Das War Production Board der USA gab DDT am 1. August 1945 für die zivile Nutzung frei. Durch Presseberichte über die erfolgreiche Malaria- und Fleckfieberbekämpfung während des Krieges waren die Erwartungen hoch. Die FDA hatte Bedenken gegen eine schnelle Freigabe, da DDT bei einer Untersuchung zu Leberschäden bei Ratten geführt hatte. Es gab bereits Hinweise, dass es sich im Körper und in der Milch anreichern konnte. Da die FDA damals nicht die Befugnis hatte, eine Freigabe zu verhindern, legte sie einen provisorischen Höchstgehalt von 7 ppm für Lebensmittel fest. In Milch sollte überhaupt kein DDT toleriert werden. Der Preis pro Pfund DDT betrug anfangs mehr als 1 US-Dollar, bis Mitte der 1950er-Jahre sank er auf 0,25 US-Dollar.[9]
In der Folgezeit wurde DDT vielerorts als Pflanzenschutzmittel in der Landwirtschaft angewendet. Im Obst- und Weinbau ersetzte DDT bald das bis dahin häufig verwendete Bleiarsenat. Es fand auch in Insektensprays für den Haushalt Verwendung.
Im Jahre 1962 war DDT allein in den USA für 334 verschiedene landwirtschaftliche Anwendungsfälle registriert.[3] DDT war über einige Jahrzehnte hinweg das am häufigsten verwendete Insektizid weltweit. Die Aufwandmengen in der Landwirtschaft lagen je nach Kultur in dem weiten Bereich von 0,5 bis 35 kg DDT/ha.[10] Beim Baumwollanbau war der DDT-Einsatz besonders hoch.
Großaktionen und Forstwirtschaft
[Bearbeiten | Quelltext bearbeiten]
In der Schweiz wurden 1950 DDT und HCH im sogenannten „Maikäferkrieg“ getestet. Die Insektizide wurden mit Motorspritzen, Nebelblasern und Sprühflugzeugen entlang der Waldränder ausgebracht. Diesen Aktionen fielen auch zahlreiche andere Insekten zum Opfer, Bienenzüchter mussten entschädigt werden, unter Naturschützern und in der Bevölkerung regte sich Protest. Die begleitende wissenschaftliche Auswertung ergab, dass mit DDT behandelte Waldränder vom Maikäfer gemieden wurden, der einfach auf unbehandelte Bestände auswich. Geigy stellte die Aktionen dennoch als Erfolg dar und konnte die Fortsetzung der Maikäferbekämpfung mit Hilfe der Politik durchsetzen.[11]
Gegen den Ulmensplintkäfer, den Überträger des für das Ulmensterben verantwortlichen Pilzes, wurde in den USA von 1947 bis in die 1960er-Jahre DDT verwendet. Die Ulme war ein häufiger Alleebaum in den Vorstädten, auch dort wurde DDT versprüht. Wegen der hohen Dosierung (etwa 700 g DDT/Baum) kam es zu zahlreichen akuten Vergiftungen bei Vögeln. Aus einigen Orten, in denen viele Ulmen mit dem Insektizid behandelt worden waren, verschwanden die Singvögel komplett. Naturschützer und Wissenschaftler wurden auf die Umweltwirkungen von DDT aufmerksam und begannen sich damit zu befassen.
Zur Bekämpfung des Schwammspinners wurden 1956 etwa 12.000 km2, größtenteils im Bundesstaat New York, vom Flugzeug aus mit DDT besprüht. Auf der behandelten Fläche lagen auch Vorstädte und Farmland. Da DDT auf Weideflächen gelangt war, war die Milch der Kühe von diesen Weiden nicht mehr verkäuflich. Außerdem kam es zu Fischsterben. Einige Einwohner von Long Island versuchten, das Sprühprogramm gerichtlich zu stoppen (Long Island case), hatten damit aber keinen Erfolg.[9]
In der DDR wurde DDT gegen den Borkenkäfer verwendet. Wegen starken Befalls der Forste wurden dort 1983/84 insgesamt etwa 600 Tonnen DDT ausgebracht, was allerdings eine untypisch große Menge war.[10] Als Folge sind heute noch erhöhte Konzentrationen von DDT und Isomeren in Waldböden v. a. Brandenburgs nachweisbar.[12][13]
Malariabekämpfung
[Bearbeiten | Quelltext bearbeiten]
Beim Einsatz von DDT zur Malariabekämpfung werden die Innenwände von Häusern und Hütten mit einer DDT-Suspension besprüht (Indoor Residual Spraying, IRS). Wenn sich die Malariamücken (Anopheles) dort absetzen, nehmen sie eine tödliche Dosis DDT auf. Da DDT an der Wand etwa ein halbes Jahr wirksam bleibt, muss die Sprühaktion zweimal jährlich durchgeführt werden, bei saisonal auftretender Malaria nur einmal. Pro Quadratmeter Wandfläche sind 1–2 g DDT notwendig.
Ab Mitte der 1950er-Jahre begann die WHO das Global Eradication of Malaria Program. Neuansteckungen infolge von Mückenstichen sollten durch Besprühen der Wände mit DDT-Lösung verhindert werden. Parallel dazu sollten die bereits Erkrankten mit Medikamenten behandelt werden. Die Kampagne war zunächst äußerst erfolgreich. In Indien konnte die Zahl der jährlichen Neuinfektionen mit Malaria von 100 Millionen (1952) auf 50.000 (1961) gesenkt werden. Ähnliche Erfolge wurden auch in Pakistan, Ceylon (heute Sri Lanka), Paraguay, Venezuela, Mexiko und Zentralamerika erzielt. In Europa war Malaria Ende der 1960er-Jahre ausgerottet.
Aus verschiedenen Gründen stieg danach in einigen der beteiligten tropischen Länder die Zahl der Malaria-Infektionsfälle wieder an. Da in der Zwischenzeit DDT-Resistenzen bei verschiedenen Arten der Anophelesmücke aufgetreten waren, brachte die Wiederaufnahme der DDT-Sprühprogramme nicht mehr denselben Erfolg wie beim ersten Einsatz. Die WHO musste 1972 eingestehen, dass das ehrgeizige Ziel der weltweiten Ausrottung der Malaria nicht zu erreichen war. In der Folgezeit war Schadensbegrenzung durch malaria control das offizielle Ziel.
Bei der Malariabekämpfung blieben die Verwendung von DDT und anderen Organochlorpestiziden auch nach dem Ende des Ausrottungsprogramms 1972 Standard. Ab 1992 wurden von der WHO mit Pyrethroiden imprägnierte Moskitonetze empfohlen. Auf dem Einsatz von DDT beruhende Großprojekte galten ab 1993 als nicht „nachhaltig“. Nach einer Empfehlung der WHO von 1997 sollte DDT nur noch als Bestandteil „integrierter“ Programme eingesetzt werden.[7] Im Jahre 2006 empfahl die WHO die Anwendung von DDT innerhalb von Gebäuden ausdrücklich, da der zu erwartende Effekt auf die Umgebung gering sei, während die Vektoren (krankheitsübertragende Insekten), die sich vor und nach den Blutmahlzeiten an den Wänden absetzen, gut erreicht werden könnten.[14]
Verbot in den USA
[Bearbeiten | Quelltext bearbeiten]Mitte der 1950er-Jahre wurde die schädigende Wirkung von DDT auf Vögel bekannt. Im Jahre 1962 veröffentlichte die US-amerikanische Biologin Rachel Carson das Buch Silent Spring („Der stumme Frühling“), mit dem sie die Probleme und Risiken des Einsatzes von Pestiziden einer breiten Öffentlichkeit bekannt machte. Das Buch löste in den USA eine teilweise heftig geführte Debatte über den Einsatz von DDT aus. Der großflächige Einsatz (wie gegen den Schwammspinner) sowie die Verwendung sehr hoher Dosierungen (wie gegen den Ulmensplintkäfer) galten bald auch unter DDT-Befürwortern als missbräuchlich und wurden eingestellt.[9]
Die Vogelschutzorganisation Audubon Society richtete 1965 den Rachel Carson Fund ein, um vor Gericht gegen den Einsatz von DDT vorzugehen. Der 1967 aufgelegte Environmental Defense Fund verfolgte dieselbe Taktik. Ein Durchbruch gelang ihnen 1969 bei einer öffentlichen Anhörung im Bundesstaat Wisconsin. Dabei ging es um die Frage, ob die Anwendung von DDT für Menschen und Tiere sicher sei. Die Vertreter des USDA mussten im Kreuzverhör zugeben, keine eigenen Toxizitätstests vorgenommen, sondern Herstellerangaben übernommen zu haben. Im Schlussbericht der Anhörung wurde empfohlen, den Gebrauch von DDT in Wisconsin einzustellen. In der Zwischenzeit hatte Präsident Nixon ein Beratergremium eingerichtet, das im November 1969 ein „Phasing out“ von DDT empfahl. Nixon entschied, dass US-Regierungsbehörden nach einer Übergangsfrist von zwei Jahren kein DDT mehr verwenden sollten.[7]
Der Leiter einer Anhörung durch die Environmental Protection Agency, Edmund M. Sweeney, kam in seinem Abschlussbericht zu der Auffassung, dass kein Gesetzesverstoß aufgrund fehlender Warnhinweise vorliege, DDT bei vorschriftsmäßiger Anwendung kein unverhältnismäßiges Risiko in Vergleich zum Nutzen darstelle und Ersatzstoffe für DDT teilweise deutlich gefährlicher seien.[15] EPA-Administrator William D. Ruckelshaus folgte dieser Empfehlung nicht und erließ am 14. Juni 1972 ein Verbot der Ausbringung von DDT in der Landwirtschaft, das nach sechs Monaten in Kraft treten sollte. Als Begründung wurde unter anderem auf seine Langlebigkeit, seine Biomagnifikation und toxikologischen Wirkungen sowie die Verfügbarkeit von wirksamen und ökologisch weniger schädlichen Ersatzstoffen verwiesen.[16] Der Einsatz zur Krankheitsbekämpfung sowie der Export blieben erlaubt.[17]
Einige DDT-Hersteller und Anwender versuchten, diese Entscheidung anzufechten; ihre Klage wurde allerdings im Dezember 1973 vom Appellationsgerichtshof in Washington abgewiesen. Der Environmental Defense Fund seinerseits versuchte ohne Erfolg, ein Herstellungs- und Exportverbot für DDT einzuklagen. In den Jahren 1973 und 1974 erteilte die EPA Ausnahmegenehmigungen für den Einsatz gegen den Gestreiften Blattrandkäfer (pea leaf weevil). 1974 wurde ein großflächiger DDT-Einsatz gegen eine Trägspinner-Art (englisch Douglas fir tussock moth) in den Wäldern im Nordwesten der USA genehmigt.[9]
Präsident Carter erließ wenige Tage vor Ende seiner Amtszeit 1981 die Executive Order 12264, die den Export von in den USA nicht zugelassenen Chemikalien, unter anderem DDT, verbot. Sein Nachfolger Reagan hob diesen Erlass jedoch schnell wieder auf. Der letzte verbliebene Hersteller in den USA, Montrose Chemical, stellte die DDT-Produktion aus wirtschaftlichen Gründen im Juni 1982 ein.[18]
Verbote in Europa
[Bearbeiten | Quelltext bearbeiten]Silent Spring war zwar auch in Europa erfolgreich, das Echo in den Medien und in der öffentlichen Diskussion blieb jedoch geringer. Die DDT-Frage spielte für Politik und Umweltbewegungen bei weitem nicht eine so große Rolle wie in den USA. Diskussionen und Entscheidungen über Zulassung oder Verbot von DDT fanden in den zuständigen Fachgremien statt. Die Entwicklung in den USA wurde dort aufmerksam verfolgt.
Im Frühjahr 1968 untersagten die USA und Kanada die Einfuhr schweizerischen Käses, weil er die Höchstgehalte an Lindan, Dieldrin und DDT überschritt. Als Hauptursache wurde eine insektizidhaltige Anstrichfarbe ausgemacht, mit der viele Kuhställe zur Fliegenbekämpfung gestrichen worden waren.
Als erstes europäisches Land verbot Schweden mit Wirkung zum 1. Januar 1970 die Verwendung von DDT. Im Frühjahr 1970 beschränkte die Eidgenössische Forschungsanstalt Wädenswil den Einsatz von DDT auf elf Insektenarten. Eine Diskussion in Politik und Medien war erst ein Jahr später, im Frühjahr 1971, in Gang gekommen. In der Schweiz war ab Januar 1972 die Verwendung in der Landwirtschaft nicht mehr zulässig. Mit Inkrafttreten des eidgenössischen Giftgesetzes am 1. April 1972 wurden dort auch alle anderen Anwendungen von DDT verboten. Die Regierung der Bundesrepublik Deutschland erklärte im Sommer 1971, sie beabsichtige, den Einsatz von DDT zu verbieten. Daraufhin wurde mit dem DDT-Gesetz ein Ausbringungsverbot ausgearbeitet und am 21. Juni 1972 verabschiedet (in Kraft ab 10. November 1972).[7] Herstellung und Vertrieb von DDT sind in der Bundesrepublik Deutschland seit dem 1. Juni 1977 verboten.[19] In Österreich wurde DDT in der Folgezeit nur noch wenig verwendet, aber erst 1992 verboten.[20]
Weitere Entwicklung und heutige Situation
[Bearbeiten | Quelltext bearbeiten]
In zahlreichen Entwicklungsländern, aber auch in den Staaten des Ostblocks, wurde DDT weiterhin hergestellt und verwendet. In der Land- und Forstwirtschaft der DDR hatte DDT ursprünglich eine viel größere Bedeutung als in Westdeutschland. Allerdings ging der DDT-Einsatz im Verlaufe der 1970er-Jahre auch hier stark zurück.[10] Zuletzt wurde es nur noch zum Beizen von Zwiebelsamen verwendet.[19]
DDT war in dem Holzschutzmittel Hylotox 59 enthalten, das in der DDR bis 1988 hergestellt wurde. Daher ist DDT in Gebäuden in Ostdeutschland noch häufig nachweisbar.[21] Es durfte übergangsweise noch bis zum 30. Juni 1991 eingesetzt werden. Heute gilt dieses Holzschutzmittel in Gebäuden generell als Gebäudeschadstoff.[22]
In Indien wurde der DDT-Einsatz in der Landwirtschaft im Mai 1989 verboten.[7] Zur Bekämpfung der Malaria ist es dort heute noch im Einsatz. Im Rahmen des bis 2007 laufenden Fünfjahresplans sollten 66.000 t DDT-Pulver (Wirkstoffgehalt 50 %) zur Bekämpfung von Malaria und Leishmaniose eingesetzt werden.[23] Die Wirksamkeit gegen Malariaüberträger wurde unter indischen Wissenschaftlern kontrovers diskutiert.[23][24]
Das Stockholmer Übereinkommen[25] vom Mai 2001, das im Mai 2004 in Kraft trat, beschränkt den Einsatz von DDT auf die Bekämpfung krankheitsübertragender Insekten (Vektoren). Außerdem durfte es bis zur Aufnahme des Akarizids Dicofol in das Stockholmer Übereinkommen 2019[26] als Ausgangsstoff für dessen Produktion hergestellt werden. Die Verwendung von DDT soll der WHO und dem Sekretariat des Stockholmer Übereinkommens mitgeteilt werden. Es gibt Hinweise darauf, dass 2007 mindestens 21 Staaten DDT einsetzten.[27] Die registrierten Staaten sollen alle drei Jahre über die eingesetzte Menge an DDT, ihre Verwendung und die Krankheitsbekämpfungsstrategie Bericht erstatten.
Im September 2006 hat der Direktor des „Global Malaria Program“ der WHO angekündigt, dass in Zukunft wieder verstärkt DDT eingesetzt werden solle.[28] Dadurch wurde für die folgenden Jahre mit einem etwas ansteigenden DDT-Verbrauch gerechnet[27], was aber nicht eintrat.[29] Ende 2020 hatten 18 Staaten die Verwendung von DDT zur Seuchenbekämpfung angezeigt.[30]
Es gibt gelegentlich Berichte über eine weiter andauernde Verwendung von DDT in der Landwirtschaft, etwa in Indien,[31] Nordkorea und möglicherweise in anderen Ländern.[32]
Indien plante, die Verwendung von DDT bis 2020 einzustellen.[33] Der weltweit letzte Hersteller, Hindustan Insecticides Limited (HIL), hat sich verpflichtet, die Produktion 2024 auslaufen zu lassen.[34]
Produktionsmengen
[Bearbeiten | Quelltext bearbeiten]Die Produktionszahlen von DDT sind nicht in allen Ländern durchgängig erhoben und veröffentlicht worden. Die USA waren lange Zeit der Hauptproduzent von DDT, dort wurden 1960 74.600 t hergestellt, 1970 waren es noch 26.900 t. Aus der Bundesrepublik sind nur die Produktionsdaten für 1965 bekannt, damals war sie mit 30.000 t der zweitgrößte DDT-Hersteller der Welt. In der UdSSR wurden in der zweiten Hälfte der 1960er-Jahre zwischen 15.000 und 25.000 t pro Jahr produziert, in Italien waren es 10.000 t jährlich. In den Staaten der EU wurden 1981 noch etwa 9.500 t hergestellt.[10]
Für 2005 wurde die Weltjahresproduktion von DDT auf 6.269 t Wirkstoff geschätzt, die sich auf Indien (4.250 t) und die Volksrepublik China aufteilten. Es wird vermutet, dass auch in Nordkorea etwa 300 t hergestellt wurden.[27] Die Produktion und der Einsatz von DDT in China wurden 2010 eingestellt. Als einziger bekannter Hersteller verbleibt die indische Hindustan Insecticides Ltd. (HIL), die in ihren Geschäftsjahren 2012/2013 3.872 t und 2013/2014 2.786 t DDT hergestellt hat. Davon wurden 287 t beziehungsweise 75 t exportiert.[29] Im Jahre 2020 stellte HIL 1.071 t DDT her.[34]
Herstellung
[Bearbeiten | Quelltext bearbeiten]
Beim klassischen Herstellungsverfahren für DDT reagierten Chloral und Chlorbenzol in konzentrierter Schwefelsäure zu DDT. Wenn ein Teil der Schwefelsäure durch Rauchende Schwefelsäure ersetzt wurde, konnte auch Chloralhydrat verwendet werden. Die Schwefelsäure nahm das bei der Reaktion entstehende Wasser auf. Das Reaktionsprodukt wurde gewaschen und in kochendem Wasser bei Zugabe von etwas Lauge geschmolzen, um anhaftende Säurereste zu beseitigen. Beim Abkühlen der Lösung fiel DDT in fester Form aus. Der Schmelzpunkt des technischen Gemisches lag bei etwa 90 °C. Durch Umkristallisation in Ethanol oder Propanol konnte DDT in Reinform gewonnen werden.[35]
In den USA wurde Mitte der 1940er-Jahre ein alternatives Herstellungsverfahren entwickelt, bei dem keine großen Mengen an Schwefelsäure notwendig waren. Dabei waren die Ausgangsstoffe Chloralhydrat und Chlorbenzol, statt Schwefelsäure wurde Chlorsulfonsäure eingesetzt. Das Chloralhydrat bildete mit der Chlorsulfonsäure als Zwischenprodukt Alkylsulfate. Die Sulfatreste wurden im nächsten Reaktionsschritt durch Chlorbenzol ersetzt. Gegen Ende des Verfahrens wurde Tetrachlorkohlenstoff als inertes Lösungsmittel zugegeben, damit das Reaktionsprodukt nicht verklumpte. Das Lösungsmittel wurde aus dem gewaschenen und neutralisierten Produkt mit Wasserdampfdestillation abgetrennt. Die Ausbeute bei diesem Verfahren lag bei 77 %, während sie mit Chloral und Schwefelsäure über 90 % erreichen konnte.[36]
Isomere und Metaboliten
[Bearbeiten | Quelltext bearbeiten]
Technisches DDT ist ein amorphes weißes Pulver, sein Schmelzpunkt liegt zwischen 80 und 94 °C.[3]
In technischem DDT ließen sich verschiedene Isomere und Nebenprodukte in unterschiedlichen Konzentrationen nachweisen:
| p,p′-DDT | o,p′-DDT[S 1] | p,p′-DDD | o,p′-DDD | p,p′-DDE | o,p′-DDE[S 2] | sonstige | Referenz |
|---|---|---|---|---|---|---|---|
| 77,1 | 14,9 | 0,3 | 0,1 | 4 | 0,1 | 3,5 | IPCS 1989[37] |
| 65–80 | 15–21 | ≤ 4 | ≤ 1,5 DDOH | UBA 1993[38] |
Die p,p′-Isomere werden häufig 4,4′-Isomere, die o,p′-Isomere 2,4′-Isomere genannt.
Hauptbestandteil von technischem DDT und im Wesentlichen für die insektizide Wirkung verantwortlich ist p,p′-DDT oder 1,1,1-Trichlor-2,2-bis(p-chlorphenyl)-ethan (CAS-Nr. 50-29-3). In der Praxis wird p,p′-DDT nicht in Reinform verwendet, sondern das technische Gemisch.
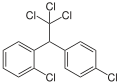
o,p′-DDT (CAS-Nr. 789-02-6) ist mit Anteilen von 15 bis 21 % die häufigste Verunreinigung in technischem DDT. Es trägt nur unwesentlich zur insektiziden Wirkung bei, hat jedoch eine relativ starke östrogene Wirkung.
Dichlordiphenyldichlorethen, 1,1-Dichlor-2,2-bis(p-chlorphenyl)ethen oder p,p′-DDE (CAS-Nr. 72-55-9) ist im technischen Gemisch mit etwa 4 % enthalten. Im menschlichen Körper wird p,p′-DDT hauptsächlich zu p,p′-DDE abgebaut. p,p′-DDE war im Wesentlichen für die Eierschalenverdünnung bei Greifvögeln verantwortlich.
2,4-DDE (CAS-Nr. 3424-82-6) hat nur einen Anteil von 0,1 % am technischen DDT. Es entsteht durch Abbau von o,p′-DDT.
Dichlordiphenyldichlorethan, 1,1-Dichlor-2,2-bis(p-chlorphenyl)ethan oder p,p′-DDD (CAS-Nr. 72-54-8) wurde durch Kondensation von Dichloracetaldehyd mit Chlorbenzol hergestellt und als Insektizid verwendet. Produktionszahlen sind nicht bekannt, es hatte keine große Bedeutung.[3] In den 1950er-Jahren wurde DDD zur Bekämpfung von Stechmückenlarven im Wasser des Clear Lake ausgebracht. Durch Biomagnifikation reicherte es sich in der Nahrungskette an und führte zum Zusammenbruch des Renntaucher-Bestands an diesem See.[9]
o,p′-DDD oder 1-Chlor-4-[2,2-dichlor-1-(2-chlorphenyl)ethyl]benzol (CAS-Nr. 53-19-0) ist im technischen DDT mit einem Anteil von etwa 0,1 % enthalten. Es wird in der Veterinärmedizin unter dem Wirkstoffnamen Mitotan zur Behandlung des Cushing-Syndroms bei Hunden eingesetzt, verliert jedoch aufgrund seiner toxischen Eigenschaften gegenüber moderneren Medikamenten zunehmend an Bedeutung.
-
p,p′-DDT
-
p,p′-DDE
-
p,p′-DDD
-
o,p′-DDT
-
o,p′-DDE
-
o,p′-DDD
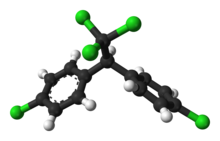
Die beiden Benzolringe im DDT-Molekül sind nicht coplanar, sondern gegeneinander verdreht.[39]
Analytik
[Bearbeiten | Quelltext bearbeiten]Zur Bestimmung des DDT-Gehalts wurde ab 1945 eine Variante der Schechter-Haller-Methode verwendet. Dabei wurde DDT aus den Proben herausgelöst und zu Polynitro-Derivaten nitriert, die nach Zugabe von Methylierungsmittel einen Farbstoff bildeten. Am Photometer konnte der Gehalt des Farbstoffs bestimmt und damit der DDT-Gehalt der Probe berechnet werden.[9] Die Methode wurde 1953 verbessert, so dass auch einige der DDT-Derivate damit quantifiziert werden konnten.
Etwa ab 1962 stand mit der Gaschromatographie ein sehr gutes Trennverfahren für DDT und seine Abbauprodukte zur Verfügung. Als Detektoren wurden dabei zunächst meist der Elektrochemische Detektor oder der Elektroneneinfangdetektor verwendet. Später wurde ein an den Gaschromatographen gekoppeltes Massenspektrometer zum bevorzugten Detektor.[40][41]
Wirkungsweise
[Bearbeiten | Quelltext bearbeiten]DDT wirkt hauptsächlich auf das zentrale Nervensystem. Bei niedrigen Dosierungen kommt es dabei zu Übererregbarkeit, bei hohen zur Lähmung. Die Steigerung der Erregbarkeit tritt zuerst bei den Motoneuronen des Gehirns auf, Spinalnerven sind erst bei höheren Konzentrationen betroffen.[42] Bei DDT-Einwirkung werden Nervenzellen angeregt, spontan zu „feuern“, wodurch Muskeln kontrahieren. Es kommt zu Tremores des Körpers und der Extremitäten, dem sogenannten „DDT-Jittern“. DDT führt über eine verstärkte Freisetzung von Neurotransmittern zu kleinen postsynaptischen Potentialen an den motorischen Endplatten, den Übergängen zwischen Nervensystem und Muskulatur. Dadurch werden Neurotransmitter „verbraucht“, was schließlich die Reizleitung unmöglich macht. Im Lauf einiger Stunden oder Tage führt DDT zu einer Lähmung und schließlich zum Tod des Insekts. Im Vergleich zu anderen Insektiziden tritt die Wirkung von DDT eher langsam ein, dabei wirkt es bei niedrigen Temperaturen stärker als bei hohen.
In der Membran der Nervenzellen von Insekten gibt es „Para“-Natriumkanäle, deren Namen auf ihre Lage im sogenannten Paralyse-Bereich auf dem X-Chromosom von Drosophila zurückgeht. Sie sind spannungsgesteuert und ermöglichen den Einstrom von Natrium-Ionen während der Depolarisation, also beim Auslösen eines Nervenimpulses. Während der anschließenden Repolarisation, dem Wiederaufbau der Ruhespannung, und im Ruhezustand müssen die Natriumkanäle geschlossen sein. DDT kann sich an die Natriumkanäle anlagern und verhindert ihr Verschließen. Die Anlagerungsstelle ist vermutlich ein langgestreckter hydrophober Hohlraum, das DDT-Molekül reicht nur in seinen oberen Teil hinein. Die Säure-Gruppe der rascher und in noch geringerer Dosis wirksamen Pyrethroide lagert sich im selben Bereich wie DDT an, ihre Alkohol-Gruppe reicht aber tiefer in den Hohlraum.[43]
Resistenz
[Bearbeiten | Quelltext bearbeiten]Ernsthafte Probleme mit DDT-Resistenzen traten erstmals 1946 bei Stallfliegen in Nordschweden auf. Als Gegenmaßnahme erhöhte die Geigy AG den Wirkstoffgehalt ihres Gesarol-Spritzmittels von 5 auf zunächst 10 %, einige Jahre später auf 50 %. Als 1949 an vielen Orten in der Schweiz resistente Fliegen auftraten, gingen die DDT-Umsätze spürbar zurück und Geigy beschleunigte die Entwicklung des als DDT-Nachfolger vorgesehenen Diazinon.[7][44]
Bereits 1953 waren der WHO Fälle von DDT-Resistenz bei malariaübertragenden Anopheles-Mücken bekannt. Um die Zeit für die Resistenzbildung zu verringern, sollte DDT während der „Angriffsphase“ des Global Eradication of Malaria Program jeweils nur einige Jahre eingesetzt werden. Dennoch traten damals unter anderem in El Salvador, Mexiko und Teilen Indiens resistente Anopheles-Mücken auf, wobei auch dem DDT-Einsatz in der Landwirtschaft eine Mitschuld zugeschrieben wird.[45]
Die häufigste Form der Resistenz, die „knockdown resistance“ (kdr), führt zu einer etwa 14-fach höheren Verträglichkeit für DDT, Pyrethrine und Pyrethroide. Sie geht auf eine Mutation am para-Natriumkanal zurück, die mittlerweile bei vielen Insektenarten gefunden wurde. Die bei Pyrethroiden wichtige „Super-kdr“-Resistenz ist für DDT von geringer Bedeutung.[43]
Der Einsatz von DDT und Pyrethroiden in der Landwirtschaft führte selbst dort zum Auftreten resistenter Mücken, wo DDT nie zur Malariabekämpfung eingesetzt wurde. Nach einem Bericht des UNEP aus dem Jahre 2007 wiesen in Afrika bei Stichproben 64 % der Bestände des dort wichtigsten Malaria-Überträgers Anopheles gambiae DDT-Resistenz auf, etwa ein Drittel davon war hochresistent. Auch in Äthiopien und Indien ist die DDT-Resistenz weit verbreitet.[27]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Die akute Giftigkeit von DDT für Menschen und Säugetiere ist im Vergleich zu anderen Organochlorpestiziden gering. Die höchste in der Literatur berichtete DDT-Dosis beim Menschen betrug 285 mg/kg Körpergewicht und wurde überlebt.[2][3] Der LD50 bei Ratten (oral) liegt bei etwa 250–300 mg/kg Körpergewicht.[19] Eine akute Vergiftung äußert sich vor allem in neurotoxischen (nervlichen) Wirkungen wie Zungentaubheit, Schwindel, Zuckungen der Gesichtsmuskulatur bis hin zu Krampfanfällen und Lähmungen.
Die biologische Halbwertszeit, also die Zeitspanne, die der Körper benötigt, bis die Hälfte des aufgenommenen DDT wieder abgebaut oder ausgeschieden wurde, beträgt beim Menschen über ein Jahr. Vom Menschen wird p,p′-DDT hauptsächlich zu p,p′-DDE abgebaut. o,p′-DDT wird schneller ausgeschieden als p,p′-DDT.[10]
Beim Menschen konnte ein möglicher Zusammenhang zwischen der DDT-Belastung und verminderten Spermienzahlen nicht eindeutig belegt werden.[10]
Der Zusammenhang zwischen der DDT-Exposition und verschiedenen Krebsarten beim Menschen wurde in zahllosen Studien untersucht. An Nagetieren konnte die kanzerogene Wirkung von technischem DDT, p,p′-DDT und p,p′-DDE zweifelsfrei nachgewiesen werden. Es ist noch unklar, inwieweit diese Ergebnisse auf den Menschen übertragbar sind.[3] Bei Langzeitstudien an Ratten, Mäusen und Hamstern bildeten sich die Tumoren in Leber, Lunge und dem Lymphsystem, nicht jedoch in der Brust oder in den Geschlechtsorganen. Die kanzerogene Wirkung ist möglicherweise auf die hormonelle Wirksamkeit zurückzuführen.[10] Die Internationale Agentur für Krebsforschung (IARC) der WHO stufte DDT im Jahr 2015 als „wahrscheinlich krebserregend bei Menschen“ (Gruppe 2A) ein.[46]
Eine gentoxische Wirkung beim Menschen konnte nicht eindeutig nachgewiesen werden. In einigen Studien wurden bei beruflich exponierten Personen Chromosomenaberrationen festgestellt. Sie waren jedoch auch anderen Pestiziden ausgesetzt und es ist unklar, ob weitere Risikofaktoren ausreichend berücksichtigt wurden. Laborversuche zur Feststellung einer gentoxischen Wirkung brachten widersprüchliche Ergebnisse.[3]
Eine Studie konnte einen Zusammenhang zwischen dem Auftreten vorzeitiger Wehentätigkeit bei 20 indischen Frauen und im Vergleich zur Kontrollgruppe erhöhten Konzentrationen von p,p′-DDE und p,p′-DDT in Blut und Plazentagewebe aufzeigen. Allerdings waren die Gehalte von Hexachlorbenzol, Lindan und Aldrin bei den Frauen mit vorzeitigen Wehen ebenfalls erhöht. Andere Untersuchungen lieferten Hinweise auf einen Zusammenhang zwischen erhöhten Konzentrationen von p,p′-DDT und dem Auftreten von Totgeburten oder zwischen der p,p′-DDE Belastung und einer verkürzten Stillperiode.[10] Erst 2014 konnte in einer Studie aufgezeigt werden, dass DDE möglicherweise an der Entstehung von Alzheimer beteiligt ist. Patienten mit Alzheimer hatten im Vergleich zu einer Kontrollgruppe einen 3,8-fach erhöhten DDE-Wert im Serum.[47]
Endokrine Wirkung
[Bearbeiten | Quelltext bearbeiten]DDT und einige seiner Abbauprodukte können als Endokrine Disruptoren wirken, also in Lebewesen ähnlich wie Hormone wirken oder natürliche Hormone hemmen.
Auf den Östrogen-Rezeptor wirkt DDT als Agonist, es lagert sich dort an und wirkt wie Östrogen. Die stärkste östrogene Wirkung hat o,p′-DDT, insbesondere das linksdrehende Enantiomer, gefolgt von o,p′-DDE. Die p,p′-Isomere von DDT und DDE haben so gut wie keine östrogene Wirkung.
Am Androgenrezeptor verhindern DDT und seine Abbauprodukte die Anlagerung körpereigener Androgene, wirken aber selbst nicht androgen. Diese Wirkung als Androgen-Antagonist ist bei p,p′-DDE stärker ausgeprägt als bei p,p′-DDT und o,p′-DDT. Natürliche Hormone binden erheblich stärker (Faktor 103 bis 106) an Östrogen- und Androgenrezeptoren als DDT oder DDE.[10]
Die endokrine Wirkung von DDT und Derivaten gilt heute als Ursache von Reproduktionsstörungen unterschiedlicher Art, die bei Lebewesen aus verschiedenen Tierklassen auftraten. Die bekannteste davon ist die Eischalenverdünnung bei Vögeln.
Exposition des Menschen
[Bearbeiten | Quelltext bearbeiten]
In den Anfangsjahren schienen keine besonderen Arbeitsschutz-Maßnahmen beim Umgang mit dem Endprodukt notwendig. Bei Arbeitern in der DDT-Produktion wurden sehr hohe DDT-Gehalte im Blut und Körpergewebe festgestellt. Da keine schädlichen Auswirkungen beobachtet wurden, galt das als Hinweis auf die Ungefährlichkeit von DDT.[7]
In den westlichen Ländern wird DDT heute hauptsächlich über Lebensmittel tierischer Herkunft aufgenommen. Bis vor wenigen Jahren waren auch Rückstände von Pflanzenschutzmitteln in importierten Lebensmitteln eine mögliche Quelle.
In Deutschland fand man bei Untersuchungen Ende der 1990er-Jahre, dass im Blutserum p,p′-DDT und sein Abbauprodukt p,p′-DDE etwa im Verhältnis 1:9 vorkamen. Anfang der 1970er-Jahre war der DDT-Anteil im Serum höher, das Verhältnis lag bei bis zu 3:1. Ein im Vergleich zum DDE hoher DDT-Anteil im Blutserum deutet auf eine kurz zurückliegende Aufnahme hin, wie sie in Ländern der Dritten Welt noch vorkommen kann. Die o,p′-Isomere werden im Körper schneller abgebaut und machen nur 1 % des Gesamt-DDT im Blutserum aus.
Anfang der 1990er-Jahre betrug der mittlere p,p′-DDE-Gehalt des Serums in der Altersgruppe von 21–30 Jahren 1,5 µg/l, wogegen bei der Altersgruppe von 51–60 Jahren 3,3 µg/l gefunden wurden (alte Bundesländer).
Die mittlere Gesamt-DDT-Belastung der Muttermilch in (West-)Deutschland ging zwischen 1980 und 1994 von etwa 1910 µg/kg Fett auf 367 µg/kg Fett zurück. In den neuen Bundesländern lag sie hingegen 1990 noch bei etwa 2250 µg/kg Fett. In den USA fand man 1955 im Mittel noch 15 mg DDT/kg Fettgewebe, bis 1980 war dieser Wert auf 5 mg/kg gesunken. Ende der 1980er-Jahre waren die Fettgewebe-Konzentrationen in den USA, Kanada und Europa auf etwa 1 mg/kg zurückgegangen.
Bei Säuglingen unterscheiden sich die Gesamt-DDT-Gehalte nicht von denen der Erwachsenen. Kinder nehmen DDT-Isomere bereits über die Plazenta, später über die Muttermilch auf.
In Ländern, in denen DDT bis vor kurzem eingesetzt wurde oder heute noch wird, sind die DDT-Gehalte in Blut, Muttermilch und Fettgewebe deutlich höher. Besonders hoch war die Belastung bei Arbeitern in der DDT-Produktion. Mitte der 1960er-Jahre wurden bei ihnen Gesamt-DDT-Gehalte zwischen 38 und 647 mg/kg Fettgewebe und etwa 350 bis 740 µg/kg Serum gefunden.[10]
Umweltverhalten und Ökotoxikologie
[Bearbeiten | Quelltext bearbeiten]Umweltverhalten
[Bearbeiten | Quelltext bearbeiten]
DDT wird in der Natur nur langsam abgebaut, zudem beginnt sein Abbau in der Regel mit der Umwandlung in die ebenfalls sehr langlebigen Verbindungen DDE und DDD.
Im Boden adsorbieren DDT, DDD und DDE stark an organischen Bodenbestandteilen und Tonmineralen. Sie gelangen daher kaum ins Grundwasser, können aber bei starken Niederschlägen mit abgespülter Erde in Gewässer eingetragen werden. Im Lauf der Jahre diffundieren sie auch in die Mikroporen des Bodens, wo sie für einen mikrobiellen Abbau nicht verfügbar sind. DDT und seine Umwandlungsprodukte können von einer ganzen Reihe von Bakterien und Pilzen abgebaut werden. Wenn Sauerstoff zur Verfügung steht, entsteht im ersten Schritt vor allem DDE, unter reduzierenden Bedingungen überwiegt der Abbau zu DDD. Die Abbaugeschwindigkeit ist von der Aktivität des Bodenlebens abhängig, sie steigt bei höheren Temperaturen sowie guter Nährstoff- und Wasserversorgung. Aus dem Boden können DDT und seine Umwandlungsprodukte sich in die Atmosphäre verflüchtigen, was durch hohe Temperaturen und Überschwemmung des Bodens begünstigt wird. Beim Ermitteln der Halbwertszeit von DDT in Böden wurden früher alle Austragswege als „Abbau“ erfasst. Teilweise wurde nur das insektizid wirksame p,p′-DDT betrachtet, ohne die hohe Persistenz der Abbauprodukte zu berücksichtigen. In den Tropen „verschwindet“ ausgebrachtes DDT schneller aus dem Boden als in kühleren Klimaten. Bei einer in den 1980er-Jahren durchgeführten Untersuchung lag die Halbwertszeit – bezogen auf Gesamt-DDT – in tropischen und subtropischen Ländern bei 22 bis 365 Tagen. Im Vergleich dazu wurden in gemäßigten Klimazonen Halbwertszeiten von 837 bis 6087 Tagen (16,7 Jahre) gefunden.
In der Atmosphäre liegt DDT je zur Hälfte in der Gasphase und partikelgebunden vor. Das DDT in der Gasphase wird vor allem durch Hydroxyl-Radikale mit einer Halbwertszeit von etwa 37 Stunden abgebaut. Partikelgebundenes DDT unterliegt diesem Abbau nicht und kann in der Atmosphäre über große Entfernungen transportiert werden. Der größte Teil des atmosphärischen DDT wird vermutlich durch Niederschläge ausgewaschen.
An der Oberfläche von Gewässern kann DDE durch Photolyse innerhalb weniger Tage zersetzt werden, DDT und DDD werden auf diese Weise nur sehr langsam abgebaut. Ein biologischer Abbau findet im freien Wasser kaum statt. Durch Hydrolyse wird DDT zu DDE abgebaut; diese Reaktion wird durch basisches Milieu begünstigt.
Aufgrund der lipophilen Eigenschaften von DDT, DDE und DDD (log KOW: 6,36, 5,70 und 5,50[48]) reichern sich diese über die Nahrungskette im Fettgewebe von Mensch und Tier an (Bioakkumulation). Für Fische werden Biokonzentrationsfaktoren von 12.000 (Regenbogenforelle) bis 100.000 angegeben, für Muscheln 4.550 bis 690.000 und für Schnecken 36.000. Fische nehmen DDT sowohl direkt aus dem Wasser als auch mit der Nahrung auf. Wandernde Fischschwärme können DDT aus stark belasteten Gewässern in ursprünglich wenig belastete Regionen verschleppen.[3]
DDT ist eine der Verbindungen, die sich an die Oberfläche des im Ozean treibenden Plastikmülls anlagern.[49]
Vögel
[Bearbeiten | Quelltext bearbeiten]DDT und sein Metabolit DDE reichern sich über die Nahrungskette stark an, die höchsten DDE-Kontaminationen wurden daher bei vogel- und fischfressenden Greifvögeln festgestellt.[50] Bei einigen Vogelarten führt DDE zu einer Eischalenverdünnung. Im Tierexperiment erwiesen sich Hühnervögel und Wachteln als unempfindlich gegen die durch DDT-Metaboliten verursachte Eierschalenverdünnung. Enten und Tauben waren mäßig, viele Greifvögel jedoch sehr empfindlich.
Von Vögeln wird o,p′-DDT rasch metabolisiert und ausgeschieden, während p,p′-DDT nur langsam zu DDE abgebaut wird.[10]


Ein großräumiger katastrophaler Bestandsrückgang des Wanderfalken wurde 1961 in Großbritannien entdeckt. Bei einer Zählung im Jahr 1962 wurde ein Bestandsrückgang von 44 % für das ganze Land gegenüber dem mittleren Bestand der Jahre 1930–39 festgestellt.[51] Im Süden Englands war die Art völlig verschwunden, in Wales und in Nordengland war der Bestand stark zurückgegangen und nur in den Schottischen Highlands war der Bestandsrückgang relativ gering. Unabhängig davon waren ab 1951 gehäuft zerbrochene Eier in Wanderfalkennestern gefunden worden, was vorher praktisch unbekannt war. Nach der Entdeckung des Bestandseinbruches wurden ältere Eischalen des Wanderfalken aus Eiersammlungen in Museen und bei Sammlern untersucht und ein schlagartiger Rückgang der Eischalendicke um im Mittel etwa 20 % ab 1947 festgestellt. Ähnliche Verringerungen der Eischalendicke wurden in Großbritannien auch bei Sperber und Merlin gefunden.[52]
Katastrophale Bestandseinbrüche und ein erheblicher Rückgang der Eischalendicke nach 1950 wurden gleichzeitig oder nur wenig später in weiten Teilen der nördlichen Hemisphäre verzeichnet. In Europa starb der Wanderfalke in Dänemark, den Niederlanden, Belgien, Luxemburg und der DDR bis Ende der 1970er-Jahre aus, die Bestände in Skandinavien, der damaligen BRD, der Schweiz, Österreich und Polen gingen bis auf wenige Paare zurück. Die Baumbrüterpopulation Mittel- und Osteuropas starb vollständig aus. In den USA verschwand der Wanderfalke aus allen Bundesstaaten östlich der Rocky Mountains.
Der plötzliche Rückgang der Eischalendicke nach 1946 trat zu der Zeit auf, als DDT in der Land- und Forstwirtschaft erstmals großflächig angewendet wurde. Ende der 1960er-Jahre wurde festgestellt, dass der Gehalt des DDT-Metaboliten DDE in den Eiern mit der Eischalendicke negativ korreliert. Eine Abnahme der Eischalendicke um 17 % war mit einem DDE-Gehalt von 15–20 ppm DDE bezogen auf das Frischgewicht des Eiinhalts verbunden. Wanderfalkenpopulationen, deren durchschnittliche Eischalendicken um 17 % oder mehr verringert waren, gingen stark zurück oder starben aus.[53]
Bereits 1958 wurde berichtet, dass Weißkopfseeadler in den USA kaum noch Junge aufziehen würden. Ähnliche Effekte traten Anfang der 1970er-Jahre bei Kormoranen an den Großen Seen in Kanada auf. Hier war der Bestand auf 100 Brutpaare zurückgegangen. Die Eischalendicke war im Vergleich zu Eiern, die vor 1945 gesammelt worden waren, um mehr als 20 % verringert. Der durchschnittliche DDE-Gehalt der Kormoraneier lag 1972 bei 22,4 mg/kg Frischgewicht. Auch bei Sperbern auf den Britischen Inseln, Weißkopfseeadlern an den Großen Seen und Fischadlern in Südschweden konnten die Probleme bei der Jungenaufzucht auf DDT oder seine Abbauprodukte zurückgeführt werden. Anderen Umweltschadstoffen wie PCB, Quecksilber, Dioxinen, Chlordan und Dieldrin waren die Vögel zu jener Zeit ebenfalls ausgesetzt. Die jeweilige DDE-Belastung ergab bei der statistischen Auswertung der Ergebnisse stets die beste Erklärung für die Eierschalendicke bzw. den ausbleibenden Bruterfolg.
Über welchen Mechanismus der Rückgang der Eischalendicke zustande kommt, ist noch nicht zweifelsfrei geklärt. Diskutiert wird beispielsweise eine Störung der Calcium-Einlagerung in der Eischale über eine Hemmung der Calcium-ATPase und der Carboanhydrase. Die Synthese des Hormons Prostaglandin, das auch für den Hydrogencarbonat-Transport verantwortlich ist, wird ebenfalls beeinflusst. Es gibt Hinweise, dass DDE ähnlich wie Progesteron (progesteron-mimetisch) den Eisprung hemmt und eine Erhöhung des Avidingehalts im Eileiter bewirkt.
Im Süden Kaliforniens waren in den 1950er- und 1960er-Jahren DDT-haltige Abwässer einer Fabrik ins Meer gelangt. Bei den dort lebenden Westmöwen (L. occidentalis) war das Geschlechterverhältnis hin zu den Weibchen verschoben. Der Anteil von Weibchen-Weibchen-Paaren war mit 10 % der Brutpaare deutlich erhöht. In den Nestern lagen ungewöhnlich viele Eier, die aber zum Teil nicht befruchtet worden waren. Hierfür wurde eine Feminisierung männlicher Vogel-Embryonen durch die östrogene Wirkung von o,p′-DDT verantwortlich gemacht.
Die Gesamt-DDT-Gehalte im Gewebe von Vögeln gingen zwischen den frühen 1970er- und den 1980er-Jahren auf der Nordhalbkugel zurück, der relative Anteil des Hauptmetaboliten DDE nahm dabei zu. Seit Anfang der 1990er-Jahre bleiben die DDT-Gehalte mehr oder weniger konstant, allerdings auf niedrigem Niveau.[10]
Säugetiere
[Bearbeiten | Quelltext bearbeiten]Junge Kegelrobben aus Nordsee und Nordatlantik hatten in den 1980er-Jahren 1,2–2,5 mg Gesamt-DDT/kg Fett. Für Kegelrobben-Junge aus der Ostsee lagen die Gesamt-DDT-Konzentrationen etwa um den Faktor 20 höher. Die Anzahl der Robben an der Ostsee ging zurück, die Neugeborenen hatten eine höhere Sterblichkeit, es traten Läsionen des Schädelknochens und Verschluss des Uterus auf. Alle Kegelrobben waren zugleich mit PCB belastet, die PCB-Konzentrationen waren etwa doppelt so hoch wie die DDT-Konzentrationen.
Beim Florida-Panther konnten in den 1990ern Reproduktionsstörungen (verringerte Spermienzahl, Spermienanomalien, Hodenhochstand) auf seine hohe Exposition mit dem antiandrogen wirksamen p,p′-DDE (5–60 mg/kg Leber) zurückgeführt werden. Ein Einfluss östrogener Substanzen wie PCB (7–26 mg/kg Leber) sowie von Inzucht konnte nicht ausgeschlossen werden.[10] Die LD50 für Säugetiere liegt im Bereich von 0,1–0,5 g DDT/kg Körpergewicht. Bei Versuchen zur Langzeitwirkung von DDT traten beim Kaninchen schädliche Wirkungen bei einer täglichen Aufnahme von mehr als 0,184 mg DDT/kg KG (NOAEL) auf.
Andere Tierklassen
[Bearbeiten | Quelltext bearbeiten]Bei Reptilien kann die Geschlechtsdetermination durch äußere Faktoren, teilweise auch durch endokrin wirksame Substanzen, beeinflusst werden.

In den Lake Apopka in Florida gelangten nach einem Chemieunfall 1980 Dicofol, DDT, DDD, DDE und Schwefelsäure. Innerhalb der folgenden vier Jahre ging dort der Bestand des Hechtalligators (Alligator mississippiensis) um 90 % zurück. Die Sterblichkeit der erwachsenen Tiere war deutlich, die der Jungtiere drastisch höher als bei einer Kontrollpopulation. Das Geschlechterverhältnis war zu den Weibchen hin verschoben und man fand Veränderungen im Hormonspiegel und an den Geschlechtsorganen der Alligatoren. Im Labor konnte mit DDE an Eiern des Hechtalligators eine geschlechtliche Umwandlung oder Intersexualität ausgelöst werden. Bei Schnappschildkröten (Chelydra serpentina) in Kanada fand man einen reduzierten Sexualdimorphismus, der vermutlich mit der Belastung durch p,p′-DDE oder PCB im Zusammenhang steht.
Auch bei Amphibien und Krebstieren können Fremdstoffe zu endokrinen Störungen führen. Ob auch DDT und seine Derivate bei diesen Tierklassen eine solche Wirkung zeigen ist noch ungeklärt.
Fische können DDT nur langsam abbauen, bei ihnen wurden p,p′-DDE und p,p′-DDD als Metaboliten nachgewiesen. Bei einigen Fischen (Ostsee-Kabeljau) war seit den 1970er-Jahren ein Rückgang der Belastung zu beobachten, bei anderen (Ostsee-Hering, Nordsee-Kliesche) ist kein Trend zu erkennen. Bei In-vivo-Untersuchungen wurden bei Fischen durch DDT und seine Derivate östrogene Wirkungen ausgelöst; diese Ergebnisse konnten in vitro bestätigt werden. Diese Effekte sind sehr stark von der jeweiligen Fischart und ihrem Entwicklungsstadium abhängig und schwer auf andere Arten übertragbar.
Bei Insekten gibt es neben der akuten Toxizität auch Hinweise auf endokrine Wirksamkeit. Bei Nymphen der Wanze Rhodius prolixus war nach Exposition mit DDT die Häutungsfrequenz erhöht, bei den Imagines verkürzte sich die Zeitdauer bis zur Eiablage. In vitro konnte bei dem Schmetterling Heliothis zea die kompetitive Bindung von DDT und Juvenilhormon an ein Fettkörperprotein gezeigt werden.[10]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Verbraucherinformationssystem Bayern: DDT – Dichlordiphenyltrichlorethan
- Stockholmer Übereinkommen: Overview – Dichloro-diphenyl-trichloroethane (DDT) (engl.)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu DDT. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. April 2014.
- ↑ a b c d e f g h Eintrag zu 4,4´-DDT in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c d e f g h U.S. Department of Health and Human Services, Agency for Toxic Substances and Disease Registry: Toxicological profile for DDT, DDE and DDD. (PDF; 5,6 MB), 2002.
- ↑ Eintrag zu Clofenotane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Lukas Straumann: Nützliche Schädlinge. Chronos Verlag, Zürich, 2005, ISBN 3-0340-0695-0, S. 236–245.
- ↑ David Kinkela: DDT and the American century. The University of North Carolina Press, Chapel Hill, 2011, S. 12–14.
- ↑ a b c d e f g h i Christian Simon: DDT – Kulturgeschichte einer chemischen Verbindung. Christoph Merian Verlag, Basel, 1999, ISBN 3-85616-114-7.
- ↑ Charles M. Wheeler: Control of Typhus in Italy 1943/1944 by Use of DDT. American Journal of Public Health, Feb. 1946, Vol. 36, S. 119–129; PMC 1626020 (freier Volltext).
- ↑ a b c d e f g h i Thomas R. Dunlap: DDT: Scientists, Citizens and Public Policy. Princeton University Press, 1981, ISBN 0-691-04680-8.
- ↑ a b c d e f g h i j k l m n o Beratergremium für Altstoffe der Gesellschaft Deutscher Chemiker: DDT und Derivate – Modellstoffe zur Beschreibung endokriner Wirkungen mit Relevanz für die Reproduktion. BUA-Stoffbericht 216, S. Hirzel Verlag, August 1998, ISBN 3-7776-0961-7.
- ↑ Lukas Straumann: Nützliche Schädlinge. Chronos Verlag, Zürich, 2005, ISBN 3-0340-0695-0, S. 288–296.
- ↑ Marc Marx, Juliane Ackermann, Simone Schmidt, Jens Utermann, Bernd M. Bussian: Occurrence and Spatial Distribution of Selected Organic Substances in Germany’s Forest Soils. In: Status and Dynamics of Forests in Germany. Band 237. Springer International Publishing, Cham 2019, ISBN 978-3-03015732-6, S. 231–259, doi:10.1007/978-3-030-15734-0_8.
- ↑ Bernhard Aichner, Bernd Bussian, Petra Lehnik-Habrink, Sebastian Hein: Levels and Spatial Distribution of Persistent Organic Pollutants in the Environment: A Case Study of German Forest Soils. In: Environmental Science & Technology. Band 47, Nr. 22, 19. November 2013, S. 12703–12714, doi:10.1021/es4019833 (researchgate.net).
- ↑ WHO: WHO gives indoor use of DDT a clean bill of health for controlling malaria. Pressemitteilung vom 15. September 2006.
- ↑ Sweeney, Edmund M, Consolidated DDT hearing: hearing examiner's recommended findings, conclusions, and orders, Environmental Protection Agency, April 25 1972; (Auszüge) (vollständiges Dokument, 56 MB) ( vom 11. Mai 2012 im Internet Archive).
- ↑ Environmental Protection Agency: Consolidated DDT Hearings: Opinion and Order of Administrator. June 30, 1972 (PDF, 1,7 MB).
- ↑ Website der United States Environmental Protection Agency: DDT Regulatory History: A Brief Survey (to 1975).
- ↑ David Kinkela: DDT and the American century, The University of North Carolina Press, Chapel Hill, 2011, S. 179–180.
- ↑ a b c Werner Perkow: „Wirksubstanzen der Pflanzenschutz- und Schädlingsbekämpfungsmittel“. 2. Auflage, Verlag Paul Parey.
- ↑ Greenpeace Österreich: Chlorpestizide und PCBs ( vom 16. November 2012 im Internet Archive) (PDF; 24 kB).
- ↑ Informationsblatt Hylotox 59 – DDT und Lindan in Innenräumen. In: www.lagus.mv-regierung.de. Landesamt für Gesundheit und Soziales Mecklenburg-Vorpommern, abgerufen am 16. Mai 2016.
- ↑ Schadstoffbelastete bauliche und technische Anlagen – Abbruch-, Sanierungs- und Instandhaltungsarbeiten. In: Verein Deutscher Ingenieure VDI / Gesamtverband Schadstoffsanierung (Hrsg.): VDI-Richtlinien. VDI/GVSS 6202 Blatt 1, Oktober 2013.
- ↑ a b V.P. Sharma: DDT: The fallen angel. ( vom 17. Dezember 2004 im Internet Archive) (PDF; 74 kB). 2003, Current Science, 85, 11, 1532–1537.
- ↑ K. Gunasekaran, S. S. Sahu, P. Jambulingam, P. K. Das: DDT indoor residual spray, still an effective tool to control Anopheles fluviatilis-transmitted Plasmodium falciparum malaria in India. 2005, Tropical Medicine & International Health 10 (2), 160–168; doi:10.1111/j.1365-3156.2004.01369.x.
- ↑ POPs-Konvention (2004) ( vom 26. Oktober 2012 im Internet Archive) (PDF; 220 kB).
- ↑ 2019 Meetings of the Conferences of the Parties to the Basel, Rotterdam and Stockholm Conventions. Highlights and images for 29 April 2019. In: Earth Negotiations Bulletin. 29. April 2019, abgerufen am 22. Februar 2023 (englisch).
- ↑ a b c d United Nations Environment Programme: Report of the expert group on the assessment of the production and use of DDT and its alternatives for disease vector control. ( vom 14. Mai 2012 im Internet Archive) (PDF; 85 kB) Third Meeting, Dakar, 30. April bis 4. Mai 2007.
- ↑ Arata Kochi: „Help save African babies as you are helping to save the environment.“ 15. September 2006.
- ↑ a b United Nations Environment Programme: Report of the DDT expert group on the assessment of the production and use of DDT and its alternatives for disease vector control. 12. November 2014.
- ↑ Provisional DDT register pursuant to paragraph 1 of part II of annex B of the Stockholm Convention. Secretariat of the Stockholm Convention, abgerufen am 20. Dezember 2020.
- ↑ Concern over excessive DDT use in Jiribam fields. The Imphal Free Press, 5. Mai 2008, archiviert vom am 6. Dezember 2008; abgerufen am 20. Dezember 2020 (englisch).
- ↑ Henk van den Berg, Sekretariat des Stockholmer Übereinkommens: Global status of DDT and its alternatives for use in vector control to prevent disease. (PDF; 288 kB) Stockholmer Übereinkommen/United Nations Environment Programme, 23. Oktober 2008, archiviert vom am 17. Dezember 2008; abgerufen am 22. November 2008 (englisch).
- ↑ Deccan Herald: India-United Nations pact to end DDT use by 2020, 26. August 2015.
- ↑ a b Alternatives to DDT. UN environmental programme, abgerufen am 13. April 2023 (englisch).
- ↑ S. F. Darling: The Laboratory Preparation of DDT. J. Chem. Education, 22, S. 170, 1945, doi:10.1021/ed022p170.
- ↑ Walter H. C. Rueggberg, David J. Torrans: Production of DDT… Condensing Action of Chlorosulfonic Acid on Chloral Hydrate and Chlorobenzene. Industrial and Engineering Chemistry, S. 211–214, Februar 1946, doi:10.1021/ie50434a026.
- ↑ Environmental Health Criteria (EHC) für DDT and its derivates, abgerufen am 9. Dezember 2014.
- ↑ Umweltbundesamt: Aktualisierte Fortschreibung des Stoffberichts 56 (DDT). Ufoplan 103 40 113, September 1993.
- ↑ T. P. DeLacy, C. H. L. Kennard: Insecticides. Part II. Crystal structures of 1,1-bis-(p-chlorophenyl)-2,2,2-trichloroethane (p,p′-DDT) and 1-(o-chlorophenyl)-1-(p-chlorophenyl)-2,2,2-trichloroethane (o,p′-DDT). In: Journal of the Chemical Society, Perkin Transactions 2. 1972, S. 2148–2153, doi:10.1039/P29720002148.
- ↑ WHO (INCHEM): DDT and its Derivatives. Environmental Health Criteria 9, Genf 1979, ISBN 92-4-154069-9.
- ↑ D. G. Hayward, J. W. Wong, H. Y. Park: Determinations for Pesticides on Black, Green, Oolong, and White Teas by Gas Chromatography Triple-Quadrupole Mass Spectrometry. In: Journal of Agricultural and Food Chemistry. Band 63, Nummer 37, 2015, S. 8116–8124, doi:10.1021/acs.jafc.5b02860, PMID 26209005.
- ↑ Forth, Henschler, Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. BI-Wiss.-Verl., 1992, ISBN 3-411-15026-2.
- ↑ a b T.G.E. Davies, L.M. Field, P.N.R. Usherwood, M.S. Williamson: DDT, Pyrethrins, Pyrethroids and Insect Sodium Channels. IUBMB Life 59(3), März 2007, S. 151–162.
- ↑ Lukas Straumann: Nützliche Schädlinge. Chronos Verlag, Zürich, 2005, ISBN 3-0340-0695-0, S. 261–263.
- ↑ G. Chapin, R. Wasserstrom: Agricultural production and malaria resurgence in Central America and India. Nature 293, 17. September 1981, S. 181–185.
- ↑ IARC Monographs evaluate DDT, lindane, and 2,4-D, 23. Juni 2015.
- ↑ Jason R. Richardson, Ananya Roy, Stuart L. Shalat et al.: Elevated Serum Pesticide Levels and Risk for Alzheimer Disease. JAMA Neurol., 27. Januar 2014. doi:10.1001/jamaneurol.2013.6030.
- ↑ Rene P. Schwarzenbach, Philip M. Gschwend, Dieter M. Imboden: Environmental Organic Chemistry. Wiley-Interscience, Hoboken, New Jersey 2003, ISBN 0-471-35750-2.
- ↑ E. L. Teuten, J. M. Saquing u. a.: Transport and release of chemicals from plastics to the environment and to wildlife. In: Philosophical Transactions of the Royal Society B: Biological Sciences. 364, 2009, S. 2027–2045, doi:10.1098/rstb.2008.0284.
- ↑ z. B. B. Conrad: Zur Situation der Pestizidbelastung bei Greifvögeln und Eulen in der Bundesrepublik Deutschland. In: Greifvögel und Pestizide. Ökologie der Vögel 3, 1981, Sonderheft: S. 161–167.
- ↑ D. A. Ratcliffe: The status of the Peregrine in Great Britain. Bird Study 10, 1963, S. 56–90.
- ↑ D. A. Ratcliffe: Decrease in eggshell weight in certain birds of prey. Nature 215, 1967, S. 208–210.
- ↑ D. B. Peakall, L. F. Kiff: DDE contamination in Peregrines and American Kestrels and its effect on reproduction. In: Cade et al. 1988, S. 337–351.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu o,p′-DDT: CAS-Nr.: 789-02-6, EG-Nr.: 212-332-5, ECHA-InfoCard: 100.011.211, GESTIS: 107242, PubChem: 13089, ChemSpider: 12543, Wikidata: Q27115760.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu o,p′-DDE: CAS-Nr.: 3424-82-6, EG-Nr.: 222-318-0, ECHA-InfoCard: 100.020.290, PubChem: 246598, ChemSpider: 215802, Wikidata: Q27115908.
- ATC-P03
- Giftiger Stoff bei Verschlucken
- Giftiger Stoff bei Hautkontakt
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Wikipedia:Lesenswert
- Diphenylmethan
- Chlorbenzol
- Trichlormethylverbindung
- Insektizid
- Biozid (Wirkstoff)
- Pflanzenschutzmittel (Wirkstoff)
- Arzneistoff
- Persistenter organischer Schadstoff nach Stockholmer Übereinkommen
- Persistenter organischer Schadstoff nach dem Übereinkommen über weiträumige grenzüberschreitende Luftverunreinigung
- Gefährliche Chemikalie nach dem Rotterdamer Übereinkommen