Caesiumbromid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Cs+ _ Br− | ||||||||||||||||
| Kristallsystem |
kubisch | |||||||||||||||
| Raumgruppe |
Pm3m (Nr. 221) | |||||||||||||||
| Gitterparameter |
a = 4,2953 Å | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Caesiumbromid | |||||||||||||||
| Verhältnisformel | CsBr | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 212,809 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,44 g·cm−3 [1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1300 °C[2] | |||||||||||||||
| Löslichkeit |
1230 g·l−1 in Wasser bei 25 °C[3], gut in Ethanol, unlöslich in Aceton[4] | |||||||||||||||
| Brechungsindex |
1,6974[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−406 kJ/mol[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Caesiumbromid ist das Caesiumsalz der Bromwasserstoffsäure.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Caesiumbromid kann durch Salzbildungsreaktion mit Bromwasserstoffsäure aus Caesiumhydroxid oder auch Caesiumcarbonat hergestellt werden:
Eigenschaften
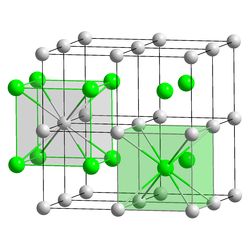
[Bearbeiten | Quelltext bearbeiten]Caesiumbromid bildet farblose, kubische Kristalle und ist gut wasserlöslich. Es weist eine rotviolette Flammenfärbung auf. Es ist auch in niederen Alkoholen löslich. Wie Caesiumchlorid und Caesiumiodid kristallisiert es in der kubischen Caesiumchloridstruktur in der Raumgruppe Pm3m (Raumgruppen-Nr. 221) mit dem Gitterparameter a = 4,2953 Å.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Aus Caesiumbromidkristallen werden Fenster und Prismen für die IR- und FIR-Spektroskopie[7] sowie für Szintillationszähler[4] hergestellt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Caesiumbromid bei Sigma-Aldrich, abgerufen am 12. Oktober 2016 (PDF).
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1281.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-57.
- ↑ a b c G. W. A. Milne: Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and … John Wiley & Sons, 2005, ISBN 978-0-471-73518-2, S. 122 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-246.
- ↑ a b Datenblatt Caesiumbromid bei Sigma-Aldrich, abgerufen am 15. März 2011 (PDF).
- ↑ a b Korth Kristalle: Caesiumbromid ( vom 21. September 2012 im Internet Archive), abgerufen am 12. Oktober 2010.


