1,4-Benzochinon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,4-Benzochinon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H4O2 | |||||||||||||||
| Kurzbeschreibung |
gelbbrauner Feststoff mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 108,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,32 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (10 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
1,4-Benzochinon, häufig vereinfachend Chinon bzw. Benzochinon genannt, ist der Stammkörper der (para)-Chinone. Es bildet gelbe Kristalle von charakteristischem, durchdringendem Geruch. 1,4-Benzochinon entsteht bei der Oxidation von Hydrochinon und als Stoffwechselprodukt im Menschen bei Benzolvergiftung.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Bei Studien über die Chemie der aus Chinarinde isolierten Chinasäure beobachtete der russische Chemiker Alexander Abramowitsch Woskressenski, dass bei der Oxidation mit Mangandioxid (Braunstein) in Schwefelsäure eine gelbe, stechend riechende Substanz gebildet wird, der er den Namen „Chinoyl“ gab.[5]
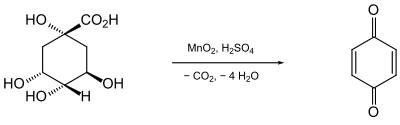
Da die Endung -yl für einen Rest (Radikal) stehen sollte, benannte Friedrich Wöhler die Verbindung um in „Chinon“.[6]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Natürlich kommt 1,4-Benzochinon in Gerste und in Anis vor.[7]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Oxidation von Hydrochinon in schwefelsaurer Lösung mit Natriumchlorat (und Vanadiumpentoxid als Katalysator)[8] oder mit Natriumdichromat[9] ist mit hoher Ausbeute möglich.
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]p-Benzochinon ist blutschädigend und steht im Verdacht Leukämie zu erzeugen. Es reagiert schnell mit Biomakromolekülen wie Proteinen und DNA. Das Addukt mit Albumin kann in breiten Bevölkerungsschichten nachgewiesen werden, und dieser Biomarker für Chinon (und damit auch für Benzol) korreliert mit Automobilbetankung, Zigarettenkonsum, aber auch mit Fruchtkonsum und Verwendung von Aspartam.[10] Das zur Abwehr von Fressfeinden dienende Wehrsekret der Bombardierkäfer enthält 1,4-Benzochinon. Bombardierkäfer[11] und Weberknechte[12] besitzen die Fähigkeit, in Drüsen 1,4-Benzochinon herzustellen.
Auch einige Arten von Tausendfüßern stellen Benzochinon zur Abwehr von Fressfeinden her. Auf Madagaskar und in Südamerika konnte in diesem Zusammenhang eine ungewöhnliche Beobachtung gemacht werden: Madagassische Lemuren und südamerikanische Kapuzineraffen fangen und reizen die Tausendfüßler, sodass diese ihr benzochinonhaltiges Sekret absondern. Dieses verteilen die Affen wiederum auf ihrem Fell, wo es seine insektenabwehrende Wirkung entfaltet und insbesondere vor krankheitsübertragenden Mücken und Moskitos schützt. Die Primaten nehmen dabei die psychoaktive Wirkung des Sekrets offensichtlich wohlwollend in Kauf. Ein Selektionsvorteil entsteht dabei eher nicht, da das Risiko, während des zwanzigminütigen Drogenrausches gefressen zu werden, deutlich erhöht ist. Es ist also davon auszugehen, dass das Hervorrufen eines Rausches im Vordergrund steht.[13][14]
Berufskrankheit
[Bearbeiten | Quelltext bearbeiten]Augenschädigungen durch Benzochinon können eine anerkannte Berufskrankheit von Menschen sein, die mit Benzol umgehen. Benzochinon kann zunächst zu unspezifischen Reizwirkungen an Bindehaut und Hornhaut führen. Nach längerer, meist mehrjähriger Einwirkung dieses Stoffes kann es im Lidspaltenbereich zu Verfärbungen kommen. Diese sind vorwiegend gelblich-braun, unter Einwirkung des Lichtes später sepiafarben oder dunkelbraun. Es bilden sich feinere bis gröbere Trübungen und Verletzungen. Die Hornhaut kann quellen, sich verformen und zu einem irregulären Astigmatismus führen, der nicht völlig auszugleichen ist. Zunächst fehlen Bindehauthyperämie und Hornhautvascularisation. Die Sensibilität der Hornhaut ist herabgesetzt, ihre Regenerationsfähigkeit vermindert.
Häufig bleibt eine erhöhte Anfälligkeit gegen Sekundärinfektionen bestehen. Auch ohne erneute Einwirkung können selbst nach jahrelangem Intervall Epitheldefekte mit hartnäckigen Geschwüren bis zum klinischen Bild des Ulcus serpens auftreten. Dauerschäden (Trübung, Astigmatismus, Keratektasie) sind häufig. Verlust des Sehvermögens und des Auges ist möglich. Die Prognose der Erkrankung hinsichtlich der Erhaltung des Sehvermögens ist zweifelhaft, da es bereits im Anfangsstadium der Erkrankung zur irreversiblen Schädigung der Hornhaut kommen kann. Im günstigen Falle ist durch rechtzeitige augenärztliche Behandlung eine Rückbildung der Hornhauterkrankung möglich.[15]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Durch Reaktion mit einem Überschuss an Hydroxylamin kann p-Benzochinondioxim gewonnen werden.[16][17]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu p-Benzochinon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Datenblatt p-Benzoquinone bei Sigma-Aldrich, abgerufen am 5. Dezember 2016 (PDF).
- ↑ Eintrag zu p-benzoquinone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 2. November 2015.
- ↑ A. Woskressenski: Ueber die Zusammensetzung der Chinasäure. In: Annalen der Pharmacie. 27, 1838, S. 257–270, doi:10.1002/jlac.18380270303.
- ↑ F. Wöhler: Untersuchungen über das Chinon. In: Justus Liebigs Annalen der Chemie, 51, 1844, S. 145–163. doi:10.1002/jlac.18440510202.
- ↑ 1,4-Benzoquinone (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 8. Juli 2024.
- ↑ H. W. Underwood, Jr. and W. L. Walsh: Quinone In: Organic Syntheses. 16, 1936, S. 73, doi:10.15227/orgsyn.016.0073; Coll. Vol. 2, 1943, S. 553 (PDF).
- ↑ E. B. Vliet: Quinone In: Organic Syntheses. 2, 1922, S. 85, doi:10.15227/orgsyn.002.0085; Coll. Vol. 1, 1941, S. 482 (PDF).
- ↑ Lin YS et al.: Variability of albumin adducts of 1,4-benzoquinone, a toxic metabolite of benzene, in human volunteers. Biomarkers. 11. Januar 2006. S. 14–27. PMID 16484134.
- ↑ Bernhard Klausnitzer: Käfer. Nikol Verlagsgesellschaft mbH & Co. KG, Hamburg 2005, ISBN 3-937872-15-9.
- ↑ Jochen Martens: Weberknechte, Opiliones. Die Tierwelt Deutschlands, Teil 64, 1978. VEB G. Fischer, Jena.
- ↑ Lemur gets high. Video von „Animal Planet“ auf YouTube, in Englisch
- ↑ Sebastian Wenger: Der glückliche Affe, 2013, S. 155–158.
- ↑ Berufskrankheiten-Merkblatt Benzochinon
- ↑ N. Singh, D. Stephenson: 14N NQR study of selected 1,4-benzoquinonedioximes. In: Hyperfine Interactions. Band 197, Nr. 1-3, April 2010, S. 309–315, doi:10.1007/s10751-010-0239-7.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie, 7. vollst. Überarb. u. erw. Auflage 2012 Grundlagen,Verbindungsklassen, Reaktionen, Konzepte, Molekülstruktur, Naturstoffe, Syntheseplanung, Nachhaltigkeit. Georg Thieme Verlag, 2014, ISBN 3-13-159987-1, S. 363 (eingeschränkte Vorschau in der Google-Buchsuche).




