Fibrose
Als Fibrose (fachsprachlich auch Fibrosis) wird eine krankhafte Vermehrung des Bindegewebes in menschlichen und tierischen Geweben und Organen bezeichnet, dessen Hauptbestandteil Kollagenfasern sind. Dabei wird das Gewebe des betroffenen Organes verhärtet. Es entstehen narbige Veränderungen, die im fortgeschrittenen Stadium zur Einschränkung der jeweiligen Organfunktion führen. Stoffe, die eine Fibrose hervorrufen, nennt man Fibrogene, das zugehörige Adjektiv ist fibrogen.
Ätiologie
[Bearbeiten | Quelltext bearbeiten]Es gibt so genannte primäre Fibrosen, bei denen die Ursache der Veränderung unbekannt ist. Hierbei fibrosiert das jeweilige Gewebe ohne erkennbare äußere Schädigung. Ein Beispiel für eine primäre Fibrose ist die retroperitoneale Fibrose Morbus Ormond. Weitaus häufiger hingegen bilden sich sekundäre Fibrosen. Bei diesen wird das Gewebe zunächst durch eine exogene, also von außen einwirkende, oder endogene, also aus dem Körper selbst entstandene Schädigung hervorgerufen, beispielsweise durch Entzündungen oder Durchblutungsstörungen. Eine solche Schädigung wird als Noxe bezeichnet. Durch diese werden innerhalb des zerstörten Gewebsverbandes besondere Zellen innerhalb des Bindegewebes, sogenannte Fibroblasten, aktiviert, die vermehrt interstitielles Bindegewebe produzieren. Als interstitiell bezeichnet man das Bindegewebe, das innerhalb der Organe zwischen einzelnen Organabschnitten verläuft. In ihm sitzen die Blutgefäße und Nerven, die die Organe versorgen. Deshalb entsteht durch die Fibrose, also das unkontrollierte Wachstum dieser die Organe durchziehenden Bereiche, eine Vernarbung, die die Funktionalität der betroffenen Organe stark beeinträchtigen oder im Extremfall auch zerstören kann.
Prinzipiell ist dieser Vorgang in jedem Gewebe möglich. Bekanntestes Beispiel ist die alkoholtoxische Leberzirrhose, bei der eine Fibrose das Leberparenchym, also die schadstoffabbauenden Bereiche der Leber, durch wiederholte und langandauernde Vergiftung mit Alkohol zerstört. Weitere Beispiele für durch eine Fibrose verursachte Erkrankungen sind als Endstadium der verschiedensten Lungenerkrankungen die Lungenfibrose, der Funktionsverlust der Niere nach langzeitiger chronischer Niereninsuffizienz oder die diastolische Dysfunktion des Herzens.
Betroffene Organe
[Bearbeiten | Quelltext bearbeiten]Eine postoperative Bindegewebswucherung kann die Fibrose am Auge auslösen. In Folge einer endokrinen Orbitopathie ist ein deutliches Hervortreten der Augen, hochgezogene Oberlidern und Erweiterungen der Lidspalten zu bemerken.
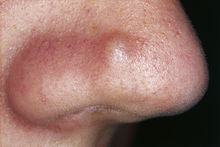
An der Haut kann eine Fibrose ein Keloid verursachen. An den Handinnenflächen kann ein Morbus Dupuytren auftreten. Die Induratio penis plastica ist für eine Bindegewebskrankheit des Penis verantwortlich, welche zu Penisverkrümmungen, Schmerzen bei einer Erektion und bis zur erektilen Dysfunktion mit psychischen Störungen führen kann. Die Fibrose kann an der Nasenpapel ein Hamartom bilden, welches als fibröse Nasenpapel bezeichnet wird.
Am Herz ist die Herzrhythmusstörung Vorhofflimmern möglich. Mit ihr ist ein erhöhtes Risiko für Schlaganfälle und Herzinsuffizienz verbunden. Krankheiten am Herzmuskel (Kardiomyopathie) können ein weiteres Erscheinungsbild einer Herzfibrose sein. Ebenfalls ist eine Diastolische Herzinsuffizienz, ein Herzinfarkt oder Remodeling bei einer Fibrose am Herz möglich. Eine Bindegewebsvermehrung findet auch bei einer diabetischen Kardiomyopathie statt.
Die Fibrose kann auch die Lungen betreffen, welche dann als Lungenfibrose gilt. Zusammen mit der Haut kann die Lunge als Auswirkung einer Sklerodermie betroffen sein. Ein spezielles Syndrom der Sklerodermie ist das CREST-Syndrom. Asthma gilt auch als Folge einer Lungenfibrose.
An der Niere kann die Fibrose ein chronisches Nierenversagen hervorrufen. Eine Peritonealdialyse wird zur Behandlung als Blutreinigungsverfahren eingesetzt. Bei der diabetischen Nephropathie vermehrt sich das Bindegewebe ebenfalls. Menschen mit einem Nierentransplantat sind dem Risiko einer chronischen Transplantatnephropathie ausgesetzt, welche die häufigste Ursache eines vorzeitigem Funktionsverlustes einer transplantierten Niere ist.
Eine Fettleber ist mögliches Ziel einer Steatohepatitis bei einer Leberfibrose. Im Endstadium führt diese zu einer Leberzirrhose, was unter anderem Durchblutungsstörungen der Leber hervorruft.
Innerhalb des Magenbereiches kann eine Fibrose eine Entzündung der Schleimhaut des Dickdarm verursachen (Mikroskopische Colitis). Die Retroperitonealfibrose lässt das Bindegewebe zwischen dem hinteren Bauchfell und der Wirbelsäule mit Ummauerung der Gefäße, Nerven und Harnleiter vermehren.
Bei einer Osteomyelofibrose ist das blutbildende Knochenmark betroffen. Sie kann zur Anämie oder Thrombozytopenie führen. Die sekundäre Version der Fibrose kann durch eine Strahlentherapie verursacht werden.
Das Medikament Ciclosporin, welches Transplantationspatienten einnehmen müssen, kann in hohen Dosen zu einem Fibroadenom führen.
Pathogenese
[Bearbeiten | Quelltext bearbeiten]Die Zellen werden unterschieden in Epithelzellen und Mesenchymzellen. Ein Epithel besteht aus einer die Basis bildenden Basalmembran und den darauf befindlichen Epithelzellen.
Allen Epithelzellen gemeinsam ist ihre Polarität: Sie haben eine apikal genannte Außenseite gegenüber der basalen Unterseite, welche der Basalmembran zugewandt ist. Diese haben unterschiedliche Funktionen. Epithelien sind dicht nebeneinander angeordnet und bilden so ein Deck- oder Drüsengewebe in Form einer Grenzfläche, die spezialisierte Stoffwechselfunktionen ausführt. In der Niere beispielsweise befindet sich das Epithel im Tubulus, einem feinen Rohr, in dem der durchfließende Urin konzentriert wird. Das transportierende Epithel nimmt hier bestimmte Stoffe auf und sondert andere ab. Erneuert wird es von sich teilenden Stammzellen, die vereinzelt auf der Basalmembran sitzen.
Eine Mesenchymzelle hingegen ist typischerweise nicht an eine Basalmembran gebunden, sondern meist frei beweglich wie die Zellen des Immunsystems. Sie kann sich im Blutkreislauf bewegen und Gewebe passieren.
Die Fibroblasten sind eine Form der Mesenchymzellen. Sie füllen den Raum zwischen den Zellen mit extrazellulärer Matrix von geringer Struktur und ergänzen hiermit auch als eine Art Narbengewebe geschädigte Bereiche des Epithels.
Bei der Entstehung einer Fibrose nehmen nun differenzierte Epithelzellen Eigenschaften einer Mesenchymzelle an. Sie verwandeln sich in Myofibroblasten. Diese sind eine besondere Form der Fibroblasten, die normalerweise unter anderem für die Wundheilung verantwortlich ist. Diesen Umwandlungsprozess bezeichnet man als Epitheliale-Mesenchymale Transition.
Die Myofibroblasten sind sehr produktiv, sie erzeugen weitaus mehr Matrixmaterial als erforderlich wäre und beeinträchtigen damit erheblich die Funktion der sie umgebenden Zellen.
Das Knochenmark bildet mesenchymale Progenitorzellen, sog. Fibrozyten, welche in die Organe wandern können und zu Fibroblasten werden.
Drei Faktoren beeinflussen dieses Geschehen: TGFβ, p38-MAPK und Thrombospondin. Das Thrombospondin ist antiangiogen; es reduziert das Einwachsen von Blutgefäßen in die entstandenen Narbenbereiche und bewirkt damit einen Energiemangel der angrenzenden Epithelien. Im Fall der Leberzirrhose resultiert aus der reduzierten Leitfähigkeit ein erhöhter Perfusionswiderstand, so dass sich Umgehungskreisläufe bilden.
Klinisch zeigen sich organspezifische Fibrosen der Leber, der Lunge, der Niere oder des Herzens, die zur Funktionseinschränkung führen. Im Bereich der rheumatischen Entitäten können Fibrosen entstehen, die mehrere Organe betreffen, wie zum Beispiel die Sklerodermie, die neben einer Hautverdickung auch die Lungen und kleine Nierengefäßwände verändert.
Therapie
[Bearbeiten | Quelltext bearbeiten]Die radikalste Form der Therapie besteht darin, die Myofibroblasten zu vernichten. Hierzu werden sogenannte NK-Zellen eingesetzt. NK-Zellen zerstören normalerweise körpereigene Zellen, die von Viren oder anderen Angreifern befallen sind. Die praktikabelste Form der Therapie ist es jedoch, irgendwo die Signaltransduktion des Signalmoleküls TGFβ zu hemmen. Ebenso sind viele Leit- und Altsubstanzen bekannt, die beispielsweise die p38-MAPK hemmen. Stoffe, von denen man erkannt hat, dass sie zur TGFβ-Aktivierung führen, wie das Angiotensin oder Aldosteron, werden mit heute verfügbaren Medikamenten beeinflusst.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Dietrich Reinhardt, Manfred Götz, Richard Kraemer, Martin H. Schöni: Cystische Fibrose. Springer-Verlag, 2013 (online)