Galactose
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Fischer-Projektion, offenkettige Darstellung | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name |
| |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H12O6 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 180,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,5 g·cm−3 (D-Form)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Die Galactose (fachsprachliche Schreibung), kurz Gal, auch Galaktose (traditionelle Schreibung, von altgriechisch γάλα gála, Genitiv: τοῦ γάλακτος toû gálaktos, deutsch „Milch“) oder auch Schleimzucker, ist eine natürlich vorkommende chemische Verbindung aus der Gruppe der Monosaccharide (Einfachzucker). Galactose kommt z. B. in den meisten Lebewesen als Baustein von Oligo- und Polykondensaten der Kohlenhydrate in verschiedenen Schleimhäuten vor, woher sich der deutsche Name ableitet. Im Vergleich mit Saccharose hat eine 10%ige D-Galactoselösung eine Süßkraft von 63 %.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Galactose ist eine Hexose und hat wie alle Hexosen die Summenformel C6H12O6. Sie ist stereoisomer (genauer gesagt ein C4-Epimer) zur Glucose und gehört zur Untergruppe der Aldohexosen.
Galactose hat wie die meisten natürlichen Zucker D-Konfiguration; L-Galactose besitzt in der Praxis nur untergeordnete Bedeutung. Wenn „Galactose“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, so ist immer D-Galactose gemeint.
| D-Galactose – Schreibweisen | ||
|---|---|---|
| Keilstrichformel | Haworth-Schreibweise | |

|
 α-D-Galactofuranose |
 β-D-Galactofuranose |
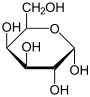 α-D-Galactopyranose |
 β-D-Galactopyranose | |
| Sessel-Darstellung α-D-Galactopyranose (links) und β-D-Galactopyranose (rechts) | ||

| ||
Jeder Ringform und jedem Stereoisomer ist eine eigene CAS-Nummer zugeordnet:
| offen- kettig |
Furanose | Pyranose | |
|---|---|---|---|
| D-Galactose | 59-23-4 | 19217-07-3 | 10257-28-0 |
| L-Galactose | 15572-79-9 | 41846-90-6 | 39392-65-9 |
Verhalten in wässriger Lösung
[Bearbeiten | Quelltext bearbeiten]In wässriger Lösung kommt es teilweise zu einem intramolekularen Ringschluss, sodass sich ein Gleichgewicht zwischen der Aldoform und den beiden Ringformen (Furanose-Form und Pyranose-Form) einstellt:[5]
Bei 20 °C liegt in Wasser gelöste D-Galactose zu 32 % in der α-Pyranoseform, zu 64 % in der β-Pyranoseform, zu 1 % in der α-Furanoseform und zu 3 % in der β-Furanoseform vor.[6]
Spezifische Drehwerte
[Bearbeiten | Quelltext bearbeiten]- α-D-Galactopyranose (= Sechsring): [α]20D = +150,7°
- β-D-Galactopyranose: [α]20°/D = +52,8°
Galactose zeigt Mutarotation. Drehwert der wässrigen Lösung: [α]20°/D = +80,2°
Energiestoffwechsel
[Bearbeiten | Quelltext bearbeiten]Durch Epimerisierung wird Galactose in einem mehrstufigen Prozess für die Glycolyse bereitgestellt. Folgende Reaktionsschritte werden dabei durchlaufen:
- Mit Hilfe der Galactokinase (GK, EC 2.7.1.6) wird Galactose (1) zu Galactose-1-phosphat (2) unter ATP-Verbrauch phosphoryliert.
- Im nächsten Schritt setzt das Enzym Galactose-1-phosphat-Uridyltransferase (GALT, EC 2.7.7.12) unter Beteiligung von UDP-Glucose (3) das Edukt um: Es entstehen UDP-Galactose (4) und Glucose-1-phosphat (5). Dieses Enzym ist bei einer Galactosämie defekt.
- Durch das Enzym Phosphoglucomutase (PGM, EC 5.4.2.2) kann Glucose-1-Phosphat zu Glucose-6-phosphat (6), einem Intermediat der Glycolyse, isomerisiert werden. Außerdem kann aus Glucose-1-phosphat zusammen mit UTP (Uridintriphosphat) durch die UDP-Glucose-Pyrophosphorylase (EC 2.7.7.9) zu UDP-Glucose regeneriert werden.
- Das Enzym UDP-Glucose-4-Epimerase (UGE, EC 5.1.3.2) sorgt dafür, dass aus UDP-Galactose die UDP-Glucose regeneriert werden kann. Sie kann erneut für die Reaktion im zweiten Schritt oder die Glycogen-Biosynthese verwendet werden.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Galactose tritt außer als Monosaccharid auch als Baustein in Di- (z. B. Lactose), Oligo- (z. B. Raffinose) und Polysacchariden (z. B. Agarose) auf. Sie ist auch Bestandteil von Proteoglykanen und Glycolipiden. Über UDP-Galactose stellt der Organismus auch bei galactosefreier Kost hierfür ausreichend Ausgangsstoff zur Verfügung.
In der lactierenden Milchdrüse wird Lactose aus UDP-Galactose und Glucose mit Hilfe von Lactosesynthetase in der Muttermilch als wichtiger Energieträger für Säuglinge bereitgestellt. Die Lactose wird im Dünndarm durch das Enzym Lactase in Glucose und Galactose gespalten und dem Energiestoffwechsel zugeführt.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Galactose wird als Nahrungsergänzungsmittel, Zuckerersatz und therapeutisch verwendet. Für die Behandlung von Patienten mit Phosphoglucomutase-1-Mangel wurden über unterschiedliche Zeiträume bis zu vier Monaten hinweg täglich 0,5–1 g/kg verabreicht, maximal 50 g pro Tag ohne schädliche Nebenwirkungen.[7]
Galactose ist im Gehirn auch an der Metabolisierung von Ammoniumionen unter Bildung von Aminosäuren beteiligt. Damit ist sie für die Behandlung von Patienten mit hepatischer Enzephalopathie zur Entgiftung dieses neurotoxischen Metaboliten geeignet.[8] Wegen der insulinunabhängigen zellulären Aufnahme von Galactose hat sie nur geringen Einfluss auf den Blutzuckerspiegel. Der glykämische Index von Galactose liegt bei 20 (Glucose = 100). Bereits in den 1930er Jahren behandelten Ärzte der Berliner Charité Diabetespatienten deshalb erfolgreich mit Galactose als Zuckerersatz.[9]
Galactose als „Hirnzucker“
[Bearbeiten | Quelltext bearbeiten]Galactose kann sowohl die Konzentrationsfähigkeit als auch die Gedächtnisleistung verbessern. So zeigten Studien an Ratten positive Effekte von oral zugeführter Galactose in der Behandlung kognitiver Defizite.[10]
Behandlung von Nierenschäden
[Bearbeiten | Quelltext bearbeiten]In Studien zeigte Galactose Erfolg bei der Behandlung von behandlungsresistenten Fällen von fokal segmentaler Glomerulosklerose (FSGS). Es wird vermutet, dass Galactose hier an den fokal-segmentalen Proteinfaktor (englisch focal segmental protein factor (FSPF)) bindet, ihn dadurch inaktiviert und so von weiterer Schädigung der Niere abhält.[7][11][12]
Künstliche Hirnalterung hervorgerufen durch intraperitoneal injizierte Galactose
[Bearbeiten | Quelltext bearbeiten]Die chronische, systemische Zufuhr von Galactose beschleunigt das Altern und die Neurodegeneration von Mäusen, Ratten und Individuen der Gattung Drosophila. Galactose verursacht vermehrten oxidativen Stress und damit einhergehende mitochondriale Fehlfunktion, vermehrten Zelltod (Apoptose) und verminderte Nervenzellneubildung im Gehirn der Tiere, insbesondere im Hippocampus.[13]
Die Galactose-induzierte beschleunigte Hirnalterung in Mäusen und Ratten ist ein verbreitetes und etabliertes pharmakologisches Modell zum Studium der Neurodegeneration, wie sie etwa bei Patienten mit Parkinson- oder Alzheimer-Krankheit vorkommt.[13]
Erkrankungen
[Bearbeiten | Quelltext bearbeiten]Eine Erbkrankheit, bei der die Betroffenen Galactose aufgrund eines Enzymdefekts überhaupt nicht verwerten können, wird Galactosämie genannt. Sie äußert sich sofort nach der Geburt.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt D-(+)-Galactose, 98% bei Alfa Aesar, abgerufen am 26. Dezember 2019 (Seite nicht mehr abrufbar).
- ↑ a b c Datenblatt L-(-)-Galactose, 98% bei Alfa Aesar, abgerufen am 26. Dezember 2019 (Seite nicht mehr abrufbar).
- ↑ a b c Eintrag zu Galactose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- ↑ Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6., vollständig überarbeitete Auflage. Springer, Berlin u. a. 2008, ISBN 978-3-540-73201-3, S. 263.
- ↑ Jürg Hunziker: Kohlenhydratchemie ( vom 10. Mai 2008 im Internet Archive), 1. April 2007.
- ↑ Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6., vollständig überarbeitete Auflage. Springer, Berlin u. a. 2008, ISBN 978-3-540-73201-3, S. 259.
- ↑ a b Eva Morava: Galactose supplementation in phosphoglucomutase-1 deficiency; review and outlook for a novel treatable CDG. Minireview. In: Molecular Genetics and Metabolism. Band 112, Ausgabe 4, August 2014. Elsevier, 21. Juni 2014, S. 275–279, doi:10.1016/j.ymgme.2014.06.002, PMID 24997537, PMC 4180034 (freier Volltext): „D-galactose has been safely used in clinical trials for FSGS in a dose of maximum 30g daily for a period of 4 months (20). […] No daily dose was used, however <sic!> above the suggested maximal intake of 50g/day (13). […] Based on our own and others’ experience D-galactose doses up to 50g/day seem to be safe.“
- ↑ Martin Roser, Djuro Josic, Maria Kontou, Kurt Mosetter, Peter Maurer: Metabolism of galactose in the brain and liver of rats and its conversion into glutamate and other amino acids. In: Journal of Neural Transmission. Band 116, Nr. 2, 1. Februar 2009, S. 131, doi:10.1007/s00702-008-0166-9.
- ↑ H. Kosterlitz, H. W. Wedler: Untersuchungen über die Verwertung der Galactose in physiologischen und pathologischen Zuständen. In: Zeitschrift für die gesamte experimentelle Medizin. Band 87, Nr. 1, 1. Dezember 1933, S. 397–404, doi:10.1007/BF02610497.
- ↑ Melita Salkovic-Petrisic, Jelena Osmanovic-Barilar, Ana Knezovic, Siegfried Hoyer, Kurt Mosetter: Long-term oral galactose treatment prevents cognitive deficits in male Wistar rats treated intracerebroventricularly with streptozotocin. In: Neuropharmacology. Band 77, S. 68–80, doi:10.1016/j.neuropharm.2013.09.002.
- ↑ Eric De Smet, Jean-Philippe Rioux, Hélène Ammann, Clément Déziel, Serge Quérin: FSGS permeability factor-associated nephrotic syndrome: remission after oral galactose therapy. Fallbericht. In: Nephrology, Dialysis, Transplantation. Band 24, Ausgabe 9, September 2009. Oxford University Press, 9. Juni 2009, S. 2938–2940, doi:10.1093/ndt/gfp278, PMID 19509024 (englisch, Volltext [PDF; 142 kB; abgerufen am 22. August 2023]).
- ↑ Matjaž Kopač, Anamarija Meglič, Rina R. Rus: Partial remission of resistant nephrotic syndrome after oral galactose therapy. Fallbericht. In: Therapeutic Apheresis and Dialysis. Band 15, Ausgabe 3, Juni 2011. Wiley, 30. Mai 2011, S. 269–272, doi:10.1111/j.1744-9987.2011.00949.x, PMID 21624074 (englisch, wiley.com).
- ↑ a b Thazin Shwe, Wasana Pratchayasakul, Nipon Chattipakorn, Siriporn C. Chattipakorn: Role of D-galactose-induced brain aging and its potential used for therapeutic interventions. In: Experimental Gerontology. Band 101, Januar 2018. Elsevier, 10. November 2017, S. 13–36, doi:10.1016/j.exger.2017.10.029, PMID 29129736. Akzeptierte Entwurfsversion als Volltext. (PDF; 1,1 MB) 30. Oktober 2017, abgerufen am 23. August 2023 (englisch).

