Chromsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
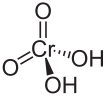
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chromsäure | ||||||||||||||||||
| Andere Namen |
Dihydrogenchromat (IUPAC) | ||||||||||||||||||
| Summenformel | H2CrO4 | ||||||||||||||||||
| Kurzbeschreibung |
dunkelrote bis gelbe geruchlose wässrige Lösung[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,95 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
nur als Lösung in Wasser beständig | ||||||||||||||||||
| Dichte |
1,5 g·cm−3 (50 % CrO3)[1] | ||||||||||||||||||
| Siedepunkt |
thermische Zersetzung[1] | ||||||||||||||||||
| Löslichkeit |
CrO3 gut löslich in Wasser: 1854 g·l−1 (bei 20 °C) [1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[4]; zulassungspflichtig[5] | ||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Chromsäure mit der Struktur H2CrO4 existiert nur in verdünnten wässrigen Lösungen. Reine, wasserfreie Chromsäure ist unbekannt. Sie ist eine starke zweiprotonige Säure und bildet als Salze die Chromate. Hydrogenchromate sind hingegen instabil und nur in wässriger Lösung bekannt.
Wird Chromsäure als Feststoff angeboten, handelt es sich stets um das Anhydrid der Chromsäure, das Chromtrioxid. Ebenso wie das Anhydrid ist die Chromsäure ätzend und giftig.
Wässrige Lösung
[Bearbeiten | Quelltext bearbeiten]Chromsäure ist eine starke Säure (pKs-Wert: −0,61) und liegt im Gleichgewicht nur zu einem sehr geringen Teil als H2CrO4 vor. HCrO4− ist hingegen eine schwache Säure (pKs-Wert: 6,45).[7] Daher liegt Chromsäure in verdünnter wässriger Lösung überwiegend als Hydrogenchromat HCrO4− vor.
Werden die wässrigen Lösungen mit einer Base versetzt, liegen bei einem pH-Wert > 7 überwiegend CrO42−-Ionen vor.
Bei pH-Werten zwischen 2 und 6 liegen HCrO4− vor und es bilden sich in einer Gleichgewichtsreaktion Dichromate (Cr2O72−). Bei dieser Reaktion kommt es zu einem Farbumschlag von gelb nach orange. Ist der pH-Wert der Lösung < 1, bilden sich unter weiterer Farbvertiefung Polychromate der allgemeinen Formel
CrnO3n+12−.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Verdünnte Chromsäure lässt sich durch Hydrolyse von Chrom(VI)-oxiddichlorid (Chromylchlorid) gewinnen. Als Nebenprodukte entstehen dabei Salzsäure und Chlor.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Chromsäure wird in der Chemie als Oxidationsmittel eingesetzt. Mit ihr lassen sich primäre Alkohole zu Aldehyden bzw. zu Carbonsäuren, sekundäre Alkohole zu Ketonen oxidieren.
In der Galvanotechnik wird Chromsäure zur Passivierung galvanisch erzeugter Schichten – vorwiegend bei Cadmium – und zur Vorbehandlung von Aluminiumoberflächen per anodischer Oxidation verwendet. Sie ist außerdem Hauptbestandteil der galvanischen Chromelektrolyte, die zum Verchromen verwendet werden. Die Chromsäurehärtung wurde 1840 von Adolph Hannover in die mikroskopische Technik eingeführt.[8] Des Weiteren werden Chromsäure bzw. Chromtrioxid zur Herstellung von Kaliumdichromat, Ammoniumdichromat und Chromdioxid verwendet.
Chromsäure wird zum Beizen von Kupfer, Bronze, Messing, Tombak und Rotguss verwendet, das auch als Gelbbrennen bezeichnet wird.
Chromsäurelösungen werden ferner häufig für die rasche Feststellung verwendet, ob im Metall bzw. einer Legierung Silber vorliegt. Der Gegenstand der Probe wird hierbei vor der Prüfung aus Gründen anzunehmender Versilberung z. B. angefeilt und dieser Stelle mit der Säure aufgetupft. Die Säure ergibt mit Silber einen Silberchromat-Niederschlag in blutroten Farbtönen. Bei unedlen Metallen bildet sich kein Silberchromat. Je dunkler der blutrote Farbniederschlag ausfällt, desto höher ist der Silberfeingehalt.
Chromsäure ist nicht zu verwechseln mit der Chromschwefelsäure.
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Chromsäure ist äußerst giftig (die letale Dosis entspricht beim erwachsenen Menschen 1 bis 2 g)[9] und auch seit langem als krebserregend bekannt. Bei Hautkontakt erzeugen sie Irritationen an Augen, Haut und Schleimhäuten. Chronischer Kontakt mit Chromsäure kann bei unterlassener Behandlung zu bleibenden Schäden führen.
Chromsäure kann zu einem toxischen Lungenödem und trotz späterer Behandlung zum Tod führen. Nach einer vorübergehenden Freiheit von Beschwerden (bis zu 48 Stunden) kann das Vollbild mit Hämoptoe, Zyanose, Aspiration oder Herzstillstand auftreten.[10]
Seit 1958 empfiehlt die WHO (World Health Organization) für Chrom(VI)-Verbindungen eine maximal zulässige Konzentration von 0,05 mg/Liter im Trinkwasser.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Arnold F. Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1567–1569.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu Chromsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Chromium (VI) compounds, with the exception of barium chromate and of compounds specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Sicherheitsdatenblatt Chromsäure auf emsdiasum.com, abgerufen am 18. Januar 2024.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- ↑ Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7738-94-5 bzw. Chromsäure), abgerufen am 27. Oktober 2015.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1568.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 35.
- ↑ S. Moeschlin: Klinik und Therapie der Vergiftungen. 7. Auflage, Thieme-Verlag, Stuttgart 1986, ISBN 978-3-13-378407-8.
- ↑ Max Daunderer: Lehrbuch Klinische Toxikologie. 42. Ergänzung, Mai 1989.
- Brandfördernder Stoff
- Giftiger Stoff bei Verschlucken
- Giftiger Stoff bei Hautkontakt
- Ätzender Stoff
- Sensibilisierender Stoff
- Atemwegsreizender Stoff
- Erbgutverändernder Stoff
- Krebserzeugender Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- CMR-Stoff
- SVHC-Stoff
- Zulassungspflichtiger Stoff nach REACH-Anhang XIV
- Anorganische Säure
- Chromverbindung
- Oxosäure
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 47
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 29
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72




