Kaliumhydrogensulfat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
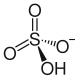
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumhydrogensulfat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | KHSO4 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 136,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,24 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
gut in Wasser (490 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Kaliumhydrogensulfat KHSO4 ist ein saures Kaliumsalz der Schwefelsäure. Es entsteht, wenn Schwefelsäure nur zu 50 % mit Kalilauge neutralisiert und die Lösung eingedampft wird. Das Produkt ist ätzend, kristallin und enthält neben Kaliumionen das Hydrogensulfat-Anion HSO4−.
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Synthese von Kalium- und Natriumhydrogensulfat gelingt durch Einwirkung mäßig warmer, konzentrierter Schwefelsäure auf Kalium- bzw. Natriumchlorid. Als Nebenprodukt dieser Verdrängungsreaktion entsteht das Gas Chlorwasserstoff:
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Der weiße, kristalline Feststoff löst sich leicht unter Bildung einer sauren Lösung in Wasser:
Erhitzt man das schwefelsaure Kaliumsulfat, so wandelt es sich unter Abgabe von Wasser (Dehydratisierung) in Kaliumdisulfat um:
Bei weiterem Erhitzen zerfällt das Kaliumdisulfat in Kaliumsulfat und Schwefeltrioxid:
Verwendung
[Bearbeiten | Quelltext bearbeiten]Kaliumhydrogensulfat dient ebenso wie das preiswertere Natriumhydrogensulfat als saurer Abflussreiniger. Hierbei wird in einer Verdrängungsreaktion Kalk aufgelöst.
Weiterhin dient Kaliumhydrogensulfat als Nachweisreagenz für Acetate. Acetat-Ionen (CH3COO−) lassen sich nachweisen, indem man das Salz, von dem man annimmt, dass es ein Acetat ist, mit Kaliumhydrogensulfat im Mörser zerreibt. Dabei wird das Proton (H+) des Hydrogensulfat-Ions auf das Acetation übertragen. Es entsteht Essigsäure, die leicht an ihrem typischen Geruch identifiziert werden kann.
- Acetat wird durch Hydrogensulfat protoniert. Es entstehen Essigsäure und Sulfat.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu E 515: Potassium sulphates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- ↑ a b c d e f g Eintrag zu Kaliumhydrogensulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Potassium hydrogensulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.






