Cadmiumoxid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Cd2+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cadmiumoxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | CdO | ||||||||||||||||||
| Kurzbeschreibung |
rotbrauner, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 128,41 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
1559 °C (Sublimation amorph)[2] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (49 mg·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR), ernsthafte Auswirkungen auf die menschliche Gesundheit gelten als wahrscheinlich[4] | ||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Cadmiumoxid ist eine chemische Verbindung des Cadmiums und zählt zu den Oxiden. Es kommt in zwei unterschiedlichen Formen als amorphes Pulver oder kristalline Verbindung vor, die sich in ihren Eigenschaften deutlich unterscheiden.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Cadmiumoxid kommt in der Natur in Form des seltenen Minerals Monteponit vor.[6]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Cadmiumoxid lässt sich durch die Oxidation von Cadmiumdampf mit Sauerstoff oder von Cadmiumschmelzen mit anderen Oxidationsmitteln gewinnen.[7]
Alternativen sind die thermische Zersetzung von Cadmiumcarbonat oder Cadmiumnitrat. Auch beim Rösten von Cadmiumsulfid entsteht Cadmiumoxid.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Amorphes Cadmiumoxid ist ein gelbes, je nach Partikelgröße auch braunes bis schwarzes Pulver mit einer Dichte von 6,95 g·cm−3. Es ist leicht reduzierbar und in Wasser und Basen unlöslich. Löslich ist es in verdünnten Säuren, Ammoniak, Ammoniumsalz-Lösungen sowie Natriumcyanidlösung. Beim starken Erhitzen in einer Sauerstoffatmosphäre wandelt es sich in das kristalline Cadmiumoxid um. Dieses ist dunkelrot, beim Erhitzen ändert sich die Farbe jedoch zu Schwarz.[7]
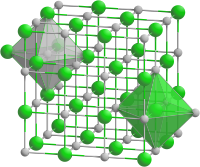
Cadmiumoxid kristallisiert im kubischen Kristallsystem in der Raumgruppe Fm3m (Raumgruppen-Nr. 225) mit dem Gitterparameter a = 4,695 Å sowie vier Formeleinheiten pro Elementarzelle.[6] Die Struktur entspricht damit der Natriumchloridstruktur. Es handelt sich bei Cadmiumoxid wie bei Zinkoxid um ein nichtstöchiometrisches Oxid, bei dem ein geringer Unterschuss an Oxidionen im Vergleich zu den Cadmiumionen herrscht. Dies wird – im Gegensatz zu Zinkoxid, bei dem zusätzliche Zinkionen in tetraedrischen Zwischengitterplätzen vorhanden sind – durch Fehlstellen im Oxidgitter verursacht. Durch unterschiedliche Anzahl an Fehlstellen je nach Temperatur wird auch die typische Farbänderung verursacht.[9]
Cadmiumoxid ist ein II-VI-Verbindungshalbleiter mit einem für ein Salz geringen spezifischen Widerstand von 5,5·10−3 Ω · cm bei 0 °C[7] und einer Bandlücke von 2,16 eV.[10]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Cadmiumoxid wird als Glaszusatz für Anlaufgläser, spezielle Farbgläser, die ihre Färbung erst nach einer Temperung (Wärmebehandlung) annehmen, und als Hydrierungs- und Dehydrierungskatalysator in der organischen Synthesechemie verwendet. Legiert mit Silber, schützt es die Oberfläche von hochbelasteten elektrischen Relaiskontakten.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu Cadmiumoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ a b c Günter Hommel: Handbuch der gefährlichen Güter. Vol. 3 Merkblätter 803-1205, 3. Auflage, Springer, 1999, ISBN 978-3-540-66592-2, Blatt 826 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Cadmium oxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1306-19-0 bzw. Cadmiumoxid), abgerufen am 2. November 2015.
- ↑ a b Monteponit in: Anthony et al.: Handbook of Mineralogy, 1990, 1, 101 (pdf).
- ↑ a b c Karl-Heinz Schulte-Schrepping, Magnus Piscator: Cadmium and Cadmium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002, doi:10.1002/14356007.a04_499.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1492.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1764.
- ↑ P. H. Jefferson, S. A. Hatfield, T. D. Veal, P. D. C. King, C. F. McConville, J. Zúñiga–Pérez, V. Muñoz–Sanjosé: Bandgap and effective mass of epitaxial cadmium oxide. In: Appl. Phys. Lett. 92, S. 022101, doi:10.1063/1.2833269.
- Giftiger Stoff bei Einatmen
- Erbgutverändernder Stoff
- Krebserzeugender Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- CMR-Stoff
- SVHC-Stoff
- Cadmiumverbindung
- Oxid
- Verbindungshalbleiter
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 28
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 23
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72



