Kaliumhydrogencarbonat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
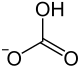
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kaliumhydrogencarbonat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | KHCO3 | |||||||||||||||||||||
| Kurzbeschreibung |
geruch- und farbloses kristallines Pulver [3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 100,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,17 g·cm−3 [3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser: 333 g·l−1 (bei 20 °C) [3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−963,2 kJ/mol[5] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Kaliumhydrogencarbonat ist ein Salz der Kohlensäure. Es zersetzt sich sehr schnell ab einer Temperatur von ca. 50 °C, wobei es Wasser und Kohlenstoffdioxid abspaltet. Dabei entsteht Kaliumcarbonat. Physiologisch gesehen gilt es als unbedenklich, es ist auch als Lebensmittelzusatzstoff E501 in Lebensmitteln enthalten.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Kaliumhydrogencarbonat dient als Trennmittel und Säureregulator in Lebensmitteln. Weiter wird es als künstliches Backtriebmittel in Backpulver verwendet. Beim Backen treibt es den Kuchenteig, indem es sich durch Hitze nach folgender Gleichung durch Abspaltung von Wasser und Kohlenstoffdioxid in Kaliumcarbonat zersetzt.
Im konventionellen sowie im biologischen Anbau von Pflanzen wird Kaliumhydrogencarbonat als Pflanzenschutzmittel (Fungizid) verwendet.[6]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Kaliumhydrogencarbonat entsteht, wenn in eine Lösung von Kaliumcarbonat in Wasser Kohlenstoffdioxid eingeleitet wird:
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu E 501: Potassium carbonate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 1. Juli 2020.
- ↑ Eintrag zu POTASSIUM BICARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Juli 2020.
- ↑ a b c d e Eintrag zu Kaliumhydrogencarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑ Armicarb ( vom 2. April 2015 im Internet Archive)

