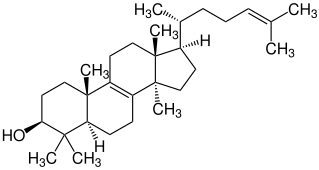
Lanosterin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Lanosterin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C30H50O | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 426,73 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Lanosterin (auch: Lanosterol) ist eine natürlich vorkommende chemische Verbindung. Chemisch handelt es sich um ein Steroid. Es entsteht in Eukaryoten als Zwischenprodukt bei der Biosynthese von Ergosterin (in Pilzen und Mykoplasmen) und Cholesterin (in Pflanzen wird diese Rolle allerdings zum größeren Teil von Cycloartenol übernommen).[4] In größeren Mengen ist es Bestandteil von Wollwachs (lat. Adeps lanae, daher der Name), in dem es von Cholesterin sowie den Lanostanderivaten Dihydrolanosterin (Lanost-8-en-3β-ol), Agnosterin (Lanosta-7,9(11),24-trien-3β-ol) und Dihydroagnosterin (Lanosta-7,9(11)-dien-3β-ol) begleitet wird.[5]
Aktuelle Forschungsergebnisse weisen darauf hin, dass Lanosterin zur Vorbeugung und Behandlung des Grauen Stars eingesetzt werden könnte.[6]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Struktur des Lanosterins wurde mit klassischen Methoden von einem Schweizer Team um W. Voser im Jahr 1950 aufgeklärt.[7]
Vorkommen und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Als Zwischenprodukt der Cholesterinbiosynthese kommt Lanosterin in allen Eukaryoten vor. Schafe schwitzen es mit dem Wollwachs aus, woraus es in größeren Mengen gewonnen werden kann. Die Trennung des Gemischs von anderen Triterpenen ist schwierig und erfolgt über fraktionierte Kristallisation und Chromatographie der Acetate.[8]
Woodward gelang die Synthese von Lanosterin aus Cholesterin in über ein Dutzend Schritten, nachdem sein Team die Totalsynthese von Cholesterin selbst schaffte.[9]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die biologische Synthese des Lanosterins erfolgt in einer bemerkenswerten mehrfachen Ringschluss-Reaktion aus (S)-Squalen-2,3-epoxid, die vom Enzym Lanosterin-Synthase katalysiert wird:
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Lanosterin ist in der Lage, verschiedene chemische Reaktionen einzugehen. So wird unter Einfluss von Phosphorpentachlorid der A-Ring zum Fünfring umgelagert; die C8-C9-Doppelbindung kann nicht direkt hydriert, aber in saurem Milieu nach C7-C8 verschoben werden; weitere Dehydrierung mit Selendioxid, N-Bromsuccinimid oder Perbenzoesäure ergibt das 7,9(11)-Dien, das weiter zum Enon oder Diketon oxidiert werden kann.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu LANOSTEROL in der CosIng-Datenbank der EU-Kommission, abgerufen am 2. April 2020.
- ↑ a b c d Datenblatt Lanosterol from sheep wool, ~97%, powder bei Sigma-Aldrich, abgerufen am 15. Juni 2011 (PDF).
- ↑ Waldemar Ternes, Alfred Täufel, Lieselotte Tunger, Martin Zobel (Hrsg.): Lebensmittel-Lexikon. 4., umfassend überarbeitete Auflage. Behr, Hamburg 2005, ISBN 3-89947-165-2, S. 1035 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Kolesnikova MD, Xiong Q, Lodeiro S, Hua L, Matsuda SP: Lanosterol biosynthesis in plants. In: Arch. Biochem. Biophys. 447. Jahrgang, Nr. 1, März 2006, S. 87–95, doi:10.1016/j.abb.2005.12.010, PMID 16445886.
- ↑ Eintrag zu Lanosterol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- ↑ Ling Zhao, Xiang-Jun Chen, Jie Zhu, Yi-Bo Xi, Xu Yang, Li-Dan Hu, Hong Ouyang, Sherrina H. Patel, Xin Jin, Danni Lin, Frances Wu, Ken Flagg, Huimin Cai, Gen Li, Guiqun Cao, Ying Lin, Daniel Chen, Cindy Wen, Christopher Chung, Yandong Wang, Austin Qiu, Emily Yeh, Wenqiu Wang, Xun Hu, Seanna Grob, et al.: Lanosterol reverses protein aggregation in cataracts. In: Nature. Juli 2015, doi:10.1038/nature14650 (nature.com).
- ↑ W. Voser, M. Montavon, Hs. H. Günthard, O. Jeger, L. Ruzicka: Zur Kenntnis der Triterpene. 156. Mitteilung. Zur Konstitution des Lanostadienols. In: Helv. chim. acta. 33. Jahrgang, Nr. 6, 1950, S. 1893–10, doi:10.1002/hlca.19500330658.
- ↑ a b Sujata V. Bhat, Bhimsen A. Nagasampagi, Meenakshi Sivakumar: Chemistry of natural products Birkhäuser, 2005. ISBN 3-540-40669-7, S. 47ff
- ↑ Woodward RB, Patchett AA, Barton DHR, Yves DHJ, Kelly RB: The Synthesis of Lanosterol (Lanostadienol). In: J. chem. Soc. 1957, S. 1131–44, doi:10.1039/JR9570001131.

