Kugelwolkenmodell
Das Kugelwolkenmodell (KWM, auch Kimballsches Atommodell und Tetraedermodell) ist ein Atommodell, mit dem sich manche Phänomene – wie beispielsweise die kovalente Bindung oder der räumliche Aufbau der Moleküle – veranschaulichen lassen. Es stellt eine Erweiterung des Bohrschen Atommodells dar und ist eine Vereinfachung gegenüber dem genaueren Orbitalmodell. Das Modell geht auf den amerikanischen Quantenchemiker George Elbert Kimball zurück und wurde vom Chemiker Henry A. Bent als „Tangent Sphere Modell“ weiterentwickelt. Als Entwickler werden auch die Chemiker Nevil Sidgwick und Herbert M. Powell genannt.[1]
Geschichte
[Bearbeiten | Quelltext bearbeiten]In den 1950er Jahren war das Orbitalmodell prinzipiell ausreichend, um die Eigenschaften von Molekülen berechnen zu können. Wegen der Komplexität des Modells durch die verschiedenen Orbitale und Orbitalformen war damit aber ein erheblicher Aufwand verbunden. Kimball entwickelte deswegen ein Atommodell, das anstelle der variationsreichen Orbitalformen nur kugelförmige s- und p-Orbitale verwendete und dennoch gute Ergebnisse bei Molekülberechnungen ermöglichte. Dieses Modell veröffentlichte er 1957.[2] Er konnte es aufgrund einer Herzerkrankung nicht mehr weiterentwickeln und verstarb 1967.[3]
Kimballs Ansatz inspirierte Henry A. Bent zu einer Neuinterpretation dieses Modells, dem „Tangent-Sphere-Model“ (etwa: „Modell der berührenden Kugeln“).[4] Als weitere Vereinfachung ließ er die qualitative Berücksichtigung der intramolekularen Anziehungs- und Abstoßungskräfte dadurch erfolgen, dass sich die jeweiligen Ladungswolken berühren müssen. Das führte zwar zu fachwissenschaftlicher Kritik, ermöglichte aber einen einfachen Zugang zu Bindungen und Molekülgeometrien. Die aus dem Kugelwolkenmodell resultierenden Darstellungen mit entsprechenden Ladungswolken (Hybridorbitalen) sind heute in den meisten gängigen Schulbüchern anzutreffen, das eigentliche Kugelwolkenmodell findet man dort aber nur noch selten.[5][6]
Zusammenhang mit dem Atommodell von Bohr
[Bearbeiten | Quelltext bearbeiten]Aus dem Schalenmodell von Bohr übernommen sind die Elektronenschalen, die um den Atomkern angeordnet sind. In jeder Schale sind aufgrund des Pauli-Prinzips jeweils maximal zwei Elektronen in einer Kugelwolke (kugelige Elektronenwolke) zusammengefasst. Die Elektronenwolke ist als „Aufenthaltsraum“ für die Elektronen zu verstehen, in dem sie sich bewegen.
Je weiter eine Elektronenschale vom Mittelpunkt des Atoms entfernt ist, desto mehr Elektronenwolken können geometrisch um den Kern angeordnet werden. Dementsprechend passen bei wachsender Entfernung immer mehr Elektronenwolken auf eine Schale:
- Erste Schale (K-Schale) = 2 Elektronen = 1 Elektronenwolke
- Zweite Schale (L-Schale) = 8 Elektronen = 4 Elektronenwolken
- Dritte Schale (M-Schale) = 18 Elektronen = 9 Elektronenwolken
- Vierte Schale (N-Schale) = 32 Elektronen = 16 Elektronenwolken
Die Anzahl Elektronen, die in der n-ten Schale Platz haben, berechnen sich nach der Formel
- Maximale Elektronenanzahl = 2·n2.
Allerdings nimmt jede äußere Schale, wie schon im Bohrschen Modell, nicht mehr als 8 Elektronen auf.
Regeln zum Auffüllen der Elektronenwolken
[Bearbeiten | Quelltext bearbeiten]- In der ersten Schale gibt es nur eine Kugelwolke, die zentral um den Kern angeordnet ist.
- Ab der zweiten Schale werden immer erst 4 Elektronenwolken angelegt, erst in den Nebengruppen werden sie auf die Endzahl erweitert (allerdings spielt das bei der chemischen Bindung keine Rolle)
- Jede der vier Elektronenwolken wird aufgrund der Abstoßung der Elektronen zuerst einfach besetzt. Erst ab dem 5. Elektron auf der Schale sind die Elektronen paarweise in den Elektronenwolken verteilt.
- Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie tetraedrisch angeordnet sind.
- Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.[7]
- Die weitere Besetzung der Elektronenwolken und Schalen erfolgt nach dem Madelung-Energieschema.
Beispiele
[Bearbeiten | Quelltext bearbeiten]-
Wasserstoffatom
Die erste Schale hat nur eine Kugelwolke, die zentrisch um den Kern angeordnet ist. -
Sauerstoffatom
In der zweiten Schale gibt es vier Kugelwolken, die beim Sauerstoff zusammen 6 Elektronen aufnehmen müssen. -
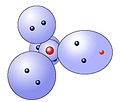
Chlorwasserstoff-Molekül
Die Bindung kommt durch Überlappung der einfach besetzten Elektronenwolken vom Wasserstoff und Chlor zustande -
Periodensystem der Elemente im Kugelwolkenmodell von Kimball, helle Kugelwolken haben ein Elektron, dunkle Kugelwolken zwei Elektronen
Die folgende Grafik stellt in der Valenzstrichschreibweise die Elemente der 2. Periode dar. Vollbesetzte Kugelwolken werden durch einen Strich und halbbesetzte durch einen Punkt dargestellt.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Jürgen Neumann: Die Elektronenpaarbindung im Kugelwolkenmodell. In: Praxishandbuch Chemie im Unterricht. Springer Spektrum, Berlin / Heidelberg 2022, ISBN 978-3-662-64963-3, S. 105–132, doi:10.1007/978-3-662-64964-0_1.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- kurze Einführung auf dem Landesbildungsserver BW
- Weiterführende Betrachtungen und Visualisierungen zum quantitativen Lewis-Modell, das auf Kimballs Kugelwolken basiert von Ernst Schumacher (englisch)
- Artikel zum Kugelwolkenmodell der Universität Rostock
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Axel König: Computergestützte Lehr- und Lernmaterialien zur chemischen Bindung, Dissertation, Mai 2003
- ↑ G. E. Kimball, G. F. Neumark: Use of Gaussian Wave Functions in Molecular Calculations. In: The Journal of Chemical Physics. Band 26, Nr. 5, 1. Mai 1957, S. 1285–1287, doi:10.1063/1.1743509.
- ↑ Philip M. Morse: George Elbert Kimball, 1906 – 1967. In: Biographical Memoirs of the National Academy of Sciences. Band 43. Washington 1973, S. 129–146 (nasonline.org [PDF; 814 kB]).
- ↑ Henry A. Bent: Tangent-sphere models of molecules. I. Theory and construction. In: Journal of Chemical Education. Band 40, Nr. 9, September 1963, S. 446, doi:10.1021/ed040p446.
- ↑ André Reinke, Alfred Flint: Das „Kugelwolken‐Modell“ – ein Klassiker neu belebt!? In: CHEMKON. Band 23, Nr. 2, April 2016, S. 59–63, doi:10.1002/ckon.201610271.
- ↑ Abteilung Didaktik der Chemie: Das Kugelwolkenmodell. In: Universität Rostock. Abgerufen am 14. September 2024.
- ↑ Elemente Chemie I – Baden-Württemberg, 2004, S. 162–165.