Lithiumeisenphosphat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
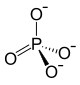 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumeisenphosphat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | LiFePO4 | |||||||||||||||
| Kurzbeschreibung |
graues bis schwarzes Pulver (Handelsform)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 157,759 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
0,8 – 1,4 g·cm−3 (Schüttdichte)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Lithiumeisenphosphat ist eine anorganische Verbindung, die in Lithium-Eisenphosphat-Akkumulatoren zur Ladungsspeicherung verwendet wird. Sie ist ein gemischtes Phosphat des Eisens und des Lithiums und kommt zumeist als kohlenstoffhaltiges graues bis schwarzes Pulver in den Handel. Die jährliche Produktionsmenge wird mit über 100.000 Tonnen angegeben.[4][5]
Benennung
[Bearbeiten | Quelltext bearbeiten]Nach den Regeln der anorganischen Nomenklatur werden bei Verbindungen mit mehreren Kationen diese in alphabetischer Reihenfolge aufgeführt; demnach müsste die Verbindung eigentlich Eisenlithiumphosphat heißen. Das ist aber nicht üblich. Das Material oder die damit ausgestatteten Batterien werden manchmal mit der Abkürzung LFP bezeichnet, die von der Summenformel LiFePO4 abgeleitet ist.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Lithiumeisenphosphat kommt in Form des eher seltenen Minerals Triphylin auch in der Natur vor.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Lithiumeisenphosphat wurde zuerst in Form des oben genannten Minerals Triphylin entdeckt. Dieses wurde 1834 vom deutschen Mineralogen Johann Nepomuk von Fuchs im Bayerischen Wald gefunden. Er untersuchte es und stellte dabei fest, dass Eisen, Lithium und Phosphat enthalten ist, außerdem fand er auch Mangan. Er benannte das neue Mineral.[6][7]
Eine vom späteren Nobelpreisträger John B. Goodenough geführte Arbeitsgruppe schlug 1997 als erste die Verwendung von Lithiumeisenphosphat (LFP) als Kathodenmaterial in Lithium-Ionen-Batterien vor.[8] Michel Armand erkannte das Potential des neuen Materials und erarbeitete in Zusammenarbeit mit Goodenough ein Herstellungsverfahren für ein optimiertes Gemisch.[9] Bei diesem erhält das LFP eine dünne Beschichtung aus Kohlenstoff, um eine ausreichende elektrische Leitfähigkeit sicherzustellen.[9][10] Anschließend war Armand an der Gründung einer Firma beteiligt, Phostech Lithium Inc., zur Herstellung und Vermarktung von LFP. Phostech wurde 2005 von der Süd-Chemie übernommen. Diese wiederum gehört seit 2011 zum Schweizer Unternehmen Clariant. Ein weiteres Unternehmen, das an der Kommerzialisierung von LFP arbeitete, ist die amerikanische Firma A123 Systems. Sie nutzt Patente des MIT.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Ausgangsstoffe zur Darstellung von Lithiumeisenphosphat sind Lithiumcarbonat, Lithiumhydroxid oder Lithiumphosphat, sowie Eisensalze wie Eisen(II)-carbonat, Eisen(II)-sulfat oder Eisen(II)-phosphat. Ein Beispiel für eine solche Umsetzung ist die Reaktion
- .
Aufgrund der steigenden technischen Bedeutung von LiFePO4 wurden viele verschiedene Herstellungsverfahren entwickelt[11]: Festkörpersynthesen mit einem Kalzinierungsschritt bei 400…800 °C, oft ergänzt mit Mahlen in der Kugelmühle zur besseren Durchmischung, Hydrothermalverfahren, bei denen wässrige Lösungen unter hohem Druck verwendet wurden, so dass Temperaturen oberhalb 100 °C erreicht werden können, und Sol-Gel-Prozesse. Bei genügend hohen Synthesetemperaturen können auch die preiswerteren Eisen(III)-Salze verwendet werden, da Fe3+ durch Kohlenstoff in der Hitze zu Fe2+ reduziert werden kann (carbothermische Reduktion), z. B.:[12]
- oder
- .
Lithiumeisenphosphat wird großtechnisch hergestellt. 2017 beanspruchte Lithiumeisenphosphat ca. 38 % des weltweiten Markts für Lithium-Kathodenmaterialien. Allerdings wird erwartet, dass das Material in den kommenden Jahren gegenüber Lithium-Nickel-Mangan-Cobalt-Oxide (NMC) an Bedeutung verlieren wird, da letzteres aufgrund seiner höheren Energiedichte von vielen Elektrofahrzeugherstellern favorisiert wird.[13]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Die elektrische Leitfähigkeit von LiFePO4 ist mit ca. 10−9 S/cm sehr gering.[14]
Lithiumeisenphosphat kristallisiert in der Olivinstruktur.
Bei tiefen Temperaturen unterhalb 50 K ist LiFePO4 antiferromagnetisch.[15]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Lithiumeisenphosphat ist in Salzsäure löslich. Lithium kann unter Erhalt des Kristallgitters aus Lithiumeisenphosphat extrahiert werden, dabei entsteht Eisen(III)phosphat FePO4.
LiFePO4 ist thermodynamisch sehr stabil, es gibt beim Erhitzen – im Gegensatz zu Lithiumkobaltoxid – keinen Sauerstoff ab.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Lithiumeisenphosphat ist das Lithium-Speichermaterial (Kathodenmaterial) am Pluspol der Lithium-Eisenphosphat-Akkumulatoren. Beim Laden der Batterie entsteht Eisen(III)-phosphat, das beim Entladen wieder in Lithiumeisen(II)phosphat überführt wird:
- vollständiges Laden: .
- vollständige Entladung:
Die Spannung der Lithiumeisenphosphatakkumulatoren ist mit 3,3 V etwas kleiner als die anderer Lithiumionenakkumulatoren wie z. B. Lithiumcobaltoxid, was insgesamt eine geringere Energiedichte bedeutet.[16] Vorteile von Lithiumeisenphosphat sind u. a. eine deutlich höhere Lebensdauer.[17] Aufgrund der hohen Stabilität von LiFePO4 gelten Batterien mit diesem Material als besonders sicher. Daher werden die entsprechenden Akkumulatoren auch in Elektrofahrzeugen, z. B. in Elektrofahrrädern verwendet. Auch in einigen Elektroautos wird Lithiumeisenphosphat eingesetzt, z. B. im BYD e6 und in einigen Tesla-Modellen.[18]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Lithiumeisenphosphat gilt als ungiftig und daher als umweltfreundlich.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Gouri Cheruvally: Lithium Iron Phosphate: A Promising Cathode-Active Material for Lithium Secondary Batteries. Trans Tech Publications Ltd., 2008, ISBN 978-0-87849-477-4.
- Pier Paolo Prosini: Iron Phosphate Materials as Cathodes for Lithium Batteries – The Use of Environmentally Friendly Iron in Lithium Batteries. Springer, London 2011, ISBN 978-0-85729-744-0.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Lithium iron(II) phosphate, powder, <5 μm particle size (BET), >97% (XRF) bei Sigma-Aldrich, abgerufen am 4. Februar 2014 (PDF).
- ↑ Jian Wang, Yuan Chen, Lu Qi: The Development of Silicon Nanocomposite Materials for Li-Ion Secondary Batteries
- ↑ Benjamin Daheron, Dean D. MacNeil: Study of LiFePO4 synthesized using a molten method with varying stoichiometries. In: Journal of Solid State Electrochemistry. Band 15, Nr. 6, Juni 2011, S. 1217–1225, doi:10.1007/s10008-010-1191-9.
- ↑ Interview mit Michel Armand. In: CIC energiGUNE > Communication > Blog. CIC energiGUNE, abgerufen am 10. Juli 2021 (englisch).
- ↑ Lithium iron phosphate: the future production will be short of supply, demand will double every year, will exceed the market expectations. Shenzhen Manly Battery Co, abgerufen am 10. Juli 2021.
- ↑ Johann Nepomuk von Fuchs: Ueber ein neues Mineral (Triphylin). In: Journal für Praktische Chemie. Band 3, Nr. 1, 1834, S. 98–104, doi:10.1002/prac.18340030120.
- ↑ Johann Nepomuk von Fuchs: Vermischte Notizen, 3. Triphylin. In: Journal für Praktische Chemie. Band 5, Nr. 1, 1835, S. 319–320, doi:10.1002/prac.18350050138.
- ↑ Akshaya K. Padhi, K. S. Nanjundaswamy, John B. Goodenough: Phospho-Olivines as Positive Electrode Materials for Rechargeable Lithium Batteries. In: Journal of the Electrochemical Society. Band 144, Nr. 4, 1997, S. 1188–1194, doi:10.1149/1.1837571.
- ↑ a b Lithium iron phosphate (LMP/LFP) battery. In: REVE News of the wind sector in Spain and in the world. Spanish Wind Energy Association, 6. Juli 2011, abgerufen am 27. Juni 2021 (amerikanisches Englisch).
- ↑ Heng Zhang, Chunmei Li, Gebrekidan Gebresilassie Eshetu, Stéphane Laruelle, Sylvie Grugeon: From Solid‐Solution Electrodes and the Rocking‐Chair Concept to Today's Batteries. In: Angewandte Chemie. Band 132, Nr. 2. Wiley-VCH, Weinheim 7. Januar 2020, S. 542–546, doi:10.1002/ange.201913923.
- ↑ Dragana Jugović, Dragan Uskoković: A review of recent developments in the synthesis procedures of lithium iron phosphate powders. In: Journal of Power Sources. Band 190, Nr. 2. Elsevier, Mai 2009, S. 538–544, doi:10.1016/j.jpowsour.2009.01.074.
- ↑ Jing Du, Ling-Bin Kong, Hong Liu, Jin-Bei Liu, Mao-Cheng Liu, Peng Zhang, Yong-Chun Luo, Long Kang: Template-free synthesis of porous–LiFePO4/C nanocomposite for high power lithium-ion batteries. In: Electrochimica Acta. Band 123, 2014, S. 1–6, doi:10.1016/j.electacta.2013.12.157.
- ↑ Tyler Or, Storm W. D. Gourley, Karthikeyan Kaliyappan, Aiping Yu, Zhongwei Chen: Recycling of mixed cathode lithium-ion batteries for electric vehicles: Current status and future outlook. In: Carbon Energy. Band 2, Nr. 1, 2020, S. 6–43, doi:10.1002/cey2.29.
- ↑ Sung-Yoon Chung, Jason T. Bloking, Yet-Ming Chiang: Electronically conductive phospho-olivines as lithium storage electrodes. In: Nature Materials. Band 1, Nr. 2, Oktober 2002, S. 123–128, doi:10.1038/nmat732.
- ↑ R. P. Santoro and R. E. Newnham: Antiferromagnetism in LiFePO4. In: Acta Crystallographica. Band 22, Nr. 3, März 1967, S. 344–347, doi:10.1107/S0365110X67000672.
- ↑ Who will win the battery wars? | Greenbiz. Abgerufen am 12. September 2020 (englisch).
- ↑ Marcelo Ayevedo: Lithium and Cobalt – a tale of two commodities. Hrsg.: McKinsey & Company. (mckinsey.com).
- ↑ China's BYD, Tesla release EVs using LFP batteries. 25. Mai 2020, abgerufen am 12. September 2020 (englisch).




