Natriumsilicate
Natriumsilicate sind chemische Verbindungen aus der Gruppe der Natriumverbindungen und Silicate, die in mehreren molaren Verhältnissen vorkommen (Monosilicat, Metasilicat, Polysilicat, …). Je nach Art der Herstellung und dem Reinheitsgrad sind sie mehr oder weniger hydratisiert oder löslich. Daneben wird auch noch das Natriumsalz Na4SiO4 der Orthokieselsäure Si(OH)4 als Natriumorthosilikat bezeichnet.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]In der Natur kommen Natriumsilicate in Form der Mineralien Ertixiit Na2Si4O9 und Natrosilit Na2Si2O5 vor.[1]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Natriumsilicate in amorpher Form werden durch Zusammenschmelzen von Siliciumdioxid und Natriumoxid (oder Natriumcarbonat unter Entwicklung von Kohlendioxid) in molaren Verhältnissen zwischen 1:1 bis 4:1 hergestellt. Die so erhaltenen Feststoffe werden bei etwa 150 °C und 5 bar Dampfdruck in Wasser gelöst um eine Lösung in Wasser (Natronwasserglas) zu erhalten.
Natriumorthosilicat:
Natriummetasilicat:
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]| Name | Natriumorthosilicat | Dinatriummetasilicat Natriummetasilicat E 550 |
Dinatriumdisilicat | Dinatriumtrisilicat | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Strukturformel |
|
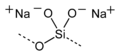
|
|||||||||||
| CAS-Nummer | 13472-30-5 | 6834-92-0 13517-24-3 (Nonahydrat) 10213-79-3 (Pentahydrat) |
13870-28-5 | 13870-30-9 | |||||||||
| 1344-09-8 (unspezifiziert) | |||||||||||||
| ECHA-InfoCard | 100.033.387 | 100.027.193 100.106.270 100.122.400 |
100.034.189 | 100.034.191 | |||||||||
| 100.014.262 | |||||||||||||
| PubChem | 26051 | 23266 | 61699 | 23266 | |||||||||
| Summenformel | Na4O4Si | Na2O3Si | Na2O5Si2 | Na2O7Si3 | |||||||||
| Molare Masse | 184,04 g·mol−1 | 122,06 g·mol−1 | 182,15 g·mol−1 | 242,23 g·mol−1 | |||||||||
| Aggregatzustand | fest | ||||||||||||
| Kurzbeschreibung | als Reinstoff farbloser und geruchloser Feststoff | ||||||||||||
| Schmelzpunkt | 1018 °C[2] | 1098 °C 48 °C (Nonahydrat) 72 °C (Pentahydrat)[3] |
|||||||||||
| Dichte | 1,39 g·cm−3[2] | 2,61 g·cm−3[3] | |||||||||||
| Löslichkeit | löslich in Wasser (175…350 g·l−1 bei 20 °C)[2][3] | ||||||||||||
| GHS- Kennzeichnung |
|
|
|
| |||||||||
| H- und P-Sätze | 314‐335 | 290‐314‐335[3] | siehe oben | siehe oben | |||||||||
| keine EUH-Sätze | keine EUH-Sätze | siehe oben | siehe oben | ||||||||||
| 260‐264‐280‐301+330+331 303+361+353‐304+340‐305+351+338 310‐321‐363‐405‐501‐280 261‐271‐304+340‐312‐403+233 |
261‐280‐305+351+338‐310[3] | siehe oben | siehe oben | ||||||||||
| Tox-Daten | 1150 mg·kg−1 (LD50, Ratte, oral)[3] | ||||||||||||
Natriumsilicate sind kristalline oder als Gemisch verschiedener Silicate glasartige (amorphe) Feststoffe bzw. in Wasser viskose Lösungen. Als Reinstoff sind sie farblos, technische Produkte erscheinen durch Verunreinigungen leicht blau bis grün oder gelb bis braun. Natronwasserglas reagiert infolge teilweiser Hydrolyse alkalisch. Durch das Kohlendioxid der Luft wird die Lösung allmählich neutralisiert, wobei je nach Konzentration Fällungsprodukte der Kieselsäure entstehen. Natriummetasilicat kommt daneben noch in mehreren Hydratformen vor, wobei das Nonahydrat bei 48 °C und das Pentahydrat bei 72 °C schmilzt.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Silicate haben ein so breites Anwendungsgebiet, dass nur einige wichtige Anwendungen aufgeführt werden. Diese werden hauptsächlich in Form von sogenanntem Wasserglas (wasserlösliche Silicate von Alkalimetallen, vornehmlich von Natrium und Kalium) eingesetzt. Natriumsilicat wird als Bindemittel, Brandschutzmaterial sowie als Puffer und Stabilisator für Chemikalien (z. B. H2O2), für die Brikettierung von Kohle, Glas, Erz, beim Papier-Recycling, beim Beschichten von Papier und zur Metallentfettung verwendet. Es ist auch in Waschmitteln, Bleichlaugen, Seifen, Reinigungsmitteln, Zementen, Mörtel, keramischen Erzeugnissen, Anstrichfarben und kosmetischen Präparaten enthalten.
Risikobewertung
[Bearbeiten | Quelltext bearbeiten]Dinatriummetasilicat wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Dinatriummetasilicat waren die Besorgnisse bezüglich Verbraucherverwendung, hoher (aggregierter) Tonnage und hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) sowie der möglichen Gefahr durch reproduktionstoxische Eigenschaften. Die Neubewertung fand ab 2015 statt und wurde von Lettland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[6][7]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Sodium silicates (KEMI) ( vom 17. Januar 2012 im Internet Archive)
- Patent EP0860399: Method of preparing crystalline sodium silicates. Veröffentlicht am 4. April 2001, Erfinder: Josef Holz, Günther Schimmel, Alexander Tapper, Volker Thewes.
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Disodium silicate, pentahydrate
Literatur
[Bearbeiten | Quelltext bearbeiten]- Werner Wieland: Ein Beitrag zur Kenntnis der Kieselsäure. Zürich 1930, doi:10.3929/ethz-a-000144203 (Dissertation, ETH Zürich).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Mineraliensuche (Mineralienatlas)
- ↑ a b c Eintrag zu Natriumsilikat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e f g h Eintrag zu Dinatriummetasilikat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ Santa Cruz Biotechnology: Sodium orthosilicate | CAS 13472-30-5 | SCBT - Santa Cruz Biotechnology, abgerufen am 17. Juni 2023
- ↑ Datenblatt Sodium metasilicate bei Sigma-Aldrich, abgerufen am 4. Mai 2011 (PDF).
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): disodium metasilicate, abgerufen am 20. Mai 2019.





