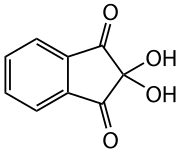
Ninhydrin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ninhydrin | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C9H6O4 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 178,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Ninhydrin ist das Hydrat des Indan-1,2,3-trions und dient als Reagenz zum Nachweis von Ammoniak und primären Aminogruppen, insbesondere von Aminosäuren.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ninhydrin reagiert mit der Aminogruppe von Aminosäuren unter Wasserabspaltung zu einer Schiffschen Base (Imin). Nach Decarboxylierung der Carboxygruppe der Aminosäure und anschließender Abspaltung des Amino-Restes entsteht Amino-Ninhydrin. Dieses dimerisiert mit Ninhydrin zu einem violetten Farbstoff (Ruhemanns Purpur). Die intensive violette Farbe kann durch Mesomerie unter der Beteiligung einer Wasserstoffbrückenbindung innerhalb des Systems konjugierter Doppelbindungen erklärt werden.[4]
Die Intensität der Farbe ist der Konzentration des Farbstoffes (siehe Lambert-Beersches Gesetz) und damit der Konzentration einer zu bestimmenden Aminosäure proportional. Zur quantitativen Analyse werden photometrisch bei 570 nm mehrere Proben mit bekannter Konzentration als Standards mit der zu untersuchenden Probe verglichen. Bei der Reaktion mit sekundären Aminosäuren, wie Prolin oder Hydroxyprolin, entsteht ein gelber Farbkomplex, welcher bei 400 nm photometrisch gemessen werden kann.
Ninhydrin hat auch eine Bedeutung bei der Umsatzkontrolle bei der Festphasen-Peptidsynthese (SPPS) und in der organischen Festphasensynthese (SPOS) und ist ein Bestandteil des Kaiser-Tests.[5][6]
Die Reaktion ist relativ empfindlich, die Nachweisgrenze liegt bei 0,001 bis 0,1 mg.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Ninhydrin wird vor allem für den Nachweis von Aminosäuren und Proteinen verwendet. Für Proteine ist der Test jedoch nur erfolgreich, wenn relativ kurze Oligopeptide vorliegen, da Ninhydrin nur mit freien Aminogruppen reagiert und diese bei langkettigen Polypeptiden kaum vorhanden sind. Der Nachweis wird in Lösung (unter Erhitzen im Wasserbad) durchgeführt. Ninhydrin wird häufig auch als Sprühreagenz z. B. bei der Papierchromatografie oder Dünnschichtchromatographie verwendet.
Eine weitere auf dieser Reaktion basierende Anwendung ist die Erstellung von Fingerabdrücken. Da im Schweiß Aminosäuren vorkommen, können diese mit Ninhydrin reagieren und die Finger- bzw. Handabdrücke sichtbar machen.
Dieser Mechanismus findet auch in der Medizin als sogenannter Moberg-Test Anwendung zum Nachweis peripherer Nervenläsionen. Da die für die Schweißsekretion regulierenden sympathischen Fasern ab dem Austritt aus dem Rückenmark gemeinsam mit den peripheren Nervenbahnen verlaufen, ist auch die Schweißsekretion gestört, was sich an einem abgenommenen Hautabdruck mittels Ninhydrin nachweisen lässt.
Eine Ausnahme bildet die Aminosäure Prolin bzw. Hydroxyprolin, die als sekundäre Aminosäuren statt einer primären (NH2) eine sekundäre (NH) Aminogruppe besitzen. Prolin und Hydroxyprolin reagieren über einen anderen Reaktionsmechanismus zu einem gelbroten Produkt mit einem Absorptionsmaximum bei 400 nm. Bei der Reaktion mit einer primären Aminosäure, welche eine NH2 Gruppe besitzt ein Absorptionsmaximum von 570 nm besitzt, und zu einem Violetten Farbstoff namens Ruhemanns Purpur reagiert.[7]

Reaktionsmechanismen mit Aminosäuren
[Bearbeiten | Quelltext bearbeiten]⍺-Aminosäuren
[Bearbeiten | Quelltext bearbeiten]Der Reaktionsmechanismus ist komplizierter als üblicherweise dargestellt; damit befassen sich Friedmann und Williams.[8] Im Einzelnen laufen – wie in der Darstellung zu sehen – folgende Reaktionen ab: Zunächst wird das Ninhydrin 1 zum Trion dehydratisiert. Am mittleren Carbonylsauerstoff greift die Aminogruppe 2 der Aminosäure an und kondensiert zum Imin. Dieses weist eine offene Siebenring-Struktur auf, welche eine zyklische Elektronenverschiebung unter Decarboxylierung ermöglicht. Durch Hydrolyse des Imins wird der Aminosäurerest als Aldehyd abgespalten und es verbleibt das primäre Amin. In einer Kondensationsreaktion entsteht so mit einem zweiten Ninhydrinmolekül unter Wasserabspaltung das Ruhemanns Purpur 3.

Ausnahme: Prolin
[Bearbeiten | Quelltext bearbeiten]Ein Prolinmolekül und ein Ninhydrinmolekül reagieren zu einem gelben, intermediären Additionsprodukt, welches nun ein weiteres Ninhydrinmolekül am Ring binden kann, wodurch ein ebenfalls purpurnes Produkt entsteht.[7][9]

Ninhydrin in der kriminalistischen Anwendung
[Bearbeiten | Quelltext bearbeiten]Ninhydrin und Amido-Schwarz finden Einsatz bei der Sicherung von Fingerabdrücken. Ein diesbezügliches Patent[10] wurde am 27. September 1954 in den Vereinigten Staaten von Svante Odén (* 29. April 1924 in Stockholm; † 1986 Todeserklärung nach Verschollenheit, Professor für Bodenkunde) angemeldet. Dieser erlangte Bekanntheit durch die Entdeckung der Versauerung von Böden durch Niederschläge und durch Analysen von Schwermetallen im Klärschlamm aus kommunalen Kläranlagen. Die Ninhydrin-Untersuchung von saugenden Spurenträgern gehört seither, neben den Verwendung von verschiedenen Adhäsionspulvern je nach Oberflächenbeschaffenheit und Kontrasterfordernis des Spurenträgers (Rußpulver, Argentorat, Lycopodium, Blancopodium etc.) und Silbernitrat sowie Cyanacrylat, zu den wesentlichen Methoden in den kriminaltechnischen Laboren und wird in der Regel wie folgt angewendet:
- Ninhydrin: In 100 ml Ethanol wird 2 g Ninhydrin gelöst. Die Lösung wird mit ca. 0,5 g einer 20%igen Essigsäure angesäuert und dann mit einem Sprühgerät auf den Fingerabdruck gesprüht. Zur Entwicklung des Abdrucks wird er einige Minuten über Wasserdampf gehalten. Ninhydrin reagiert mit den Aminosäuren und Eiweißen im Schweiß und bildet eine violette Verbindung von komplexem Aufbau.[11]
- N.F.N. (Non Flammable Ninhydrin): Die Non Flammable Ninhydrin-Lösung bewirkt eine chemische Reaktion mit einigen Substanzen der daktyloskopischen Spur. Sie eignet sich gut für Schreibpapier, Zeitungen und Pappe; für Kunstdruck-, Hochglanz- und Fotopapier ist sie ungeeignet. Der Spurenträger wird in die Lösung eingetaucht (die Dauer richtet sich nach der Materialstärke) oder mit einem Wattebausch befeuchtet. Nach Trocknung an der Luft wird er im Dunkeln gelagert. Die Entwicklung der Spuren dauert 30 Minuten bis 72 Stunden; in dringenden Fällen kann sie durch Hitzezufuhr beschleunigt werden. Mit Ninhydrin behandelte Spurenträger sind sofort in eine luftdichte Plastikhülle zu stecken, weil eine erneute Berührung zu weiteren Spuren führen würde; außerdem können sich gesundheitsschädliche Dämpfe oder Stäube entwickeln. Die Spurensicherung erfolgt durch Fotografie.[12]
- N.P.B. (Ninhydrin-Petroleumbenzin): Die Lösung bewirkt eine chemische Reaktion mit einigen Bestandteilen der daktyloskopischen Spur. Die gesundheitsschädlichen Anteile von N.F.N. (Trichlortrifluorethan und Essigsäure) sind durch Petroleumbenzin ersetzt, das entstehende Dampfgemisch ist dafür aber explosionsgefährlich. Elektroanlagen und -geräte im Arbeitsraum müssen ex-geschützt sein. N.P.B. eignet sich gut für Schreibpapier, Zeitungen und Pappe; bei Kunstdruckpapier, Hochglanzpapier und Fotopapier kann es dagegen nicht verwendet werden. Die Verarbeitung erfolgt in gleicher Weise wie bei N.F.N.[12]
- Tetra-N.P.B. (Tetra Ninhydrin-Petroleumbenzin): Die Lösung bewirkt eine chemische Reaktion mit einigen Bestandteilen der daktyloskopischen Spur. Sie ist gut geeignet für latente Spuren, die durch Blut oder Blutwasser entstanden sind (die Blutspurenuntersuchung wird durch das Verfahren nicht beeinträchtigt). Die Mischung wird in ein Gefäß gegeben, bis sich zwei Schichten gebildet haben. Die obere, helle Flüssigkeit wird abgegossen (muss entsorgt werden), die untere, braune Flüssigkeit wird in das Sprühgerät gefüllt. Die Spurensicherung erfolgt im Original (mit Spurenträger) oder fotografisch.[13]
- Ninhydrin – Aceton: Die Lösung bewirkt eine chemische Reaktion mit einigen Bestandteilen der daktyloskopischen Spur. Sie ist gut geeignet für Schreibpapier, Zeitungen und Pappe; für Kunstdruck-, Hochglanz- und Fotopapier kann sie nicht verwendet werden. Aceton löst fast alle Schrifteinfärbungsmittel, Stempelaufdrucke usw. auf. Das Verfahren darf daher nur angewendet werden, wenn auf die Untersuchung dieser Spurenarten verzichtet werden kann. Die Spurensuche erfolgt in gleicher Weise wie bei N.F.N.[12]
- Sirchie - Onprint: Bei dem Onprint-Spray handelt es sich um ein Industrieerzeugnis, das ähnliche Stoffe wie N.F.N. enthält. Es ist gut geeignet für Schreibpapier, Zeitungen und Pappe; bei Kunstdruckpapier, Hochglanzpapier und Fotopapier kann es nicht verwendet werden. Der Spurenträger wird aus 30 cm Entfernung besprüht und an der Luft getrocknet. Bei Lagerung im Dunkeln entwickeln sich die Spuren selbständig in einer Zeit von ca. 30 Minuten bis zu 72 Stunden.[12]
Besonderheiten
[Bearbeiten | Quelltext bearbeiten]Ninhydrin ist eine der wenigen Verbindungen, die der Erlenmeyerregel widersprechen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Siegfried Ruhemann: Cyclic di- and tri-ketones. In: Journal of the Chemical Society Transactions. Band 97, 1910, S. 1438–1449. doi:10.1039/CT9109701438
- Stanford Moore, William Howard Stein: Photometric ninhydrin method for use in the chromatography of amino acids. In: J Biol Chem. Band 176, 1948, S. 367 ff.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Ruhemanns Purpur ( vom 31. Mai 2008 im Internet Archive)
- Nachweis von Aminosäuren in Milch
- Reaktionsmechanismus
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu NINHYDRIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. September 2021.
- ↑ a b Eintrag zu Ninhydrin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ a b c d Eintrag zu Ninhydrin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ S. Ebel, H. J. Roth (Hrsg.): Lexikon der Pharmazie. Georg Thieme Verlag, 1987, ISBN 3-13-672201-9, S. 465.
- ↑ E. Kaiser, R. L. Colescott, C. D. Bossinger, P. I. Cook: Color test for detection of free terminal amino groups in the solid-phase synthesis of peptides. In: Analytical Biochemistry. Band 34, Nr. 2, April 1970, S. 595–598.
- ↑ V. K. Sarin, S. B. H. Kent, J. P. Tam, R. B. Merrifield: Quantitative monitoring of solid-phase peptide synthesis by the ninhydrin reaction. In: Analytical Biochemistry. Band 117, Nr. 1, S. 147.
- ↑ a b FU Berlin: Proteine. FU Berlin, abgerufen am 11. November 2019.
- ↑ Mendel Friedman, L. David Williams: Stoichiometry of formation of Ruhemann's purple in the ninhydrin reaction. In: Bioorganic Chemistry. Band 3, Nr. 3, 1974, S. 267–280, doi:10.1016/0045-2068(74)90017-0.
- ↑ D. J. McCaldin: The Chemistry of Ninhydrin. ACS Publications, 31. August 1959, S. 39–51.
- ↑ Robert Heindl: Patent für ein kriminalistisches Verfahren (Ninhydrinmethode). In: Archiv für Kriminologie. Band 119, 5 und 6. Schmidt-Römhild, Lübeck 1. Juni 1957, S. 177 (Text des Patentanspruchs in Identification News, Januar 1957, S. 1 f.).
- ↑ Chemie verstehen: Fingerabdrücke, abgerufen am 31. Dezember 2009.
- ↑ a b c d Henry C. Lee, Robert E. Gaensslen: Advances in fingerprint technology. CRC Press, 2001.
- ↑ G. Kaiser: Kriminologie. Eine Einführung in die Grundlagen. 10., völlig neubearbeitete Auflage. Heidelberg 1997.
