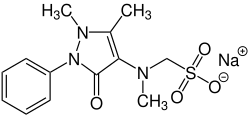
Metamizol-Natrium
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Metamizol-Natrium (INNv[1]) | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H16N3NaO4S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
nichtsaures Nichtopioid-Analgetikum, Antipyretikum | |||||||||||||||||||||
| Wirkmechanismus |
Unbekannt | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 333,34 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
4351 mg Metamizol-Natrium-Monohydrat·kg−1 (LD50, Ratte, oral)[4] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Metamizol-Natrium, kurz Metamizol genannt, ist ein schmerzstillender und fiebersenkender Wirkstoff mit krampflösender Komponente aus der Gruppe der nichtsauren Nichtopioid-Analgetika. Weitere geläufige Namen des Wirkstoffs sind Dipyron, Novaminsulfon und der Handelsname Novalgin. Chemisch handelt es sich um ein Pyrazolon-Derivat, der Name Metamizol leitet sich aus Methyl, Amino und Pyrazol ab. Im Organismus entsteht durch hydrolytische Spaltung der eigentliche Wirkstoff 4-Methylaminophenazon (4-Methylamino-1,5-dimethyl-2-phenyl-1,2-dihydro-3H-pyrazol-3-on).[7]
Auch in der Tiermedizin wird der Wirkstoff als akut wirkendes Schmerzmittel eingesetzt,[8][9] und er ist auch für lebensmittelliefernde Tiere zugelassen.
Pharmazeutisch verwendet wird das Natriumsalz von Metamizol bzw. seine kristallwasserhaltige Form Metamizol-Natrium-Monohydrat (Ph. Eur.). Metamizol-Natrium-Monohydrat ist ein weißes bis fast weißes kristallines Pulver, das sehr leicht löslich in Wasser, löslich in Ethanol 96 % und praktisch unlöslich in Dichlormethan ist.[10] In der Säureform wird Metamizol[11] nicht arzneilich eingesetzt.
Ferner sind ein Calciumsalz (Metamizol-Calcium)[12] und ein Magnesiumsalz (Metamizol-Magnesium)[13] beschrieben.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Metamizol ist ein Analgetikum aus der Reihe der Pyrazolone. Deren Entwicklung begann um 1875 mit der Entdeckung des Phenylhydrazins durch den deutschen Chemiker und Nobelpreisträger Hermann Emil Fischer.[14] Fischers Schüler Ludwig Knorr wollte in den 1880er Jahren aus Phenylhydrazin ein Chinolinderivat als Ersatz für das fiebersenkende und in der Chinarinde natürlich vorkommende Chinin synthetisieren. In seinem Labor setzte Knorr Phenylhydrazin mit Acetessigester um, wobei jedoch kein Chinolin-, sondern ein Pyrazol-Abkömmling entstand. Dessen Methylierungsprodukt Phenazon wurde als Antipyrin in die Therapie eingeführt[15] und galt als „Mutter aller modernen fiebersenkenden Schmerzmittel“.[14]
1893 entwickelte der Apotheker und Chemiker Friedrich Stolz in den Farbwerken Hoechst aus dem Antipyrin eine weitere Substanz, die eine Dimethylaminogruppe am C4-Atom trägt und die er Aminopyrin nannte; sie kam 1896 als Pyramidon auf den Markt.[14]

Für den klinischen Einsatz bei schwerer Erkrankten wurde eine wasserlösliche und somit injizierbare Variante benötigt.[14] Chemiker bei Meister Lucius & Brüning[14] (ein Vorgänger der Hoechst AG) synthetisierten daraufhin, indem sie über eine Methylenbrücke eine Sulfonsäuregruppe in das Antipyrin einbrachten, das wasserlösliche Sulfamidopyrin. Die Darstellung im Jahr 1912 wird Max Bockmühl,[16] nach anderer Quelle Friedrich Stolz[17] zugeschrieben. Sulfamidopyrin wurde als Melubrin (eine aus dem Firmennamen „Meister Lucius & Brüning“ gebildete Abkürzung[14]) von 1912 bis 1959 vermarktet.[18] Im Jahr 1920[19] erhielten Bockmühl und Windisch als N-Methyl-Derivat von Sulfamidopyrin[20] das Metamizol, eine wie Sulfamidopyrin ebenfalls gut wasserlösliche Substanz, die jedoch doppelt so wirksam war.[21] Es wurde 1922 von der Firma Hoechst unter dem Handelsnamen Novalgin auf dem deutschen Arzneimittelmarkt eingeführt.[22]
Otto Dornblüth erwähnte Novalgin 1934 in seinem Klinischen Wörterbuch als „Phenyldimethylpyrazolonmethylaminomethansulfonsaures Natrium, innerlich und parenteral anwendbares entzündungswidriges Analgeticum, Antirheumaticum und Antipyreticum der I.G. Farben.“[23] Früher zählte man Metamizol zu den damals so genannten kleinen (auch schwachen oder einfachen) Analgetika mit großer therapeutischer Breite. Zum Beispiel wurde es auch zur Behandlung von Kopfschmerzen empfohlen.[24] Schon 1985 wurden das Auftreten von Knochenmarksdepressionen (Blutbildungsschäden, Leukopenien) und spezifische Allergien sowie zerebrale Krampfanfälle, Delirien und Dämmerzustände als unerwünschte Wirkungen beschrieben.[25]
Vor allem Aminophenazon und Metamizol seien in der Pädiatrie seither in Misskredit geraten und durch Paracetamol verdrängt worden.[26] Nach dem GKV-Arzneimittelindex ging die Verordnung von Metamizol 1991 gegenüber dem Vorjahr wohl als Folge der intensiven Diskussion über das Risiko der Metamizol-Anwendung um 4,7 Prozent zurück.[27] Ebenso ging die Verordnung des zu DDR-Zeiten unter dem Namen Analgin vermarkteten Metamizolpräparates in den neuen Bundesländern nach der Wende 1991 gegenüber dem Vorjahr um 69,3 % zurück.[28]
Indikationen
[Bearbeiten | Quelltext bearbeiten]Metamizol ist in den EU-Ländern, in denen es durch die nationalen Zulassungsbehörden zugelassen ist, für folgende Anwendungsgebiete genehmigt:[29]
- akute starke Schmerzen nach Trauma oder nach einem chirurgischen Eingriff,
- schmerzhafte Koliken,
- Tumorschmerzen,
- sonstige akute oder chronische Schmerzen, falls andere therapeutische Maßnahmen kontraindiziert sind,
- hohes Fieber, das auf andere Maßnahmen nicht anspricht.
Zu den schmerzhaften Koliken (viszerale Schmerzen und Kolikschmerzen[30][31]) werden auch Harnleiterkoliken durch Urolithiasis[32] sowie Gallen- und Nierenkoliken[33] gezählt.
Die Anbieter von Metamizol-Präparaten in der Europäischen Union veröffentlichen pflichtgemäß die Anwendungsgebiete ebenso wie auch Anwendungseinschränkungen in ihren Packungsbeilagen und Fachinformationen.[34]
Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) hat mehrfach gemahnt, Metamizol strikt nur innerhalb der obigen Indikationen zu verordnen. Offenbar werde aber Metamizol häufig auch bei leichten bzw. mittelstarken Schmerzen sowie (trotz wirksamer und weniger riskanter Alternativen) als Erstlinientherapie bei Beschwerden, wie beispielsweise Rückenschmerzen, eingesetzt. Bei einer solchen Anwendung von Metamizol, die auch in Deutschland weiterhin durch die Zulassung nicht abgedeckt ist („Off-Label-Use“), sei das Nutzen-Risiko-Verhältnis ungünstig, worüber der Arzt den Patienten entsprechend den Sorgfaltsanforderungen des Arzthaftungsrechts aufklären und engmaschig auf Zeichen gefährlicher Nebenwirkungen untersuchen muss.[35][36] Der Einsatz von Metamizol sei also nur dann gerechtfertigt, wenn Paracetamol, nichtsteroidale Antirheumatika (NSAR) oder Opioide nicht ausreichen oder nicht gegeben werden dürfen. Ansonsten sei „im Fall eines Schadens der verordnende Arzt rechtlich in einer kritischen Situation“.[37]
Risiko einer Agranulozytose
[Bearbeiten | Quelltext bearbeiten]Wegen der seltenen schweren Nebenwirkung Agranulozytose wurde Metamizol in vielen Industriestaaten vor allem des englischen Sprachraums, aber auch in weiteren Gebieten (z. B. in Skandinavien und Japan), nicht zugelassen oder eine bereits bestehende Zulassung wurde widerrufen. In Australien ist die Einfuhr verboten.[38] Im deutschsprachigen Raum dagegen ist die Anwendung des verschreibungspflichtigen Medikaments weit verbreitet, das zudem auch außerhalb der zugelassenen Indikationen zur Anwendung kommt.[35] Auf Antrag Finnlands befasste sich die Europäische Arzneimittel-Agentur (EMA) im Jahr 2024 erneut mit der Frage, ob und unter welchen Bedingungen Metamizol weiter zugelassen werden darf. Die EMA gab am 6. September 2024 als Ergebnis ihres Bewertungsverfahrens bekannt, dass der Nutzen von metamizolhaltigen Arzneimitteln weiterhin die Risiken überwiegt. Die Produktinformationen für alle metamizolhaltigen Arzneimittel sollten jedoch aktualisiert werden.[39] Die Änderungen sollten das Bewusstsein für die schwerwiegende Nebenwirkung Agranulozytose bei Patienten und Angehörigen der Gesundheitsberufe schärfen und ihre frühzeitige Erkennung und Diagnose erleichtern.[40] In einem Rote-Hand-Brief vom 9. Dezember 2024 informierten Hersteller und Arzneimittelbehörden Angehörige der Gesundheitsberufe entsprechend. Sie müssen Patienten, die mit Metamizol behandelt werden, über Frühsymptome der Agranulozytose aufklären und informieren, die Einnahme sofort abzubrechen und einen Arzt aufzusuchen, sobald sich solche Symptome zeigen.[41]
Kontraindikationen
[Bearbeiten | Quelltext bearbeiten]Gegenanzeigen für die Gabe von Metamizol sind eine bekannte Unverträglichkeit, Erkrankungen der blutbildenden Zellreihe, eine hepatische Porphyrie (angeborene oder erworbene Störung der Produktion des roten Blutfarbstoffes) sowie ein Glucose-6-Phosphat-Dehydrogenase-Mangel.[34] Weitere Gegenanzeigen sind ein Analgetika-Asthma-Syndrom und eine Analgetika-Intoleranz vom Urtikaria-Angioödem-Typ.[42]
Von einer gleichzeitigen Gabe von Methotrexat (MTX) und Metamizol wird dringend abgeraten. Vor allem bei Patienten ab dem 40. Lebensjahr sei das Agranulozytose-Risiko nahezu verdreifacht, ab dem 80. verachtfacht.[43][44]
Metamizol zeigte in tierexperimentellen Studien zwar keine teratogenen Effekte, aufgrund fehlender Daten am Menschen wird aber vom Einsatz in der Schwangerschaft abgeraten. Kontraindiziert ist die Anwendung im letzten Schwangerschaftsdrittel, in der Stillzeit sowie bei Säuglingen unter drei Monaten.[34]
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Metamizol, das selbst ein Prodrug ist, wird zum pharmakologisch wirksamen 4-N-Methylaminoantipyrin (4-MAA) hydrolysiert. Metamizolpräparate werden intravenös, intramuskulär, rektal und (als Tabletten und Tropfen) oral verabreicht.[45] Bei intravenöser Zufuhr ist Metamizol bereits nach 15 Minuten nicht mehr im Blut nachweisbar. Nach oraler Verabreichung gelangt es nicht in das Blutplasma, sondern wird schon im Gastrointestinaltrakt quantitativ nicht enzymatisch zu 4-MAA hydrolysiert. Letzteres wird dann nahezu vollständig resorbiert. Die Bioverfügbarkeit von Methylaminoantipyrin liegt bei etwa 90 %. 4-MAA wird in der Leber (hepatisch) verstoffwechselt und hauptsächlich über die Niere (renal) ausgeschieden. Die Plasmahalbwertzeit und die Wirkdauer betragen circa 2,5 bis 4 Stunden. Die Wirkung von intravenös verabreichtem Metamizol tritt nach 20 bis 30 Minuten ein.[46] Eine gleichzeitige Nahrungsaufnahme kann zu einer verlangsamten Resorption von peroral verabreichtem Metamizol und damit zu einem leicht verzögerten Wirkungseintritt führen.[22]
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Der genaue Wirkmechanismus von Metamizol ist ungeklärt. Diskutiert werden unter anderem eine Beteiligung des 5-HT- oder Opioid-Stoffwechsels oder des cGMP-Signalweges. Seit den 1980er Jahren ist bekannt, dass Metamizol als Cyclooxygenase-Hemmer wirkt.[47] Nach einer physiologischen Studie von 2015 blockiert Metamizol TRPA1-Ionenkanäle in Schmerzrezeptoren (Nozizeptoren).[48]
Neben seiner schmerzlindernden und fiebersenkenden Wirkung wirkt Metamizol (in hohen intravenösen Dosen) in bestimmten Fällen (vor allem Kolikschmerzen) auch krampflösend (spasmolytisch),[49][50] was durch Öffnung von Kaliumkanälen und den verminderten Einstrom von Calcium in der glatten Muskulatur erklärt wird.[51] Metamizol wird deshalb zur Schmerztherapie bei Koliken der Gallen- und Harnwege eingesetzt.
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Etwa die Hälfte der im deutschen Spontanmeldesystem erfassten unerwünschten Nebenwirkungen sind Hautveränderungen, darunter lebensgefährliche wie das Stevens-Johnson-Syndrom (6,5 %) und das Lyell-Syndrom (7,8 %).[34][52] Etwa 8 % der im deutschen Spontanmeldesystem erfassten Nebenwirkungen wurden unter psychiatrische Störungen zusammengefasst. Neben Verwirrtheit und Benommenheit (Somnolenz) zählen hierzu in wenigen Einzelfällen auch Angst, Delirium, Depression, Unruhe (Agitiertheit), Halluzinationen, Konzentrationsschwäche, Sedierung und Sprachstörungen. Die Störungen können bereits bei geringer Dosierung über einige Stunden andauern.[52]
Nach einer Übersichtsstudie von 2016 erhöhte Metamizol das gastrointestinale Blutungsrisiko im Magenbereich signifikant – je nach Einzelstudie – um den Faktor 1,4 bis 2,7 (relatives Risiko).[53] Einzelfälle von akutem Nierenversagen mit akuter interstitieller Nephritis nichtdestruierender Natur wurden berichtet.[54][55] Auch können Übelkeit und Erbrechen auftreten, gelegentlich auch eine harmlose Rotfärbung des Urins durch Stoffwechselprodukte.
In einem Rote-Hand-Brief vom 15. Dezember 2020 informierten die Zulassungsinhaber und die Aufsichtsbehörden die Fachöffentlichkeit über das sehr seltene Risiko für arzneimittelbedingte Leberschäden unter Anwendung von Metamizol.[56][57] Der Entstehungsmechanismus ist weitgehend unklar, es wird eine immun-allergische Komponente angenommen. Die Leberschäden sind dem Wortlaut des Rote-Hand-Briefes nach wahrscheinlich meist reversibel.
Grundsätzlich können die Nebenwirkungen bei parenteraler Gabe verstärkt sein.[34]
Agranulozytose
[Bearbeiten | Quelltext bearbeiten]Bei einer akuten Agranulozytose handelt es sich um eine Störung der Bildung von Granulozyten im Knochenmark, einer Unterart von weißen Blutkörperchen (Leukozyten). Eine Auslösung durch Metamizol kann in einem sehr variablen Zeitintervall (ein Tag bis mehrere Monate) nach der ersten Verabreichung eintreten. Da die metamizolinduzierte Agranulozytose tödlich enden kann, sind Blutkontrollen und ein Absetzen des Medikaments sofort nach den ersten Symptomen zwingend erforderlich.[34][58][59]
Als Symptome können zuerst lokale Infekte mit Halsschmerzen, Schleimhautschäden (Ulzera), Fieber und Schüttelfrost und später eine Generalisierung des Infekts (Sepsis) auftreten. Als Therapie werden – neben dem Ausschalten des Auslösers – Antibiotika und eventuell Granulozyten-Transfusionen oder Stimulationsfaktoren (G-CSF) gegeben. Bei Absetzen des Auslösers ist die Bildungsstörung oft reversibel, in einer relevanten Anzahl von Fällen jedoch nicht oder zu spät. Selbst in Ländern mit hochentwickelter medizinischer Versorgung, wie Schweden[60] und Deutschland,[61] starb nahezu jeder Vierte (23 % und 23,6 %) derer, die unter Metamizol eine Agranulozytose entwickelt hatten. Neben der Agranulozytose kommen auch Fälle mit einer Blutbildstörung (Neutropenie), jedoch ohne klinische Symptome, vor.

Parallel zur Zunahme der Verordnungen von Metamizol in Deutschland seit 1990 ist hier eine Zunahme der Spontanmeldungen von Agranulozytosen durch Metamizol zu verzeichnen: Während 1990 noch eine Inzidenz von weniger als 10 Fälle berichtet wurde, lag die Zahl der Meldungen um 2010 im Durchschnitt bei über 30[35] und im Jahr 2012 bei über 50 pro Jahr.[61] Bei zwei Dritteln der Fälle trat die Agranulozytose innerhalb von 6 Wochen nach (dauernder oder zeitweiser) Einnahme auf, bei 30,5 % innerhalb von 7 Tagen und in 18 Fällen direkt nach ein- oder zweimaligem Gebrauch. 38 Fälle (23,6 %) endeten tödlich.[61] Zwar gelangte 1986 eine vom deutschen Hersteller Hoechst bezahlte[60] Studie zu einer Schätzung der Häufigkeit von lediglich 1,1 pro 1 Million Anwendungen pro Woche.[62] Diese Studie wurde jedoch wegen schwerwiegender methodischer Fehler heftig kritisiert.[63][64] Tatsächlich ergab beispielsweise eine schwedische Studie von 2002 bei Auswertung dortiger Systeme personenbezogener Arzneimittelstatistik und ärztlicher Meldepflichten ein weitaus höheres Risiko der Agranulozytose von mindestens 1 pro 1439 Verordnungen.[65][66][67] Eine vergleichbare Studie von 2014, die die Daten der größten deutschen gesetzlichen Krankenkasse (Techniker Krankenkasse) nutzen konnte, bestätigte die schwedischen Ergebnisse von 2002 auf einer noch größeren Datenbasis.[68][69]
Bei Tieren ist eine Agranulozytose bislang nicht beschrieben. Lediglich bei Pferden wurde nach mehrmaliger Anwendung hoher Dosen eine Leukopenie festgestellt.[70]
Anaphylaktische, anaphylaktoide und allergische Reaktionen
[Bearbeiten | Quelltext bearbeiten]Bei zu hoher Injektionsgeschwindigkeit bei intravenöser Injektion von Metamizol besteht ein Risiko von 0,1 bis 1 % eines anaphylaktischen Schocks, eines lebensbedrohlichen Zustands, der sehr schnell eintreten kann und ein Todesrisiko von 25 % mit sich bringt.[71] Auch nach oraler Einnahme kann es zu einem anaphylaktischen Schock kommen.[34]
In der BRD erfragte 1980 das Bundesgesundheitsamt von den Herstellern 260 derartige Schock-Fälle, die auf Metamizol zurückgeführt wurden, davon 205 nach Injektionen und 54 nach Tabletten und Zäpfchen. Von der Gesamtzahl verliefen – gemäß den Meldungen – 35 tödlich.[72]
Aufgrund dieses Risikos sind in Italien seit 1979 und in Ägypten seit 1983 Injektionspräparate mit einer Dosis von mehr als 1 Gramm nicht mehr zugelassen.[73]
Bei Personen, bei denen eine Neigung zu allergischen Reaktionen, zu Asthma oder zu chronischen Atemwegsinfektionen besteht, kann es zu einer starken allergischen Hautreaktion bis zu einem Asthmaanfall kommen. Wenn Allergien gegen Analgetika oder das Süßungsmittel Saccharin vorhanden sind, sollte besondere Vorsicht geboten sein.[74]
Thrombozytenaggregationshemmung
[Bearbeiten | Quelltext bearbeiten]Eine reversible Hemmung der Thrombozytenaggregation und damit verzögerter Blutgerinnung ist bekannt. Labortechnisch ist diese vergleichbar mit der Wirkung anderer Schmerzmittel der Gruppe der NSAR. Dadurch kann es bei gleichzeitiger Einnahme zu einer Herabsetzung der Wirksamkeit des stärkeren Thrombozytenaggregationshemmers Acetylsalicylsäure kommen.[75][76]
Blutdruckabfall
[Bearbeiten | Quelltext bearbeiten]Insbesondere bei schneller intravenöser Injektion kann es zu Blutdruckabfällen kommen.[46]
Wechselwirkungen
[Bearbeiten | Quelltext bearbeiten]Metamizol bewirkt eine Abnahme des Ciclosporin-Serumspiegels, weshalb dieser bei gleichzeitiger Anwendung kontrolliert werden muss. Weiterhin kann die Wirkung von Diuretika abgeschwächt werden.[22][34] Cimetidin kann die Plasmakonzentration von Metamizol um ungefähr 70 % erhöhen.[77]
Gesundheitspolitische Bedeutung (Pharmakovigilanz)
[Bearbeiten | Quelltext bearbeiten]2015 veröffentlichte eine Forschungsgruppe an der Oxford University eine Analyse der weltweiten Reaktionen von Behörden der Arzneimittelzulassung auf Berichte von Todesfällen durch Medikamente nach deren Marktzulassung. Für den Zeitraum von 1950 bis 2013 wurden 95 Medikamente gefunden, bei denen die Zulassung aufgrund dokumentierter Todesfälle nach der Markteinführung widerrufen wurde. In 16 der 95 Fälle war die Widerrufung jedoch von Land zu Land uneinheitlich. Metamizol wurde als Musterbeispiel für eine gravierende Uneinheitlichkeit genauer analysiert. Hier wurde der erste Todesfall 1952 berichtet, doch die ersten Verbote erfolgten erst 1974 in Norwegen und Schweden und das zuletzt erfasste Verbot erst 2013 in Indien, während eine Reihe von Ländern ihre Zulassungen beibehielten.[78] Die Autoren dieser Studie und einer weiteren aus Kanada[79] empfahlen eine verbesserte Überwachung bereits zugelassener Medikamente, mehr internationale Kooperation und mehr Transparenz der Verfahren sowohl bei Pharmaunternehmen als auch bei Zulassungsbehörden.
Zulassungen im internationalen Vergleich
[Bearbeiten | Quelltext bearbeiten]Aufgrund des Agranulozytoserisikos wurde Metamizol in vielen Ländern vom Markt genommen bzw. nicht zugelassen, unter anderem in Schweden, Norwegen, Dänemark, Island, Frankreich, Griechenland, Irland, Australien, Japan, Singapur, Kanada, im Vereinigten Königreich, in den USA, Venezuela, Marokko, Nigeria und Saudi-Arabien.[73][80][81] In Indien war Metamizol von Juni 2013 bis Februar 2014 verboten.[82][83]
In manchen Ländern ist Metamizol bis heute rezeptfrei (over the counter) erhältlich, so z. B. in Russland,[84] Polen,[85] Bulgarien,[86] der Türkei, Ägypten, Brasilien,[87] Mexiko[88] und Israel.
In der DDR war Metamizol unter dem Markennamen Analgin bis 1985 rezeptfrei erhältlich. In der Bundesrepublik Deutschland beschloss „der Bundesrat […] am 19. Dezember 1986, noch kurz vor Weihnachten, die Rezeptpflicht“,[89] die 1987 in Kraft trat.[35] Die Zulassungsgeschichte in Deutschland seit 1981 wurde 2015 in einer historischen Darstellung von Peter Schönhöfer und Jörg Schaaber beschrieben, und zwar auch unter Berücksichtigung der Verflechtung von Behörden, Pharma-Industrie und Forschern.[90]
In der Schweiz ist Metamizol nur für starke Schmerzen und hohes Fieber, die auf andere Maßnahmen nicht ansprechen, zugelassen, gehört aber trotzdem zu den meistverabreichten Arzneien.[91] Laut einem Bericht der Neuen Zürcher Zeitung von 2019 stand es in Alters- und Pflegeheimen zu diesem Zeitpunkt nach Paracetamol auf Platz zwei.[91]
Marktstellung in Deutschland
[Bearbeiten | Quelltext bearbeiten]Trotz der Indikationseinschränkungen vervierzehnfachte sich die Zahl der verordneten Tagesdosen (Defined Daily Dose, für Metamizol definiert mit drei Gramm bei Erwachsenen[92]) in Deutschland im ambulanten Bereich von circa 10 Millionen Tagesdosen im Jahr 1990 über 85,8 Millionen Tagesdosen im Jahr 2007[93] und mehr als 110 Millionen im Jahr 2009[35] auf mehr als 140 Millionen im Jahr 2012.[61] Allein im Jahr 2013 betrug der Verkaufswert von Metamizol-Produkten, die von der gesetzlichen Krankenversicherung (GKV) in Deutschland erstattet wurden, mehr als 214 Millionen Euro.[94]
Bei den privaten Krankenversicherungen (PKV) in Deutschland belegte das Metamizol-Produkt Novalgin des Herstellers Sanofi (vormals Hoechst AG) im Jahr 2010 Rang 16 der verordnungshäufigsten und mit einem Anteil von 0,13 % Rang 130 der umsatzstärksten Medikamente. Im selben Jahr erreichte ein Nachahmerpräparat (Generikum) des Herstellers Ratiopharm mit dem generischen Namen Novaminsulfon Rang 3 der verordnungshäufigsten Medikamente im Bereich der GKV.[95]
Bei den nichtopioiden Analgetika ist seit 2010 ein auffälliger Wandel eingetreten. Die Verordnungen von Acetylsalicylsäure und Paracetamol sind in den darauffolgenden zehn Jahren um fast 70 % zurückgegangen, während das rezeptpflichtige Metamizol häufiger verordnet wurde.[96]
Anwendungsformen und Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Metamizol ist in verschiedenen Darreichungsformen im Handel: Tabletten, Brausetabletten, Tropfen, Zäpfchen und Injektionslösung zur intravenösen oder intramuskulären Gabe.
Humanmedizin
[Bearbeiten | Quelltext bearbeiten]- Monopräparate: Analgin (D), Berlosin (D), Metagelan (A), Minalgin (CH), Metamizol-1A /-Abz /-Aristo /-Heumann /-Hexal /-Zentiva (D), Nopain (D), Norgesic N, Novalgin (D, A, CH), Novaminsulfon -1A /-Abz /-Ratiopharm /-Zentiva (D), Nolotil (E), Optalgin (ISR)
- Kombinationspräparate mit Metamizol sind für eine humanmedizinische Verwendung in der Bundesrepublik Deutschland bereits seit 1987 nicht mehr verkehrsfähig, nachdem das Bundesgesundheitsamt metamizolhaltige Kombinationsarzneimittel als bedenklich eingestuft hatte.[97] Auch in den USA, Australien, Japan sowie in den meisten Ländern Europas sind metamizolhaltige Kombinationsarzneimittel verboten. In Ländern wie Brasilien, Kolumbien und Costa Rica werden solche Präparate weiterhin verkauft, z. B. Buscopan composto (BR).[98]
- Würzburger Schmerztropf
Tiermedizin
[Bearbeiten | Quelltext bearbeiten]- Monopräparate: Metapyrin (D), Novaminsulfon (D), Novacoc forte (A), Novacen (D), Novasul (A), Vetalgin (A)
- Kombinationspräparate mit Butylscopolaminbromid: Buscopan compositum (D, A), Buscosol (D), Spasmium comp. (D, A)
Synthese
[Bearbeiten | Quelltext bearbeiten]Metamizol-Natrium (6) kann aus dem Phenazonderivat 1 und Benzaldehyd (2) synthetisiert werden:

Dabei entsteht zunächst das Imin 3, das mit Dimethylsulfat methyliert wird und so die quartäre Ammoniumverbindung 4 ausbildet. Diese wird anschließend zu 5 hydrolysiert und reagiert dann abschließend unter Zugabe von Formaldehyd und Natriumhydrogensulfit zu Metamizol-Natrium (6).[99]
Hinweis
[Bearbeiten | Quelltext bearbeiten]Metamizol darf nicht mit Methimazol, Metamucil (Flohsamen) und Methazolamid verwechselt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Vorgeschlagener Freiname – Proposed INN, List 53. WHO, 1985.
- ↑ Heinz Walter, Günter Thiele (Hrsg.): Reallexikon der Medizin und ihrer Grenzgebiete. Loseblattsammlung, Band 5 (Mem–Rz). Verlag Urban & Schwarzenberg, München / Berlin / Wien 1973, ISBN 3-541-84005-6, S. N 110.
- ↑ Berthold Göber, J. Böttger, S. Pfeifer: Beiträge zur rationellen und einheitlichen Gestaltung der Identitätsprüfung im DAB 8.2. In: Die Pharmazie. Band 26, Nr. 3, März 1971, OCLC 104483961, S. 137–152.
- ↑ a b Eintrag METAMIZOLE SODIUM CRS Monohydrate beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 16. Oktober 2008.
- ↑ Patent DE617237: Verfahren zur Darstellung von ω-Methylsulfonsäuren primärer oder sekundärer Pyrazolonamine. Veröffentlicht am 15. August 1935, Anmelder: I. G. Farbenindustrie, Erfinder: Max Bockmühl und Leonhard Stein.
- ↑ a b Datenblatt Dipyron monohydrate bei Sigma-Aldrich, abgerufen am 7. November 2021 (PDF).
- ↑ Ernst Mutschler: Arzneimittelwirkungen. 9. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1. S. 251.
- ↑ ema.europa.eu
- ↑ Wolfgang Löscher, Fritz Rupert Ungemach, Reinhard Kroker: Pharmakotherapie bei Haus- und Nutztieren. Paul Parey Verlag, Stuttgart 2006, ISBN 978-3-8304-4160-1, S. 103–108 und 364–380.
- ↑ Europäisches Arzneibuch. 9. Ausgabe. Grundwerk 2017. Amtliche deutsche Ausgabe (Ph. Eur. 9.0), Deutscher Apotheker Verlag. S. 5469.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Metamizol: CAS-Nr.: 50567-35-6, EG-Nr.: 256-627-7, ECHA-InfoCard: 100.051.462, PubChem: 3111, ChemSpider: 3000, DrugBank: DBDB04817, Wikidata: Q56719288.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Metamizol-Calcium: CAS-Nr.: 51996-59-9, EG-Nr.: 257-592-0, ECHA-InfoCard: 100.052.339, PubChem: 21117887, ChemSpider: 19975821, Wikidata: Q27289576. (Metamizol-Hemicalcium).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Metamizol-Magnesium: CAS-Nr.: 6150-97-6, EG-Nr.: 228-161-4, ECHA-InfoCard: 100.025.602, PubChem: 80253, ChemSpider: 72495, Wikidata: Q10266679. (Metamizol-Hemimagnesium).
- ↑ a b c d e f Kay Brune: The early history of non-opioid analgesics. In: Acute Pain. Band 1, Nr. 1, Dezember 1997, S. 33–40, doi:10.1016/S1366-0071(97)80033-2.
- ↑ Enrique Raviña Rubira: The Evolution of Drug Discovery: From Traditional Medicines to Modern Drugs. 2011, ISBN 978-3-527-32669-3, S. 26 f.
- ↑ Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. Wissenschaftliche Verlagsgesellschaft, 2. Auflage, Stuttgart 2005, ISBN 3-8047-2113-3, S. 138.
- ↑ Industriepark Hoechst > Bedeutende Mitarbeiter und Forscher aus der Standortgeschichte, abgerufen am 18. August 2022.
- ↑ Robert Berold, Wolf-Dieter Müller-Jahncke: Pyramidon – Nachgesang auf einen „Schnelldreher“. Geschichte der Pharmazie, Bd. 51, 1999, S. 39–47.
- ↑ Irina Nikolova, Jasmina Tencheva, Julian Voinikov, Valentina Petkova, Niko Benbasat, Nikolai Danchev: Metamizole: A Review Profile of a Well-Known „Forgotten“ Drug. Part I: Pharmaceutical and Nonclinical Profile. In: Biotechnology & Biotechnological Equipment. Band 26, Nr. 6, 2014, S. 3329–3337, doi:10.5504/BBEQ.2012.0089.
- ↑ Gustav Ehrhart, Heinrich Ruschig: Arzneimittel Entwicklung, Wirkung, Darstellung. Band 1, Verlag Chemie, 1968. S. 394.
- ↑ H. P. Kaufmann: Arzneimittel-Synthese. Springer Verlag, 1953. S. 63
- ↑ a b c Renaissance eines Analgetikums. In: Pharmazeutische Zeitung, Ausgabe 32/2006.
- ↑ Otto Dornblüth: Klinisches Wörterbuch. 21.–22. Auflage, Verlag von Walter de Gruyter & Co., Berlin / Leipzig 1934, S. 338.
- ↑ Hartwig Heyck: Der Kopfschmerz. 4. Auflage, Georg Thieme Verlag, Stuttgart 1975, ISBN 3-13-349704-9, S. 88.
- ↑ F. Danke: Schmerz. In: Hubert Feiereis, H.-J. Kabelitz (Hrsg.): Internistische Pharmakotherapie. Band 2 (M–Z), 1. Auflage, Hans Marseille Verlag, München 1985, ISBN 3-88616-015-7, S. 1215–1230.
- ↑ H. Boehncke: Schmerz. In: P. Schweier (Hrsg.): Pharmakotherapie im Kindesalter. 4. Auflage, Hans Marseille Verlag, München 1988, ISBN 3-88616-024-6, S. 838 f.
- ↑ Gerhard Schmidt: Analgetika. In: Ulrich Schwabe, Dieter Paffrath (Hrsg.): Arzneiverordnungs-Report 1992, Gustav Fischer Verlag, Stuttgart / Jena 1992, ISBN 3-437-11426-3, S. 29.
- ↑ K. O. Hauenstein, M. Litsch: Arzneiverordnungen in den neuen Bundesländern im Jahre 1991. In: Ulrich Schwabe, Dieter Paffrath (Hrsg.): Arzneiverordnungs-Report 1992, Gustav Fischer Verlag, Stuttgart / Jena 1992, ISBN 3-437-11426-3, S. 456–502.
- ↑ Anhang II zum Eintrag Metamizol im Arzneimittel-Unionsregister das EU-Verfahren vom 20. März 2019 betreffend. S. 26 (pdf)
- ↑ Willibald Pschyrembel: Klinisches Wörterbuch. 268. Auflage. Verlag Walter de Gruyter, Berlin/Boston 2020, ISBN 978-3-11-068325-7, S. 1109.
- ↑ Tinsley Randolph Harrison: Harrisons Innere Medizin. 20. Auflage, Georg Thieme Verlag, Berlin 2020, Band 1, ISBN 978-3-13-243524-7, S. 86.
- ↑ Gerd Harald Herold: Innere Medizin 2022. Selbstverlag, Köln 2021, ISBN 978-3-9821166-1-7, S. 658.
- ↑ Maxim Zetkin, Herbert Schaldach: Lexikon der Medizin, 16. Auflage, Ullstein Medical, Wiesbaden 1999, ISBN 978-3-86126-126-1, S. 1281.
- ↑ a b c d e f g h Fachinformation Metamizol Heumann Tropfen (Heumann Pharma), Stand Mai 2019; pdf (183 kB)
- ↑ a b c d e AkdÄ: Agranulozytose nach Metamizol – sehr selten, aber häufiger als gedacht. (PDF) 19. August 2011, abgerufen am 22. April 2017.
- ↑ Arzneimittelkommission der deutschen Ärzteschaft: Drug Safety Mail 2017–37 – Agranulozytose nach Einnahme von Metamizol, online 15. November 2017, Abruf am 26. September 2019
- ↑ Irene Schott-Seidenschwanz, Hans Wille, Bernd Mühlbauer: Todesfalle Metamizol? In: Bremer Ärztejournal – Mitteilungsblatt der Ärztekammer Bremen und der Kassenärztlichen Vereinigung Bremen, April 2011, 64. Jahrgang, S. 20; aekhb.de (PDF); abgerufen am 28. August 2015.
- ↑ Travelling to or from Australia with medicines and medical devices
- ↑ EMA recommends measures to minimise serious outcomes of known side effect with painkiller metamizole. In: ema.europa.eu. 6. September 2024, abgerufen am 28. September 2024 (englisch).
- ↑ Metamizolhaltige Arzneimittel: Risiko für Agranulozytose – erneute Überprüfung. Bundesinstitut für Arzneimittel und Medizinprodukte, 20. September 2024, abgerufen am 27. September 2024.
- ↑ BfArM - Rote-Hand-Briefe und Informationsbriefe - Rote-Hand-Brief zu metamizolhaltigen Arzneimitteln: Wichtige Maßnahmen zur Minimierung der schwerwiegenden Folgen des bekannten Risikos für Agranulozytose. 9. Dezember 2024, abgerufen am 12. Dezember 2024.
- ↑ Rote Liste Service GmbH (Hrsg.): Rote Liste 2022 – Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main 2022, 62. Ausgabe, ISBN 978-3-946057-74-1, Rubrik 1.B.2.1.3.1, Kapitel 05, Nummer 074, S. 245 f.
- ↑ F. Hoffmann, C. Bantel, K. Jobski: Agranulocytosis attributed to metamizole: An analysis of spontaneous reports in EudraVigilance 1985-2017. In: Basic & clinical pharmacology & toxicology. Band 126, Nummer 2, Februar 2020, S. 116–125, doi:10.1111/bcpt.13310, PMID 31449718, (freier Volltext).
- ↑ Diana Moll: Gefährliche Wechselwirkungen – Vorsicht bei Methotrexat mit Metamizol oder Cotrimoxazol. In: DAZ. 9. März 2023, abgerufen am 1. April 2024.
- ↑ Martin Lindig: Schmerz, Sedierung und Narkose. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 581–618, hier: S. 598 f. (Metamizol).
- ↑ a b D. Häske und andere: Analgesie bei Traumapatienten in der Notfallmedizin. In: Der Anaesthesist. Band 69, Nr. 2, Februar 2020, S. 137–148, hier: S. 140 f.
- ↑ Reviewed in: S. C. Pierre, R. Schmidt, C. Brenneis, M. Michaelis, G. Geisslinger, K. Scholich: Inhibition of cyclooxygenases by dipyrone. In: British Journal of Pharmacology. Band 151, Nummer 4, Juni 2007, S. 494–503, doi:10.1038/sj.bjp.0707239, PMID 17435797, PMC 2013970 (freier Volltext).
- ↑ R. Nassini, C. Fusi, S. Materazzi, E. Coppi, T. Tuccinardi, I. M. Marone, F. De Logu, D. Preti, R. Tonello, A. Chiarugi, R. Patacchini, P. Geppetti, S. Benemei: The TRPA1 channel mediates the analgesic action of dipyrone and pyrazolone derivatives. In: British Journal of Pharmacology. Band 172, Nummer 13, Juli 2015, S. 3397–3411, doi:10.1111/bph.13129, PMID 25765567, PMC 4500374 (freier Volltext).
- ↑ Heinz Lüllmann, Klaus Mohr, Martin Wehling, Lutz Hein (Hrsg.): Pharmakologie und Toxikologie. 18. Auflage. Georg Thieme, Stuttgart 2016, ISBN 978-3-13-368518-4, S. 349.
- ↑ E. A. Lux, E. Neugebauer, M. Zimmermann: Postoperative Akutschmerztherapie nach ambulanten Operationen mit Metamizol? In: Schmerz. Band 31, Nr. 4, 2017, S. 360–365. (doi:10.1007/s00482-017-0186-1).
- ↑ Deutsche Schmerzgesellschaft e. V. (Hrsg.): Basisbuch Q14 Schmerzmedizin. 2015, ISBN 978-3-00-051025-0, S. 59 (dgss.org).
- ↑ a b Bundesärztekammer: Arzneimittelkommission der deutschen Ärzteschaft – „UAW-News – International“: Psychiatrische Störungen unter Metamizol, online, Deutsches Ärzteblatt 2006, 103(8), A-499/B-431/C-411.
- ↑ S. Andrade, D. B. Bartels, R. Lange, L. Sandford, J. Gurwitz: Safety of metamizole: a systematic review of the literature. In: Journal of clinical pharmacy and therapeutics. Band 41, Nummer 5, Oktober 2016, S. 459–477, doi:10.1111/jcpt.12422, PMID 27422768 (Review).
- ↑ K. Hassan, K. Khazim, F. Hassan, S. Hassan: Acute kidney injury associated with metamizole sodium ingestion. In: Renal failure. Band 33, Nummer 5, 2011, S. 544–547, doi:10.3109/0886022X.2011.569107, PMID 21446784 (Review).
- ↑ T. Stueber, L. Buessecker, A. Leffler, H. J. Gillmann: The use of dipyrone in the ICU is associated with acute kidney injury: A retrospective cohort analysis. In: European journal of anaesthesiology. [elektronische Veröffentlichung vor dem Druck] März 2017, doi:10.1097/EJA.0000000000000627, PMID 28306590.
- ↑ BfArM – Rote-Hand-Briefe und Informationsbriefe – Rote-Hand-Brief zu Metamizol: Risiko für arzneimittelbedingten Leberschaden. (PDF) Abgerufen am 16. Dezember 2020.
- ↑ Leberschäden unter Metamizol (NOVALGIN, Generika). arznei-telegramm 12/2020.
- ↑ Ulrike M. Stamer, Ursula Gundert-Remy, E. Biermann, Joachim Erlenwein, Winfried Meißner, Stefan Wirz, Thomas Stammschulte: Dipyrone (metamizole): Considerations on monitoring for early detection of agranulocytosis. In: Schmerz, [elektronische Veröffentlichung vor dem Druck] Oktober 2016; doi:10.1007/s00482-016-0160-3, PMID 27766404, Volltext auf Deutsch. (PDF) Review; abgerufen am 27. Dezember 2016.
- ↑ Ulrike M. Stamer, Ursula Gundert-Remy, E. Biermann, J. Erlenwein, W. Meißner, S. Wirz u. a.: Metamizol: Überlegungen zum Monitoring zur frühzeitigen Diagnose einer Agranulozytose. In: Schmerz, 2017, Band 31, S. 5–13.
- ↑ a b Joachim Neumann: Von Metamizol abraten (Kommentar zu: B. Zernikow, T. Hechler: Schmerztherapie bei Kindern und Jugendlichen. In: Deutsches Ärzteblatt, 2008, Heft 28–29, S. 511–522). In: Deutsches Ärzteblatt International, Januar 2009, Jahrgang 106, Heft 4, S. 55–56; aerzteblatt.de abgerufen am 28. August 2015.
- ↑ a b c d Thomas Stammschulte, W. D. Ludwig, B. Mühlbauer, E. Bronder, Ursula Gundert-Remy: Metamizole (dipyrone)-associated agranulocytosis. An analysis of German spontaneous reports 1990–2012. In: European Journal of Clinical Pharmacology. Band 71, Nummer 9, September 2015, S. 1129–1138, doi:10.1007/s00228-015-1895-y, PMID 26169297.
- ↑ No authors listed: Risks of agranulocytosis and aplastic anemia. A first report of their relation to drug use with special reference to analgesics. The International Agranulocytosis and Aplastic Anemia Study. In: The Journal of the American Medical Association (JAMA). Band 256, Nummer 13, Oktober 1986, S. 1749–1757, PMID 3747087.
- ↑ C. P. H. van Dijke: Analgesic Use, Agranulocytosis, and Aplastic Anemia. In: JAMA: The Journal of the American Medical Association. 257, 1987, S. 2590, doi:10.1001/jama.1987.03390190068009.
- ↑ Literaturübersicht der Kritik in: Andrew Chetley: A drug no-one needs (Critical review of dipyrone incl. bibliography and list of brand name products containing dipyrone, HAI-Europe/BUKO BUKO Pharma-Kampagne 1989). Health Action International, 1993; bukopharma.de ( vom 23. September 2015 im Internet Archive; PDF)abgerufen am 30. August 2015.
- ↑ K. Hedenmalm, O. Spigset: Agranulocytosis and other blood dyscrasias associated with dipyrone (metamizole). European Journal of Clinical Pharmacology. 2002 Jul; 58 (4): S. 265–274. PMID 12136373.
- ↑ Wie gefährlich ist Metamizol? ( vom 27. Juni 2009 im Internet Archive) In: Der Arzneimittelbrief, 2003, 37, 6b.
- ↑ T. Kötter, B. R. da Costa, M. Fässler, E. Blozik, K. Linde, P. Jüni, S. Reichenbach, M. Scherer: Metamizole-associated adverse events: a systematic review and meta-analysis. In: PLOS ONE, 2015, Band 10, Nummer 4, S. e0122918, doi:10.1371/journal.pone.0122918, PMID 25875821, PMC 4405027 (freier Volltext) (Review).
- ↑ S. Klose, M. Schwaninger, F. Verheyen, R. Linder: Pharmakovigilanzforschung mit GKV-Routinedaten: Wie hoch ist das Risiko für Agranulozytose in Deutschland?. In: Zeitschrift für Palliativmedizin. 15 – PD292, Mai 2014, doi:10.1055/s-0034-1374463.
- ↑ T. Kötter, B. R. da Costa, M. Fässler, E. Blozik, K. Linde, P. Jüni, S. Reichenbach, M. Scherer: Metamizol-assoziierte unerwünschte Arzneimittelwirkungen: Eine systematische Übersicht mit Metaanalyse. In: Zeitschrift für Allgemeinmedizin, Jahrgang 92, Nummer 2, 2016, S. 72–78, doi:10.3238/zfa.2016.0072–0078, PDF ( vom 5. Januar 2017 im Internet Archive), abgerufen am 5. Januar 2017.
- ↑ Wolfgang Löscher et al.: Pharmakotherapie bei Haus- und Nutztieren. Paul Parey Verlag, 7. Auflage, Berlin / Wien 2006, ISBN 978-3-8304-4160-1, S. 107–108.
- ↑ Eugen J. Verspohl: Analgetika mit antipyretischer und antiphlogistischer Wirkungskomponente. In: Hermann Philipp Theodor Ammon u. a. (Hrsg.): Arzneimittelneben- und -wechselwirkungen: Ein Handbuch und Tabellenwerk für Ärzte und Apotheker, 4. neu bearbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2001, ISBN 978-3-8047-1717-6, S. 420–424.
- ↑ Justin Westhoff: Es tötet nicht nur den Schmerz. In: Die Zeit, Nr. 28/1981.
- ↑ a b Consolidated List of Products Whose Consumption and/or Sale Have Been Banned, Withdrawn, Severely Restricted of Not Approved by Governments. 12. Auflage. United Nations, Department of Economic and Social Affairs (UN-Sekretariat), New York 2005, S. 171–175 (un.org [PDF; abgerufen am 27. August 2015]).
- ↑ Novaminsulfon – Anwendung, Nebenwirkungen, Wechselwirkungen. 9. November 2015, abgerufen am 28. November 2019.
- ↑ J. Graff, M. Arabmotlagh, R. Cheung, G. Geisslinger, S. Harder: Effects of parecoxib and dipyrone on platelet aggregation in patients undergoing meniscectomy: a double-blind, randomized, parallel-group study. Clinical Therapeutics 2007; 29, S. 438–447.
- ↑ G. Geisslinger, B. Peskar, D. Pallapies, R. Sittl, M. Levy, Kay Brune: The effects on platelet aggregation and prostanoid biosynthesis of two parenteral analgesics: ketorolac tromethamine and dipyrone. In: Thrombosis and Haemostasis, 1996, Band 76, S. 592–597.
- ↑ N. Bacracheva, N. Tyutyulkova u. a.: Effect of cimetidine on the pharmacokinetics of the metabolites of metamizol. In: International Journal of Clinical Pharmacology and Therapeutics, Juli 1997, Band 35, Nummer 7, S. 275–281, PMID 9247840.
- ↑ Igho J. Onakpoya, Carl J. Heneghan, Jeffrey K. Aronson: Delays in the post-marketing withdrawal of drugs to which deaths have been attributed: a systematic investigation and analysis. In: BMC Medicine, 2015, Band 13, S. 26; doi:10.1186/s12916-014-0262-7, PMID 25651859, PMC 4318389 (freier Volltext).
- ↑ Joel Lexchin: Why are there deadly drugs? In: BMC Medicine, 2015, Band 13, S. 27; doi:10.1186/s12916-015-0270-2, PMID 25656293, PMC 4318445 (freier Volltext).
- ↑ Metamizol – neuerliches Verbot in Schweden. In: Pharmainformation, September 1999, Jahrgang 14, Nr. 3; abgerufen am 29. August 2015.
- ↑ Department of Economic and Social Affairs of the United Nations Secretariat Consolidated List of Products Whose Consumption and/or Sale Have Been Banned, Withdrawn, Severely Restricted or not Approved by Governments Fourteenth Issue (New data only) (Januar 2005 – Oktober 2008): Pharmaceuticals. (PDF) United Nations, 2009; abgerufen am 5. Januar 2017.
- ↑ Soumyadeep Bhaumik: India's health ministry bans pioglitazone, metamizole, and flupentixol-melitracen. In: BMJ (Clinical research edition), 2013, Band 347, S. f4366; PMID 23833116.
- ↑ Govt lifts ban on painkiller Analgin. Business Standard; abgerufen am 7. November 2018.
- ↑ essentialdrugs.org: Metamizole in your country? ( vom 10. Mai 2003 im Internet Archive)
- ↑ G. W. Basak, J. Drozd-Sokolowska, W. Wiktor-Jedrzejczak: Update on the incidence of metamizole sodium-induced blood dyscrasias in Poland. In: The Journal of International Medical Research. Band 38, Nummer 4, 2010 Jul-Aug, S. 1374–1380, PMID 20926010.
- ↑ analgin.bg: Curious Facts ( vom 30. November 2010 im Internet Archive)
- ↑ Isabela M. Benseñor: To use or not to use dipyrone? Or maybe, Central Station versus ER? That is the question. In: Sao Paulo Medical Journal, Band 119, Nummer 6, São Paulo November 2001, doi:10.1590/S1516-31802001000600001.
- ↑ Joshua L. Bonkowsky, J. Kimble Frazer, Karen F. Buchi, Carrie L. Byington: Metamizole Use by Latino Immigrants: A Common and Potentially Harmful Home Remedy. In: Pediatrics. 109, 2002, S. e98–e98, doi:10.1542/peds.109.6.e98.
- ↑ Helmut Kewitz: Metamizol – Führt die Indikationseinschränkung zu einem Rückgang der Agranulozytose?, Deutsches Ärzteblatt, Jahrgang 84, Heft 28/29. Deutscher Ärzteverlag, 11. Juli 1987, S. A-1972; online [1]
- ↑ Peter Schönhöfer, Jörg Schaaber: Berliner Weißwäscher – Neue Studie zur Metamizol-induzierten Agranulozytose mit alten Fehlern. In: Pharma-Brief, Juli/August 2015, Nr. 6, S. 3–5; bukopharma.de (PDF; 0,4 MB); abgerufen am 12. Juli 2018.
- ↑ a b Theres Lüthi: Wie gefährlich ist das «Wundermittel» Novalgin wirklich? In: Neue Zürcher Zeitung. 2. März 2019, abgerufen am 4. Januar 2021.
- ↑ Anatomisch-therapeutisch-chemische Klassifikation mit Tagesdosen. Amtliche Fassung des ATC-Index mit DDD-Angaben für Deutschland im Jahre 2009. Deutsches Institut für Medizinische Dokumentation und Information.
- ↑ Ulrich Schwabe, Dieter Paffrath (Hrsg.): Arzneiverordnungs-Report 2008. Springer Medizin Verlag, Heidelberg 2008, ISBN 978-3-540-69218-8.
- ↑ Ulrich Schwabe, Dieter Paffrath (Hrsg.): Arzneiverordnungs-Report 2014. Aktuelle Daten, Kosten, Trends und Kommentare, Springer-Verlag 2014, ISBN 3-662-43487-3, S. 1160.
- ↑ Frank Wild: Arzneimittelversorgung der Privatversicherten 2010: Zahlen, Analysen, PKV-GKV-Vergleich. WIP (Wissenschaftliches Institut der PKV), Köln 2012, ISBN 978-3-9813569-1-5, S. 56 f., 113 und 120; wip-pkv.de (PDF; 1,1 MB); abgerufen am 23. Juni 2017.
- ↑ Rainer H. Böger, Gerhard Schmidt: Analgetika. In: Ulrich Schwabe, Wolf-Dieter Ludwig: Arzneiverordnungs-Report 2020. Springer-Verlag, Berlin / Heidelberg 2020, ISBN 978-3-662-62167-7, S. 261–278. doi:10.1007/978-3-662-62168-4.
- ↑ Kombinationsschmerzmittel. In: Deutsches Ärzteblatt. Band 84, Nr. 19. Deutscher Ärzte-Verlag, 7. Mai 1987, S. A-1310 (Bekanntgabe der Arzneimittelkommission der deutschen Ärzteschaft: Vertriebsstopp für 62 Metamizol-haltige).
- ↑ Boehringer Ingelheim will umstrittenes Medikament weiter verkaufen. SWR, 23. Oktober 2012, abgerufen am 11. Dezember 2012.
- ↑ Axel Kleemann, Jürgen Engel, Bernhard Kutscher, Dietmar Reichert: Pharmaceutical Substances – Syntheses, Patents and Applications of the most relevant APIs. 5. Auflage, Georg Thieme Verlag, Stuttgart/New York 2009, ISBN 978-3-13-558405-8, S. 860–861.