Osteonectin
Zur Navigation springen
Zur Suche springen
| Osteonectin | ||
|---|---|---|
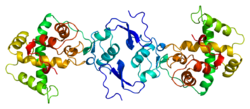
| ||
| Bändermodell eines verkürzten Osteonectin-Trimers (Aminosäuren 71-303), nach PDB 1BMO | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 286 Aminosäuren | |
| Kofaktor | Ca2+ | |
| Bezeichner | ||
| Gen-Namen | SPARC BM-40; ON | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | mehrzellige Tiere[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 6678 | 20692 |
| Ensembl | ENSG00000113140 | ENSMUSG00000018593 |
| UniProt | P09486 | P07214 |
| Refseq (mRNA) | NM_001309443 | NM_001290817 |
| Refseq (Protein) | NP_001296372 | NP_001277746 |
| Genlocus | Chr 5: 151.66 – 151.69 Mb | Chr 11: 55.39 – 55.42 Mb |
| PubMed-Suche | 6678 | 20692
|
Osteonectin (auch englisch Secreted protein acidic and rich in cysteine und kurz SPARC genannt) ist ein Glykoprotein, das von tierischen Zellen abgesondert (sezerniert) wird. Es wird in der extrazellulären Matrix in nahezu allen Geweben während Umbau- und Entwicklungsvorgängen sowie Krankheiten exprimiert. Es ist in der Lage, mehrere Calcium-Ionen aufzunehmen und bindet an nahezu alle Matrixproteine, Wachstumsfaktoren, Serumalbumin und an Zellen. Es reguliert Zell-Matrix-Wechselwirkungen und moduliert Zellwanderungen (Zellmigration) und ist damit unter anderem in der Wundheilung und im Knochenstoffwechsel von Bedeutung.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Thomas Kreis, Ronald Vale: Guidebook to the extracellular matrix, anchor, and adhesion proteins; Oxford University Press; 2. Auflage 1999; ISBN 9780198599586; Seite 480