4-Pentenal
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Pentenal | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H8O | ||||||||||||||||||
| Kurzbeschreibung |
klare farblose[1] Flüssigkeit | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Diethylether, Aceton[3] und in Dichlormethan[4] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
4-Pentenal ist ein linearer C5-Aldehyd mit einer endständigen Doppelbindung. Die Verbindung ist u. a. durch Hydroformylierung von 1,3-Butadien zugänglich und dient als Ausgangsstoff für 4-Pentensäure, Cyclopentanon und Adipaldehyd (Hexandial), einer möglichen Vorstufe für Adipinsäure.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]4-Pentenal entsteht bei der Oxidation von 4-Penten-1-ol (aus Tetrahydrofurfurylalkohol zugänglich[5]) mit Chrom(VI)-salzen, wie z. B. dem Collins-Reagenz[6] oder Chromylchlorid (CrO2Cl2)[7] Der Einsatz von krebserregenden Chrom(VI)-Verbindungen und die geringen erzielten Ausbeuten (ca. 40 %) schränken die Brauchbarkeit beider Verfahrensvarianten stark ein.
Eine cyclopentenreiche Steamcrackerfraktion kann mit Distickstoffmonoxid N2O u. a. zu 4-Pentenal oxidiert werden.[8]
Die einfache Hydroformylierung von 1,3-Butadien liefert ein Gemisch von Pentenalen, in dem das 3-Pentenal überwiegt, das durch katalytische Isomerisierung in 4-Pentenal überführt werden kann.[9]
Die [3+3]-sigmatrope Umlagerung (Claisen-Umlagerung) von Allylvinylether (aus Ethylvinylether über die Zwischenstufe n-Octylvinylether[10] oder n-Butylvinylether[11] und Allylalkohol in Gegenwart von Quecksilber(II)-acetat erzeugt 4-Pentenal in Ausbeuten > 60 %.[12][13][14]

Die 4-Pentenalvorstufe Acetaldehyddiallylacetal[15] aus Allylalkohol und Acetaldehyd, die ihrerseits aus den nachwachsenden Rohstoffen Glycerin bzw. Ethanol zugänglich sind, spaltet unter Säurekatalyse Allylalkohol ab und geht in Allylvinylether über, der durch Erhitzen auf > 320 °C mit hoher Selektivität in 4-Pentenal umgelagert wird.[16][14]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]4-Pentenal ist eine klare farblose Flüssigkeit, die sich in Wasser praktisch nicht, jedoch in Diethylether und Aceton löst.[3] Die Substanz ist als ungesättigter Aldehyd luftempfindlich.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]4-Pentenal lässt sich einfach mit Sauerstoff in einem Blasensäulenreaktor zu 4-Pentensäure oxidieren.[8]
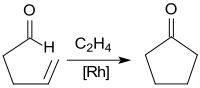
Mithilfe von Rhodiumkatalysatoren kann 4-Pentenal in einer Ethylenatmosphäre unter milden Bedingungen praktisch quantitativ zu Cyclopentanon cyclisiert werden.[17][4]
Bei der zweifachen Hydroformylierung von 4-Pentenal mit Synthesegas (CO/H2-Gemisch) an Rhodiumkatalysatoren bildet sich mit hoher Selektivität Adipaldehyd (1,6-Hexandial)[18][9]

Hexandial ist eine vielseitige Ausgangsverbindung, aus der durch Oxidation Adipinsäure, durch Reduktion 1,6-Hexandiol, über das entsprechende Aldoxim und Adiponitril das Diamin 1,6-Hexandiamin und durch Tischtschenko-Reaktion ε-Caprolacton zugänglich sind, die als Monomere für Polyamide und Polyester von großer industrieller Bedeutung sind.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Datenblatt 4-Pentenal bei Alfa Aesar, abgerufen am 1. Februar 2021 (Seite nicht mehr abrufbar).
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 51.
- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics, 93th Edition. CRC Press, Boca Raton, FL, U.S.A. 2012, ISBN 978-1-4398-8050-0, S. 3–440.
- ↑ a b Patent US4288613: Cyclopentanone synthesis. Angemeldet am 3. Dezember 1979, veröffentlicht am 8. September 1981, Anmelder: Iowa State University Research Foundation, Inc., Erfinder: R.C. Larock.
- ↑ L.A. Brooks, H.R. Snyder: 4-Penten-1-ol In: Organic Syntheses. 25, 1945, S. 84, doi:10.15227/orgsyn.025.0084; Coll. Vol. 3, 1955, S. 698 (PDF).
- ↑ R. Ratcliffe, R. Rodehorst: Improved procedure for oxidation with the chromium trioxide-pyridine complex. In: J. Org. Chem. Band 35, Nr. 11, 1970, S. 4000–4002, doi:10.1021/jo00836a108.
- ↑ K. Barry Sharpless, K. Akashi: Oxidation of alcohols to aldehydes by reagents derived from chromyl chloride. In: J. Amer. Chem. Soc. Band 97, Nr. 20, 1975, S. 5927–5928, doi:10.1021/ja00853a055.
- ↑ a b Patent WO2011020878A2: Verfahren zur Herstellung von 4-Pentensäure. Angemeldet am 19. August 2010, veröffentlicht am 24. Februar 2011, Anmelder: BASF SE, Erfinder: J.H. Teles, M. Schelper, K. Gumlich, M. Chabanas, C. Müller, A. Meier.
- ↑ a b M.-J. Tenorio, R.V. Chaudhari, B. Subramaniam: Rh-catalyzed hydroformylation of 1,3-butadiene and pent-4-enal to adipaldehyde in CO2-expanded media. In: Ind. Eng. Chem. Res. Band 58, Nr. 50, 2019, S. 22526–22533, doi:10.1021/acs.iecr.9b05184.
- ↑ L. Kupozyk-Subotkowska, W.H. Saunders Jr., H.J. Shine, W. Subotkowski: Thermal rearrangement of allyl vinyl ether: heavy-atom kinetic isotope effects and the transition structure. In: J. Amer. Chem. Soc. Band 115, Nr. 14, 1993, S. 5957–5961, doi:10.1021/ja00067a009.
- ↑ W.H. Watanabe, L.E. Conlon: Homogeneous metal salt catalysis in organic reactions. I. The preparation of vinyl ethers by vinyl transetherification. In: J. Amer. Chem. Soc. Band 79, Nr. 11, 1957, S. 2828–2833, doi:10.1021/ja01568a044.
- ↑ R.F. Webb, A.J. Duke, J.A. Parsons: α-Allylated acetaldehydes. In: J. Chem. Soc. 1961, S. 4092–4095, doi:10.1039/JR9610004092.
- ↑ L.K. Montgomery, J.W. Matt: Homoallylic free-radical rearrangements. Rearrangements of the allylcarbinyl radicals. In: J. Amer. Chem. Soc. Band 89, Nr. 25, 1967, S. 6556–6564, doi:10.1021/ja01001a031.
- ↑ a b Stefan Günther: Synthese von Polymeren ausgehend vom nachwachsenden Rohstoff Glycerin, Dissertation. Universität Hamburg 2012 (uni-hamburg.de [PDF]).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Acetaldehyddiallylacetal: CAS-Nr.: 20682-69-3, PubChem: 225379, ChemSpider: 195917, Wikidata: Q82012882.
- ↑ Patent EP0287956A2: Verfahren zur Herstellung von 5-Formylvaleriansäureestern oder den entsprechenden Acetalen. Angemeldet am 14. April 1988, veröffentlicht am 26. Oktober 1988, Anmelder: BASF AG, Erfinder: F. Merger, W. Bertleff, J. Liebe.
- ↑ C.F. Lochow, R.G. Miller: Transition-metal-promoted aldehyde-alkene addition reactions. In: J. Amer. Chem. Soc. Band 98, Nr. 5, 1976, S. 1281–1283, doi:10.1021/ja00421a050.
- ↑ J. Mormul, M. Mulzer, T. Rosendahl, F. Rominger, M. Limbach, P. Hofmann: Synthesis of adipic aldehyde by n-selective hydroformylation of 4-pentenal. In: Organometallics. Band 34, Nr. 16, 2015, S. 4102–4108, doi:10.1021/acs.organomet.5b00538.

