Perflunafen
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
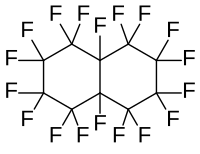
| ||||||||||||||||||||||
| Struktur ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Perflunafen[1] | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10F18 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 462,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Brechungsindex |
1,3145 (25 °C) (cis/trans)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Treibhauspotential |
7977 (bezogen auf 100 Jahre)[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Perflunafen (Perfluordecalin) ist eine chemische Verbindung aus der Gruppe der Perfluorcarbone.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Perflunafen ist eine farblose, inerte Flüssigkeit und nicht mit Wasser mischbar. Es hat eine hohe Dichte und gilt als ungiftig. Allerdings ist die Verbindung in der Luft stabil und hat ein hohes Treibhauspotential.[8][9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Perflunafen wird bei bestimmten Augenoperationen verwendet, etwa um verlagerte Linsen (Linsenluxation) aus dem Glaskörper zu entfernen, oder auch im Rahmen der sogenannten Pars-plana-Vitrektomie, um die Netzhaut zu entfalten und wieder zurückzulegen. In Kosmetika kommt Perflunafen unter anderem zur Verbesserung der Kämmbarkeit zum Einsatz.[10][11] In der Literatur ist die mögliche Eignung von Perflunafen als Blutersatz und als Kontrastmittel für Ultraschalluntersuchungen beschrieben, ferner für Hautzubereitungen zur Behandlung von Wunden und Verbrennungen sowie für die Flüssigkeitsbeatmung. Für in Glasmikrokugeln zu verkapselnde Impfstoffe könnte Perflunafen als inerte Trägerlösung in Frage kommen. Für organische und metallorganische Synthesen dient es als Reaktionsmedium. Des Weiteren wird es zur Gasmodifizierung von Schmiermitteln und zur Prüfung der Umweltqualität von Meeres- und Grundwasser eingesetzt.[12]
Isomerie
[Bearbeiten | Quelltext bearbeiten]Von Perflunafen gibt es zwei Isomere, die cis- und die trans-Form.[13] Das verwendete technische Produkt enthält beide Isomere in etwa gleicher Konzentration.[11]
-
cis
-
trans
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]- Reinstoff: Flutec PP6
- Medizinische Fertigpräparate für die Augenheilkunde: DK-Line (D), Vitreo Deca (D), RT Decalin (D)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ INN Recommended List 21, World Health Organisation (WHO), 9. Mai 1981.
- ↑ Eintrag zu PERFLUORODECALIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ a b c Pharmazeutische Stoffliste, 12. Ausgabe 2001, Werbe- und Vertriebsgesellschaft Deutscher Apotheker
- ↑ a b c d e Carl L. Yaws: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals: Physical Properties for More Than 54,000 Organic and Inorganic Chemical Compounds, Coverage for C1 to C100 Organics and Ac to Zr Inorganics. Gulf Professional Publishing, 2015, ISBN 978-0-12-801146-1 (books.google.com).
- ↑ a b Datenblatt Perfluorodecalin bei Sigma-Aldrich, abgerufen am 28. November 2012 (PDF).
- ↑ Eintrag zu Perflunafene in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 5. August 2016. (Seite nicht mehr abrufbar)
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- ↑ Keith P. Shine et al.: Perfluorodecalin: global warming potential and first detection in the atmosphere. In: Atmospheric Environment 39(9), 2005, 1759–1763, doi:10.1016/j.atmosenv.2005.01.001.
- ↑ Wen-Tien Tsai: Environmental Property Modeling of Perfluorodecalin and its Implications for Environmental Fate and Hazards. In: Aerosol and Air Quality Research 11, 2011, 903–907, doi:10.4209/aaqr.2010.12.0106.
- ↑ Marina Bährle-Rapp: Springer Lexikon Kosmetik und Körperpflege. Springer-Verlag, 2012, ISBN 978-3-642-24688-3 (S. 434 in der Google-Buchsuche).
- ↑ a b B. Gschrey, W. Schwarz, T. Kimmel, B. Zeiger, S. Reitz: Implementierung der ab dem Berichtsjahr 2013 gültigen IPCC Guidelines for National Greenhouse Gas Inventories 2006 in die Inventarerhebung fluorierter Treibhausgase (HFKW, FKW, SF6, NF3) (PDF; 2,6 MB), in: Climate Change 17/2015, Hrsg.: Umweltbundesamt, S. 111 ff.
- ↑ Wen-Tien Tsai: Environmental Property Modeling of Perfluorodecalin and its Implications for Environmental Fate and Hazards. In: Aerosol and Air Quality Research. Band 11, 2011, S. 903, doi:10.4209/aaqr.2010.12.0106.
- ↑ Hans-Georg Mack, Heinz Oberhammer: The gas-phase structures of trans- and cis-perfluorodecalin. In: Journal of Molecular Structure 197, 1989, S. 321–328, doi:10.1016/0022-2860(89)85172-5.

