Polyphosphorsäuren
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
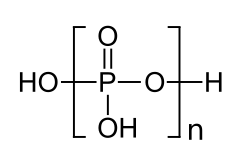
| |||||||
| Allgemeines | |||||||
| Name | Polyphosphorsäure, Diphosphorpentoxid-Gehalt von ca. 85 % | ||||||
| Andere Namen |
PPA | ||||||
| CAS-Nummer | 8017-16-1 | ||||||
| EG-Nummer | 232-417-0 | ||||||
| ECHA-InfoCard | |||||||
| Monomer | Orthophosphorsäure | ||||||
| Summenformel der Wiederholeinheit | HPO3 | ||||||
| Molare Masse der Wiederholeinheit | 79,97 g/mol | ||||||
| Art des Polymers |
Monomer | ||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[1] | ||||||
| Eigenschaften | |||||||
| Aggregatzustand |
flüssig[1] | ||||||
| Dichte |
2,06 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
hydrolysiert in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Polyphosphorsäuren sind chemische Verbindungen aus der Gruppe der Phosphorverbindungen. Es sind von der Orthophosphorsäure H3PO4 durch Dehydratisierung abgeleitete ketten- oder ringförmige Polymere, in denen die [PO4]-Tetraeder über Sauerstoffbrücken miteinander verknüpft sind.[2] Zur besseren Unterscheidung von den kettenförmigen Polyphosphorsäuren werden ringförmige Polyphosphorsäuren als Metapolyphosphorsäuren und Polyphosphorsäuren mit verzweigten Ketten als Ultraphosphorsäuren bezeichnet.[3] Die Verbindung kommt mit unterschiedlichen Gehalten an Diphosphorpentoxid P2O5 in den Handel. Die Angaben in der Box beziehen sich auf ein handelsübliches Produkt mit einem Diphosphorpentoxid-Gehalt von ca. 85 %.[1] Die Salze der Polyphosphorsäuren werden als Polyphosphate (systematisch: catena-Polyphosphate) bzw. Metapolyphosphate bezeichnet.[4]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Ketten und ringförmige Polyphosphorsäuren bilden sich beim Erwärmen über 300 °C via Kondensationsreaktionen (Wasserabspaltung). Die einfachsten Vertreter sind Diphosphorsäure, auch als Pyrophosphorsäure bezeichnet, und Triphosphorsäure, die durch Kondensation von zwei beziehungsweise drei Orthophosphorsäuremolekülen im Drehrohrofen bei Temperaturen zwischen 400 und 600 °C entstehen. Je nach Zeitdauer der Wärmeeinwirkung und Temperatur kann der Kondensationsgrad n bis auf 10.000 anwachsen.[4]
Die Pyrophosphorsäure ist die einzige von den linearen Polyphosphorsäuren, die leicht in kristalliner Form erhalten werden kann. Sie besitzt einen theoretischen Diphosphorpentoxid-Gehalt von 79,8 %. Bringt man eine flüssige Säure mit dieser Konzentration zum Kristallisieren, erhält man Pyrophosphorsäure (Form I), die gewöhnliche Form (Schmelztemperatur 54,3 °C), als weißen Festkörper. Wird die kristalline Form I in einem abgeschlossenen Rohr mehrere Stunden auf 50 °C erhitzt, dann erfolgt eine Umwandlung in eine Form II (Schmelztemperatur 71,5 °C), die bei Raumtemperatur die stabile Form ist.[5]
Durch Zugabe von wenig Wasser zu Diphosphorpentoxid sind sie ebenfalls zugänglich.[6] Zum Beispiel erhält man Tetrametaphosphorsäure, wenn hexagonales P4O10 langsam in Eiswasser gegeben wird.[5] Außerdem entstehen Polyphosphorsäuren beim thermischen Zerfall der als Flammschutzmittel verwendeten Ammoniumphosphate.[6]
Die Salze der Metapolyphosphorsäuren können beispielsweise durch alkalische Hydrolyse von Phosphorpentoxid gewonnen werden.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Polyphosphorsäuren sind je nach Polymerisationsgrad farblose, hochviskose bis glasartige Stoffe, deren Säurestärke mit zunehmender Kettenlänge zunimmt.[4] In allen Phosphorsäuren und Polyphosphaten teilen die aufbauenden PO4-Tetraeder miteinander nur die Ecken, nie Kanten oder gar Flächen. Die POP-Winkel besitzen Werte zwischen 120 und 180° (je nach dem Ausmaß der Bildung von dπpπ-Bindungen).[7]
Handelsübliche Polyphosphorsäure ist eine hygroskopische, viskose, farb- und geruchlose Flüssigkeit, die in Wasser hydrolysiert. Ihre wässrige Lösung reagiert stark sauer.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Polyphosphorsäuren werden als Zwischenprodukt zur Herstellung abgeleiteter Verbindungen verwendet. Die Salze der Polyphosphorsäuren bilden mit Metallionen wasserlösliche Komplexverbindungen. So ist insbesondere das Pentanatriumtripolyphosphat kommerziell bedeutsam, das als Wasserenthärtungsmittel Verwendung findet.[4] Auch werden sie zur Herstellung von Ammoniumphosphaten eingesetzt.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu Polyphosphorsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ Lexikon der Chemie: Polyphosphorsäuren, abgerufen am 27. Mai 2022.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. De Gruyter, 2015, ISBN 978-3-11-038774-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e Josef K. Felixberger: Chemie für Einsteiger. Springer Berlin Heidelberg, 2017, ISBN 978-3-662-52821-1, S. 211 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b E. Schwarzmann: Hydroxide, Oxidhydrate und Oxide Neue Entwicklungen. Springer-Verlag, 2013, ISBN 978-3-642-87024-8, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Chemgapedia: Polyphosphorsäure, abgerufen am 27. Mai 2022.
- ↑ A. F. Holleman, Wiberg Nils: Lehrbuch der anorganischen Chemie. De Gruyter, 2019, ISBN 978-3-11-083817-6, S. 660 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Martin Bertau, Peter Fröhlich, Michael Katzberg: Industrielle Anorganische Chemie. Wiley-VCH, 2013, ISBN 978-3-527-33019-5, S. 178 (eingeschränkte Vorschau in der Google-Buchsuche).
