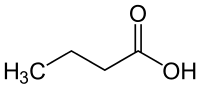
Buttersäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Buttersäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H8O2 | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 88,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||||||||
| Dichte |
0,9528 g·cm−3 (25 °C)[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
163,7 °C[4] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
4,82[6] | |||||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[2], Ethanol und Diethylether[3] | |||||||||||||||||||||
| Brechungsindex |
1,3980 (20 °C)[7] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Buttersäure ist der Trivialname der Butansäure, der einfachsten Fettsäure. Es handelt sich um eine Carbonsäure mit der Halbstrukturformel CH3–(CH2)2–COOH. Ihre Dämpfe reizen die Augen sowie die Atemwege und haben einen charakteristischen, unangenehmen Geruch. In der Natur entsteht Buttersäure durch die Buttersäuregärung. Die Salze und Ester der Buttersäure heißen Butyrate, nach der IUPAC Nomenklatur auch Butanoate genannt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Buttersäure wurde 1814 von Eugène Chevreul unter den Verseifungsprodukten der Butter entdeckt und sorgfältig beschrieben.[9] Die Herkunft aus dem Butterfett und der Geruch nach Butter (lateinisch butyrum) führten zum Namen der Säure. Théophile-Jules Pelouze beschrieb 1843 sie und ihre Reaktionen genauer[10][9][11] und nannte dabei folgende Eigenschaften:
„Die Buttersäure ist eine vollkommen farblose Flüssigkeit, durchsichtig, in hohem Grade beweglich, sie besitzt einen Geruch, welcher gleichzeitig an Essigsäure und kräftige Butter erinnert. Sie ist in allen Verhältnissen, in Wasser, Ethanol und Methanol löslich. Bei gewöhnlichem Druck siedet sie bei 164 °C und destilliert ohne bemerkliche Veränderung. Ihr Dampf ist entzündlich und brennt mit blauer Flamme […] ihr Geschmack ist stark sauer und brennend. Sie greift die Haut an und zerstört sie, wie die stärksten Säuren.“[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Buttersäure macht im Wesentlichen den unangenehmen Geruch von Erbrochenem oder von ranziger Butter aus. Buttersäure trägt auch zum Schweißgeruch und in manchen Fällen zum Mundgeruch bei. Die Dämpfe reizen in höheren Konzentrationen die Augen und die Atemwege. Buttersäure entsteht beim Ranzigwerden von Butter. Sie ist in jedem Verhältnis mit Wasser, Ethanol, Diethylether und Glycerin mischbar. Buttersäure ist im Vergleich zur Ameisensäure und Essigsäure eine schwächere Säure. Eisen, Zink, Magnesium und andere unedle Metalle lösen sich bei Säurekontakt unter Wasserstoffentwicklung ganz langsam auf. Dabei bilden sich Butyrate, die bei Feuchtigkeit wieder Buttersäure freisetzen:
- Reaktion von Magnesium mit Buttersäure
Mit Alkoholen können Ester erzeugt werden, die zum Fruchtaroma beitragen.[12]
- Reaktion von Buttersäure mit Ethanol
Buttersäure bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 72 °C.[2] Der Explosionsbereich liegt zwischen 2,0 Vol.‑% (72 g/m³) als untere Explosionsgrenze (UEG) und 10,0 Vol.‑% (365 g/m³) als obere Explosionsgrenze (OEG).[2] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 64 °C.[2] Die Zündtemperatur beträgt 440 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Da die Buttersäure unter anaeroben Bedingungen durch Buttersäurebakterien aus Kohlenhydraten gebildet wird, kommt sie in Lebensmitteln vor, zu deren Zubereitung Gärprozesse notwendig sind, also z. B. Käse, Sauerkraut, Bier und Brot; sie kommt auch in Milch, Fleischsaft und Schweiß sowie in Holzessig vor.[5][13] Weiter findet sie sich in einigen Pflanzenlipiden, meistens in geringer Konzentration. Die ursprüngliche Annahme, dass die übelriechende, scharfe und ätzende Flüssigkeit, die verschiedene Arten der Laufkäfer (Carabidae) wie die Echten Laufkäfer (Carabus spp.) zur Abwehr aus der Pygiadialdrüse versprühen, Buttersäure enthält, wurde in späteren Untersuchungen relativiert.[14]
Herstellung
[Bearbeiten | Quelltext bearbeiten]
Das grampositive, anaerobe, sporenbildende Bakterium Clostridium tyrobutyricum, ist in der Lage, durch Fermentation Buttersäure zu produzieren. Es hat die Fähigkeit, sowohl Glucose als auch Xylose abzubauen. Die wichtigsten metabolischen Endprodukte sind Buttersäure, Essigsäure, Wasserstoff und Kohlenstoffdioxid. Die vereinfachte Reaktionsgleichung lautet:
Die Ausbeute in Fermentationen ist jedoch erheblich niedriger als das theoretische Maximum, da die Buttersäureproduktion von der Essigsäureerzeugung begleitet wird. Die Produktion von fermentativer Buttersäure wird hauptsächlich in synthetischen Wachstumsmedien mit Glucose, Xylose oder Saccharose als Kohlenstoffquelle durchgeführt. Während des letzten Jahrzehnts und als das Konzept der nachhaltigen Produktion von Brennstoffen und Chemikalien aus Restrohstoffen im Vordergrund stand, wurde Buttersäure aus Maisfasern hergestellt. Die Nutzung von Lignocellulose für die biologische Herstellung von Kraftstoffen und Chemikalien erfordert eine Vorbehandlung und enzymatische Hydrolyse, um Glucose und Xylose aus der Lignocellulose-Matrix freizusetzen. Vorbehandlungsverfahren setzen je nach Rohstoff und Härte der Vorbehandlung auch toxische Verbindungen frei, wie Carbonsäuren, Furanderivate und phenolische Verbindungen, die den mikrobiellen Stoffwechsel und das Wachstum hemmen. Daher könnte die Hemmung eines der ersten Hindernisse sein, die überwunden werden müssen, wenn Hydrolysate aus Biomassen der zweiten Generation für biologische Produktionsprozesse verwendet werden, insbesondere wenn unverdünnte Hydrolysate mit hohen Zuckerkonzentrationen verwendet werden.[15]
Stoffwechsel im Darm
[Bearbeiten | Quelltext bearbeiten]Im menschlichen Dickdarm entsteht Buttersäure vor allem beim Abbau von präbiotischen Kohlenhydraten durch Darmbakterien. Durch die damit verbundene pH-Wert-Verschiebung in den sauren Bereich wird das Milieu für Salmonellen und andere Krankheitserreger ungünstig. Buttersäure scheint darüber hinaus direkt die Darmbewegungen anzuregen und dient den Epithelzellen des Dickdarms als Energiequelle.
Geruch
[Bearbeiten | Quelltext bearbeiten]Der Geruch von Buttersäure kann von Menschen und Tieren in kleinen Spuren wahrgenommen werden. Für den Menschen sind bereits Konzentrationen ab 0,06 mg pro Kubikmeter wahrnehmbar.[2] Der Mensch bewertet den Geruch negativ, die Stubenfliege dagegen positiv. Zecken dient der Geruch von Buttersäure zum Auffinden ihrer Wirte.
Buttersäure ist neben Propionsäure, Schwefelwasserstoff und flüchtigen schwefelhaltigen organischen Verbindungen (Methanthiol, Dimethylsulfid) ein Verursacher von Mundgeruch beim Menschen.[16]
Da die Entstehung von Buttersäure ein Zeichen von Fäulnis darstellt, dient ihre Geruchswahrnehmung als Warngeruch. Der Geruch von Buttersäure kann mit Basen, wie Natronlauge, Lösungen von Carbonaten usw. vermindert werden. Dabei bilden sich geruchlose Butyrate.
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Zur Herstellung von preisgünstigen, besonders wirksamen und lange anhaltenden Stinkbomben wird nebst Schwefelwasserstoff Buttersäure verwendet.[17]
Der penetrante Geruchsstoff wird auch dazu verwendet, Maulwürfe zu vertreiben.[18][19] Der Vertrieb dieses Mittels für diesen Zweck ist jedoch verboten, da es keine Zulassung als Biozid hat.[20]
Buttersäure findet in verschiedenen Branchen Verwendung. Gegenwärtig besteht ein großes Interesse daran, sie als Vorstufe für Biokraftstoffe, z. B. Biobutanol, zu verwenden. Aufgrund des Anstiegs des Ölpreises sowie der kontinuierlichen Verringerung der Erdölverfügbarkeit und des wachsenden Bedarfs an sauberen Energiequellen wurden in jüngster Zeit Forschungsarbeiten auf alternative Kraftstoffquellen ausgerichtet.
Buttersäure findet auch zahlreiche Anwendungen in der pharmazeutischen und chemischen Industrie. In der chemischen Industrie wird Buttersäure hauptsächlich zur Herstellung von Celluloseacetatbutyrat-Kunststoffen verwendet. Die aus Buttersäure hergestellten Buttersäureester werden als Aromastoffe und Riechstoffe in der Getränke-, Lebensmittel- und Kosmetikindustrie verwendet.[5]
Buttersäure dient In der Analytik traditionell als Leitsubstanz für Wiederkäuer-Milchfett, da sie nicht in tierischen Körperfetten oder pflanzlichen Fetten vorkommt.[5]
Salze
[Bearbeiten | Quelltext bearbeiten]Butyrate (systematisch auch Butanoate) ist neben einer Bezeichnung für Buttersäureester auch die Bezeichnung für die Salze der Buttersäure. Diese bestehen aus Butyrat-Anionen C3H7COO− und einem Kation. Beispiele sind Natriumbutyrat (NaC3H7COO), Magnesiumbutyrat[21] [Mg(C3H7COO)2] und Ammoniumbutyrat[22] (NH4C3H7COO). Bei Feuchtigkeit besitzen sie den gleichen charakteristischen Geruch wie Buttersäure. Wird ein Butyrat-Salz mit einer stärkeren Säure behandelt, entsteht wiederum Buttersäure.
Das Calcium-Salz der Buttersäure (Calciumbutyrat[23]) ist ein in der Gerberei-Industrie benutztes Entkalkungsmittel für Häute.[5]
Ester
[Bearbeiten | Quelltext bearbeiten]Die Ester der Buttersäure haben in vielen Fällen einen Geruch nach Früchten und kommen in vielen Fruchtaromen natürlich vor.[24]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu BUTYRIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 14. November 2021.
- ↑ a b c d e f g h i j k l m n o Eintrag zu Buttersäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Eintrag zu Buttersäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 96. Auflage. CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-78.
- ↑ a b c d e Gerhard Eisenbrand, Peter Schreier: RÖMPP Lexikon Lebensmittelchemie. 2. Auflage, Thieme, 2006, ISBN 978-3-13-736602-7, S. 160.
- ↑ Peter W. Atkins, Julio de Paula: Physikalische Chemie. 4. Auflage, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8, S. 1118.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-74.
- ↑ Eintrag zu Butyric acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c Théophile-Jules Pelouze, Amédée Gélis: Ueber die Buttersäure. In: Friedrich Wöhler, Justus Liebig (Hrsg.): (Justus Liebigs) Annalen der Chemie und Pharmacie. Band 47, Nr. 3. C. F. Winter, Heidelberg 1843, S. 241–253, doi:10.1002/jlac.18430470302 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Théophile-Jules Pelouze, Amédée Gélis: Ueber die Buttersäure. In: Otto Linné Erdmann, Richard Felix Marchand (Hrsg.): Journal für Praktische Chemie. Band 29, Nr. 1. Johann Ambrosius Barth, Leipzig 1843, doi:10.1002/prac.18430290171 (bsb-muenchen.de).
- ↑ Théophile-Jules Pelouze, Amédée Gélis: Mémoire sur l'acide butyrique. In: J.-B. Dumas (Hrsg.): Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences. Band 16, Nr. 1. Bachelier, Paris 2. Januar 1843, Seiten 1268–1269 Éther butyrique, S. 1262–1271 (online bei Gallica Bibliothèque numérique).
- ↑ Burchard Kohaupt: Praxiswissen Chemie für Techniker und Ingenieure. Springer-Verlag, 2013, ISBN 978-3-663-07703-9, S. 121.
- ↑ J. Schormüller: Die Bestandteile der Lebensmittel. Springer, 1965, ISBN 978-3-642-46012-8, S. 765–766.
- ↑ H. Schildknecht, H. Winkler. U. Maschitz: Vergleichend chemische Untersuchungen der Inhaltsstoffe der Pygidialwehrblasen von Carabiden. In: Z. Naturforsch. 23 b, 1968, S. 637–644, doi:10.1515/znb-1968-0512 (PDF; 6,9 MB).
- ↑ G. N. Baroi, I. Baumann, P. Westermann, H. N. Gavala: Butyric acid fermentation from pretreated and hydrolysed wheat straw by an adapted Clostridium tyrobutyricum strain. In: Microbial biotechnology. Band 8, Nummer 5, September 2015, S. 874–882, doi:10.1111/1751-7915.12304, PMID 26230610, PMC 4554475 (freier Volltext).
- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft. Vieweg + Teubner Verlag, 2011, ISBN 978-3-8348-1245-2, S. 61–62.
- ↑ Institut für Prävention und Arbeitsmedizin: Geruchsbelästigungen am Arbeitsplatz - Herausforderungen für die arbeitsmedizinische Praxis, IPA-Journal 03/2018, abgerufen am 5. November 2022
- ↑ selbst.de: Maulwurf bekämpfen | selbst.de, abgerufen am 5. November 2022
- ↑ heimwerker.de: Maulwürfe bekämpfen – 7 Tipps zum verschrecken von Maulwürfen - heimwerker.de, abgerufen am 5. November 2022
- ↑ Rechtslupe: Buttersäure für die Maulwurfbekämpfung | Rechtslupe, abgerufen am 5. November 2022
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Magnesiumbutyrat: CAS-Nr.: 556-45-6, EG-Nr.: 209-125-7, ECHA-InfoCard: 100.008.297, PubChem: 87086190, ChemSpider: 4955607, Wikidata: Q27277815.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Ammoniumbutyrat: CAS-Nr.: 14287-04-8, EG-Nr.: 238-207-5, ECHA-InfoCard: 100.034.718, PubChem: 26607, Wikidata: Q25473479.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Calciumbutyrat: CAS-Nr.: 5743-36-2, EG-Nr.: 227-265-7, ECHA-InfoCard: 100.024.787, PubChem: 6453483, ChemSpider: 4955855, Wikidata: Q27288183.
- ↑ George A Burdock: Fenaroli's Handbook of Flavor Ingredients. Sixth Edition, CRC Press, 2009, ISBN 978-1-4200-9077-2.




