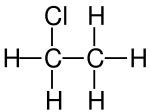
Chlorethan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Chlorethan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H5Cl | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit etherartigem, stechendem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 64,51 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
13,1 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Dipolmoment | ||||||||||||||||||||||
| Brechungsindex |
1,3798[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Chlorethan ist eine chemische Verbindung, die synthetisch als Ethylierungsreagenz eingesetzt werden kann. Weitere Namen sind Aethylchlorid, Chloräthyl, Monochloräthan, Chlorwasserstoffäther, leichter Salzäther, Kelen und Chelen.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Ethylchlorid als chemische Verbindung wurde bereits sehr früh entdeckt und hergestellt. Man nimmt an, dass es der erste hergestellte chlorierte Kohlenwasserstoff ist. Bereits 1440 wurde es von Basilius Valentinus durch Reaktion von Ethanol mit Salzsäure hergestellt. Zwei Jahrhunderte später – im Jahr 1648 – erhielt Johann Rudolph Glauber die Verbindung ebenfalls, indem er Ethanol mit Zinkchlorid umgesetzt hat. Nachdem Ernst von Bibra und Emil Harleß tierexperimentell Salzäther erforscht und Thomas Nunneley sowie James Young Simpson das Chloräthyl eingehender untersucht hatten, verwendeten Marie-Jean-Pierre Flourens in Paris[8] und Johann Ferdinand Heyfelder in Erlangen 1847 als Erste Salzätherinhalationen zur Herbeiführung einer Inhalationsnarkose.[9] Auch als Lokalanästhetikum in der Zahnheilkunde wurde Chlorethan benutzt. So benutzte der Schweizer Camille Redard (1841–1910) um 1888 Chloräthyl als Lokalanästhetikum. Nachdem Carlson und Thiessing 1894 festgestellt hatten, dass das Lokalanästhetikum auch eine allgemeine Betäubung bewirken kann, wurde es wieder vermehrt für kurze Operationen bzw. als Einleitungshypnotikum verwendet.[10] Um 1904 entwickelte Wilhelm Herrenknecht eine modernere Technik des Chloräthylrausches.[11] Im Rahmen der Industrialisierung und der immer stärker wachsenden Automobilindustrie in den 1920er Jahren, wurde Chlorethan zu einem wichtigen Massenprodukt der Chemischen Industrie. Es wurde anfangs in großen Mengen bei der Produktion von Tetraethylblei, einem Antiklopfmittel für Motorenbenzin, verwendet. Durch die strikteren Regulierungen im Bezug auf verbleites Motorenbenzin zur Erhöhung der Oktanzahl (Verbot seit 2000 in der EU, → siehe Entwicklung der Ottokraftstoffe) und aufgrund der Entwicklung von alternativen Zusatzstoffen (z. B. Methyl-tert-butylether) für Ottomotoren, ist der Bedarf an Chlorethan rückläufig geworden.[4]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Wie bereits erwähnt gibt es verschiedene Möglichkeiten zur Herstellung von Chlorethan, von denen jedoch nur noch zwei von industrieller Bedeutung sind.
Thermische Chlorierung von Ethan
[Bearbeiten | Quelltext bearbeiten]Ein vorteilhaftes Verfahren zur großtechnischen Herstellung von Chlorethan besteht in der thermischen Chlorierung von Ethan mit Chlorgas bei Temperaturen von 400–450 °C und Drücken von 5–10 bar.[4][12]

Die Umsetzung wird katalysatorfrei in einem adiabatisch betriebenen Rohrreaktor durchgeführt. Man arbeitet mit einem hohen Ethanüberschuss, um die Bildung von höher chlorierten Kohlenwasserstoffen (z. B. 1,1-Dichlorethan) zu reduzieren. Es handelt sich um einen radikalische Substitutionsreaktion, die aufgrund der hohen Temperatur ohne Katalysator abläuft. Alternativ kann die Reaktion auch photochemisch induziert werden. Das Produktgemisch wird destillativ aufgereinigt und von anderen Bestandteilen abgetrennt.[4][12]
Hydrochlorierung von Ethen
[Bearbeiten | Quelltext bearbeiten]Ein weiteres Verfahren zur industriellen Herstellung von Chlorethan betrifft die Hydrochlorierung von Ethen mit Chlorwasserstoff bei Temperaturen von 30–50 °C und geringen Drücken von 1–5 bar in Gegenwart von Aluminiumchlorid als Katalysator.[4][12]

Man arbeitet in der Flüssigphase in Siedebettreaktoren, in denen die entstandene Reaktionswärme durch ein Kühlsystem abgeführt wird. Der Umsatz von Ethen und Chlorwasserstoff ist nahezu quantitativ. Die Selektivität bezogen auf Chlorethan beträgt 98–99 %. Als Nebenprodukte entstehen geringe Mengen an oligomeren Ethen-Verbindungen (durch Ziegler-Natta-Verfahren) und höher chlorierte Kohlenwasserstoffe.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chlorethandämpfe sind schwerer als Luft und reichern sich am Boden an („Schwergas“). Es besitzt eine kritische Temperatur von 187,2 °C, einen kritischen Druck von 52,7 bar, eine kritische Dichte von 0,331 kg/l und eine Tripelpunkt-Temperatur von −138,3 °C (Schmelztemperatur).[1]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chlorethan ist unter Normalbedingungen gasförmig, sehr reaktionsfreudig und lichtempfindlich. Bei der thermischen Zersetzung unter Sauerstoffausschluss entsteht Chlorwasserstoff und Ethylen. An Luft und unter Lichteinwirkung zersetzt es sich langsam unter Bildung von Chlorwasserstoff und Phosgen.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Chlorethan wird wegen der schwierigen Handhabung praktisch nur industriell genutzt, etwa als Ethylierungs-, Löse- und Extraktionsmittel.[1] In der Medizin dient es seit etwa 1882[13] zur Lokalanästhesie (Vereisung).[14] Industriell war Chlorethan ein wichtiger Ausgangsstoff zur Herstellung des Antiklopf-Additivs Tetraethylblei für Kraftstoffe. In der Zahnmedizin dient es zur Sensibilitätsprüfung der Zähne („Vitalitätsprüfung“).
Chlorethan wurde früher auch als (in Ampullen aufbewahrtes) und seit der Mitte des 19. Jahrhunderts bekanntes[15] Inhalationsnarkotikum[16] verwendet, erwies sich aber in der zweiten Hälfte des 20. Jahrhunderts[17] wegen seiner im Vergleich zu anderen Substanzen geringen therapeutischen Breite als ungeeignet.[18]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Chlorethan ist hochentzündlich und gesundheitsschädlich, möglicherweise sogar krebserregend. Das Gas wirkt stark betäubend; bereits 4 % in der Atemluft verursachen Narkose.[2] Schon narkotische Konzentrationen können zu Kammerflimmern und Herzstillstand führen, höhere Konzentrationen (6 %) nach kurzer Zeit zu Atemlähmung.[1]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o p Eintrag zu Chlorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b Eintrag zu Ethylchlorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. März 2020.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ a b c d e f Eberhard‐Ludwig Dreher, Klaus K. Beutel, John D. Myers, Thomas Lübbe, Shannon Krieger, Lynn H. Pottenger: Chloroethanes and Chloroethylenes. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 19. November 2014, doi:10.1002/14356007.o06_o01.pub2.
- ↑ Eintrag zu Chloroethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. März 2020. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-00-3 bzw. Chlorethan), abgerufen am 13. März 2020.
- ↑ a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-10.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 14.
- ↑ Ulrich von Hintzenstern, Wolfgang Schwarz: Frühe Erlanger Beiträge zur Theorie und Praxis der Äther- und Chloroformnarkose. Teil 1: Heyfelders klinische Versuche mit Äther und Chloroform. In: Der Anaesthesist. Band 45, Heft 2, 1996, S. 131–139, hier: S. 131 und 135 f.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 14 und 25.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 58.
- ↑ a b c Manfred Fedtke, Wilhelm Pritzkow, Gerhard Zimmermann: Technische Organische Chemie – Grundstoffe, Zwischenprodukte, Finalprodukte, Polymere. 1. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1992, ISBN 3-342-00420-7
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 18.
- ↑ Johannes Petres, Rainer Rompel: Operative Dermatologie: Lehrbuch und Atlas. 2. Auflage, Springer-Verlag, Heidelberg 2006, ISBN 978-3-540-34086-7, S. 44.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 18.
- ↑ Hans Killian: Hinter uns steht nur der Herrgott. Sub umbra dei. Ein Chirurg erinnert sich. Kindler, München 1957; hier: Lizenzausgabe als Herder-Taschenbuch (= Herderbücherei. Band 279). Herder, Freiburg/Basel/Wien 1975, ISBN 3-451-01779-2, S. 31.
- ↑ Vgl. etwa Gustav Döderlein: Der heutige Stand der abdominalen Schnittentbindung. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. 56–61, hier: S. 61 (zur Chloräthyl-Äther-Narkose).
- ↑ Harry Auterhoff: Lehrbuch der pharmazeutischen Chemie. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1968, S. 121.


