Rubidiumacetat
(Weitergeleitet von Rubidiumethanoat)
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rubidiumacetat | |||||||||||||||
| Andere Namen |
Rubidiumethanoat (nach IUPAC) | |||||||||||||||
| Summenformel | C2H3O2Rb | |||||||||||||||
| Kurzbeschreibung |
weißes geruchloses Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 144,52 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
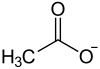
Rubidiumacetat ist das Rubidiumsalz der Essigsäure mit der Summenformel CH3COORb.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Rubidiumacetat kann durch Salzbildungsreaktion aus Rubidiumhydroxid und Essigsäure hergestellt werden.
Ebenso ist die Synthese aus Rubidiumcarbonat und Essigsäure unter Entwicklung von Kohlendioxid möglich.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Rubidiumacetat ist im Handel als hygroskopisches, weißes Pulver erhältlich. Es bildet monokline Kristalle mit den Gitterparametern a = 869 pm, b = 618 pm, c = 426 pm und β = 104,4°.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Datenblatt Rubidium acetate (PDF) bei Strem, abgerufen am 21. Dezember 2019.
- ↑ Datenblatt Rubidium acetate, 99.8% (metals basis) bei Alfa Aesar, abgerufen am 1. Dezember 2019 (Seite nicht mehr abrufbar).
- ↑ a b Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 332 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt Rubidium acetate, ≥99.8% trace metals basis bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- ↑ N. V. Sidgwick, J. A. H. R. Gentle: "The solubilities of the alkali formates and acetates in water", in: J. Chem. Soc., Trans., 1922, 121, S. 1837–1843; doi:10.1039/CT9222101837.
- ↑ J. Hatibarua, G. S. Parry: "A crystallographic study of the acetates of potassium, rubidium and caesium", in: Acta Cryst., 1972, B28, S. 3099–3100; doi:10.1107/S0567740872007496.

