Epithelialer Natriumkanal
| Epithelialer Natriumkanal | ||
|---|---|---|
| ||
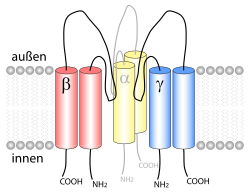
| Schematische Darstellung eines ENaC. | ||
| Masse/Länge Primärstruktur | 1958 = 669+640+649 Aminosäuren | |
| Sekundär- bis Quartärstruktur | α+β+γ; multipass Membranprotein | |
| Isoformen | 5α; 2β; 1γ | |
| Bezeichner | ||
| Gen-Name(n) | SCNN1A, SCNN1B, SCNN1G, SCNN1D | |
| Transporter-Klassifikation | ||
| TCDB | 1.A.6.1.1 | |
| Bezeichnung | ENaC-Familie | |
Der epitheliale Natriumkanal (kurz: ENaC von engl.: epithelial Na channel; auch SCNN1 von engl.: sodium channel non-neuronal 1 oder ASSC von engl.: amiloride sensitive sodium channel) ist ein membranständiger Ionenkanal, der neben Li+-Ionen und Protonen vor allem für Na+-Ionen durchlässig ist. Er ist im Grundzustand geöffnet, man spricht von einem konstitutiv aktiven Kanal.
Der epitheliale Natriumkanal setzt sich aus drei Untereinheiten zusammen (α, β, γ), die zu einem Heterotrimer zusammengesetzt sind.[1][2][3] Jede der drei Untereinheiten weist zwei Transmembranhelices und eine extrazelluläre Schleife auf. Die Amino- und Carboxytermini der Polypeptidketten befinden sich jeweils im Cytosol.[4] Mutationen an den Genen, die für die ENaC-Untereinheiten kodieren, können Pseudohypoaldosteronismus Typ 1 (α, β) und Liddle-Syndrom (β, γ) verursachen.[5]

ENaC befindet sich in den Apikalmembranen von polaren Epithelzellen vor allem in der Niere, der Lunge und dem Grimmdarm (Colon).[6] Er ist in den transepithelialen Transport von Na+-Ionen involviert, welchen er gemeinsam mit der Na+/K+-ATPase bewerkstelligt. Er spielt eine wichtige Rolle bei der Aufrechterhaltung der Na+ und K+-Konzentrationen in Blut, Epithelien sowie extraepithelialen Flüssigkeiten, indem er Na+-Ionen aus Primärharn und Darmlumen rückresorbiert. Die ENaC-Aktivität und -expression in Niere und Grimmdarm wird dabei durch das Mineralokortikoid Aldosteron moduliert. ENaC kann durch Amilorid und Triamteren blockiert werden. Diese Eigenschaft macht man sich in der Medizin zunutze, indem man diese als Diuretikum einsetzt.
Weiterhin kommt ENaC in Geschmackssinneszellen vor. Hier spielt er eine wichtige Rolle in der Wahrnehmung des Salzgeschmacks. Während bei Nagetieren nahezu der gesamte Salzgeschmack durch ENaC vermittelt wird, ist beim Menschen nur etwa ein Fünftel der Wahrnehmung auf ENaC zurückzuführen.
Es gibt eine weitere sogenannte δ-Untereinheit, die große Homologie zur α-Untereinheit aufweist und diese unter Bildung eines funktionellen Kanals ersetzen kann. Solche δ, β, γ-Tetramere treten beispielsweise in Pankreas, Hoden oder Ovarien auf, ihre Funktion ist jedoch noch ungeklärt.
Quellen
[Bearbeiten | Quelltext bearbeiten]- ↑ Sigrid Noreng, Arpita Bharadwaj, Richard Posert, Craig Yoshioka, Isabelle Baconguis: Structure of the human epithelial sodium channel by cryo-electron microscopy. In: eLife. Band 7, 25. September 2018, ISSN 2050-084X, S. e39340, doi:10.7554/eLife.39340, PMID 30251954, PMC 6197857 (freier Volltext).
- ↑ Israel Hanukoglu, Aaron Hanukoglu: Epithelial sodium channel (ENaC) family: Phylogeny, structure-function, tissue distribution, and associated inherited diseases. In: Gene. Band 579, Nr. 2, 1. April 2016, ISSN 1879-0038, S. 95–132, doi:10.1016/j.gene.2015.12.061, PMID 26772908, PMC 4756657 (freier Volltext).
- ↑ Nate Yoder, Craig Yoshioka, Eric Gouaux: Gating mechanisms of acid-sensing ion channels. In: Nature. Band 555, Nr. 7696, 15. März 2018, ISSN 1476-4687, S. 397–401, doi:10.1038/nature25782, PMID 29513651, PMC 5966032 (freier Volltext).
- ↑ Hanukoglu I, Hanukoglu A: Epithelial sodium channel (ENaC) family: Phylogeny, structure-function, tissue distribution, and associated inherited diseases. In: Gene. 579. Jahrgang, Nr. 2, Januar 2016, S. 95–132, doi:10.1016/j.gene.2015.12.061, PMID 26772908, PMC 4756657 (freier Volltext).
- ↑ UniProt P37188, UniProt P51168, UniProt P51170
- ↑ Enuka Y, Hanukoglu I, Edelheit O, Vaknine H, Hanukoglu A: Epithelial sodium channels (ENaC) are uniformly distributed on motile cilia in the oviduct and the respiratory airways. In: Histochemistry and Cell Biology. 137. Jahrgang, Nr. 3, März 2012, S. 339–353, doi:10.1007/s00418-011-0904-1, PMID 22207244.