Salpingoeca
| Salpingoeca | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
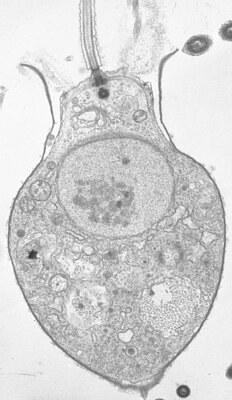
Salpingoeca sp., in transmission electron microscopy (TEM) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Salpingoeca | ||||||||||||
| James-Clark, 1866[1] |
Salpingoeca ist eine Gattung von Choanoflagellaten aus der Klade (in der NCBI-Taxonomie: Familie) Salpingoecidae. Typusart ist Salpingoeca gracilis.
Beschreibung
[Bearbeiten | Quelltext bearbeiten]
Die Choanoflagellaten der Gattung Salpingoeca haben eine einzige feste vasenförmige Hülle oder Panzerung (Lorica). Ihr Hauptbestandteil ist aber wie für Mitglieder der Craspedida typisch anders als bei anderen Choanoflagellaten nicht Siliciumdioxid, sondern Chitin, ist also organisch. Diese Hülle wird daher bei dieser Gruppe als Theca bezeichnet. Die Theca ist am hinteren Ende geschlossen und im Lichtmikroskop gut sichtbar (Leadbeater 1991; Thomsen & Buck 1991). Als Kragengeißeltierchen besitzen sie den für diese Gruppe namensgebenden Kragen. Es gibt gestielte (englisch stalked) und ungestielte Vertreter. Manche Arten bilden Kolonien (s. u.). Die Unterscheidung zwischen den ca. 70 Arten basiert meist auf der Morphologie der Theca (Starmach 1985); viele Arten scheinen sich in ihren Merkmalen zu überschneiden, weshalb die Identifizierung aufgrund der äußeren Gestalt oft schwierig ist. Viele Arten sind daher wahrscheinlich synonym, die Identifizierung und Taxonomie der Salpingoeca-Arten ist daher problematisch und noch Veränderungen unterworfen. In älteren Werken gibt es gelegentlich fehlerhafte Abbildungen (z. B. Lemmermann 1914), es wird empfohlen, für die Identifizierung die Typusbeschreibungen zu Rate zu ziehen.[2]
Habitate der Salpingoeca-Arten sind im Süß-, im Brack- oder im Salzwasser.[2][3]
Artenliste
[Bearbeiten | Quelltext bearbeiten]Artenliste (Stand Ende September 2024):
Gattung Salpingoeca H. J. Clark, 1866(e,N,O,P,W) bzw. Clark, 1868(J) oder James-Clark, 1867(J)
- Salpingoeca abyssalis Nitsche, Weitere, Scheckenbach, Hausmann, Wylezich & Arndt, 2007(O) [Salpingoeca sp. abyssalis(N)]
- Salpingoeca aggregata Valkanov, 1970(J,O?,W?)
- Salpingoeca amphora Kent, 1880(N)

- Salpingoeca amphoridium James-Clark, 1867(e,J,N,O)[4] bzw. J. Clark, 1868(J)
- Salpingoeca ampullacea (Stein, 1878)(R)[5]
- Salpingoeca ampulloides D. de C. Bicudo & C. E. de M. Bicudo, 1984(e,P,R,W)[6] [veraltet: Salpingoeca ampullacea D. de C. Bicudo & C. E. de M. Bicudo, 1983(e,R)[5]]
- Salpingoeca angulosa de Saedeleer 1927(N)
- Salpingoeca aroma Schiwitza & Nitsche, 2021(N) [Salpingoeca sp. SaSch-2021a(N)]
- Salpingoeca buetschlii Lemmermann, 1913(e,J,P)[7]

- Salpingoeca calixa Carr et al. 2017(e,N) [Salpingoeca sp. MC-2015a(N)]
- Salpingoeca caudiculata D. C. Bicudo & C. E. M. Bicudo(e)
- Salpingoeca clarkii F. Stein, 1878(e,P,R)[9][10]
- Salpingoeca collaris Stokes(O?,W?)
- Salpingoeca convallaria Stein(W?)[11]
- Salpingoeca cornuta Kent, 1880(e,W)
- Salpingoeca crinita Schiwitza, Arndt & Nitsche 2018(e,N)

- Salpingoeca dolichothecata Carr, Richter & Nitsche 2017(e,N) [Salpingoeca sp. MC-2015b(N)]
- Salpingoeca elegans (Bachmann) Lemmermann, 1913(W)
- Salpingoeca euryoecia Jeuck, Arndt & Nitsche 2014(e,N)
- Salpingoeca fluviatilis Schiwitza, Lisson, Arndt & Nitsche, 2020(N) [Salpingoeca sp. FN-2016a(N)]
- Salpingoeca frequentissima (Zacharias, 1894) Lemmermann, 1913(O,P,R)[12][13]
- Salpingoeca fusiformis Saville Kent (1880)(e,J,N,P)[14][15]

- Salpingoeca gracilis James-Clark, 1867(e,N) bzw. J. Clark(J) oder Clark(e)[16] – Typusart(W)
- Salpingoeca guzmanae Schiwitza & Nitsche, 2021(N) [Salpingoeca sp. SaSch-2021b(N)]
- Salpingoeca helianthica Carr, Richter & Nitsche 2017(e,N,P)[17] (kurz Salhel[18])
- Salpingoeca huasca Schiwitza, Arndt & Nitsche 2018(e,N)
- Salpingoeca huxleyi Ellis, 1930(e,W)
- Salpingoeca infusionum Kent, 1880(e,N,O,W)[19][20] [Salpingoeca longipes Saville Kent, 1880(e,N,W)[21]]
- Salpingoeca intermedia Vørs, 1993(W)
- Salpingoeca inquillata Kent, 1880(J,O?,W?) [Salpingoeca curvipes Kent, 1880(W)]

- Salpingoeca kvevrii Carr, Richter & Nitsche 2017(e,N) [Salpingoeca sp. ATCC 50929(N)]
- Salpingoeca lefevrei Bourrelly, 1949(W?)
- Salpingoeca llamariensis Schiwitza & Nitsche, 2021(N) [Salpingoeca sp. SaSch-2021c(N)]

- Salpingoeca macrocollata Carr, Richter & Nitsche 2017(e,N) [Salpingoeca sp. ATCC 50938(N)]
- Salpingoeca marina James-Clark, 1868(W?,O?)
- Salpingoeca megacheila Ellis, 1930(e,O,W)
- Salpingoeca minuta Kent, 1880(e,N,O?)[22]
- Salpingoeca napiformis Kent 1880(e,N,W)[23] [Salpingoeca sp. ATCC 50153(N), Salpingoeca desaedeleeri Ellis, 1930(P,W)[24]]

- Salpingoeca oahu Carr, Richter & Nitsche 2017(e,N) [Salpingoeca sp. MC-2015c(N)]
- Salpingoeca prava Schiwitza, Arndt & Nitsche 2018(e,N)
- Salpingoeca procera Möbius(e,W)

- Salpingoeca punica Carr, Richter & Nitsche 2017(e,N)
- Salpingoeca pyxidium Kent, 1881(e,J,N)[25]
- Salpingoeca ringens Kent, 1878(P)[26]
- Salpingoeca rosetta Dayel et al. 2011(e,N)[27][28][29] [Salpingoeca sp. ATCC 50818(N), Proterospongia sp. ATCC 50818(N)]
- Salpingoeca ruttneri (Bourrelly, 1952) Bourrelly(P)[30]
- Salpingoeca skujae Tikhonenkov & Mazei 2008(e)
- Salpingoeca steinii Kent, 1880(N)
- Salpingoeca stenotheca Boucard Camou, 1967(e,W)
- Salpingoeca surira Schiwitza, Arndt & Nitsche 2018(e,N)
- Salpingoeca teres Kent, 1880(e,W)
- Salpingoeca tuba W. S. Kent, 1880(e,N,O)[31] [Salpingoeca petiolata Kent, 1881(W)]
- Salpingoeca undulata Ellis, 1930(e,W)
- Salpingoeca urceolata W. S. Kent, 1881(e,N,O,P,W)[32][33] [Salpingoeca cardiforma Ellis, 1930(W)]
- Salpingoeca vaginicola F. Stein, 1878(e,J,P,R)[34][35]
- Salpingoeca ventriosa Jeuck, Arndt & Nitsche 2014(e,N,R)[36]
- Salpingoeca sp. FN-2016b(N)
- Salpingoeca sp. Madeira(N)
- Salpingoeca sp. Mallorca(N)
- Salpingoeca sp. Thailand(N)
Verschiebungen…
…zur Gattung Barroeca:
- Salpingoeca monosierra [Salpingoeca sp. PTW-2021a] ⇒ Barroeca monosierra Hake, Burkhardt, Richter & King, 2021(N)[37]
…zur Gattung Bicosta:
- Salpingoeca minor N. Reynolds, 1976 ⇒ Bicosta minor (N. Reynolds) Leadbeater, 1978(W)
- Salpingoeca spinifera Throndsen, 1970 ⇒ Bicosta spinifera (Throndsen) Leadbeater, 1978(O,W)
- Salpingoeca virgata Parke & Leadbeater, 1977 ⇒ Bicosta minor (N. Reynolds) Leadbeater, 1978(W)
…zur Gattung Calliacantha:
- Salpingoeca longicaudata Leadbeater, 1975 ⇒ Calliacantha longicaudata (Leadbeater) Leadbeater, 1978(W)
- Salpingoeca natans Grøntved, 1956 ⇒ Calliacantha natans (Grøntved) Leadbeater, 1978(O,W)
…zur Gattung Crucispina:
- Salpingoeca cruciformis Leadbeater, 1974 ⇒ Crucispina cruciformis (Leadbeater) Espeland, 1986(O)
…zur Gattung Stephanoeca:
- Salpingoeca campanula Kent, 1880 ⇒ Stephanoeca campanula (W. S.&nvsp;Kent) Boucaud-Camou, 1967(W)
Quellen:
- (e)– Encyclopedia of Life (eoL)[38]
- (J)– National Institute for Environmental Studies (NIES), Japan[2]
- (N)– Taxonomie des National Center for Biotechnology Information (NCBI)[39]
- (O)– Ocean Biogeographic Information System (OBIS)[3]
- (P)– Wolfgang Bettighofer: Protisten.de[40]
- (R)– Martin Kreutz: Real Micro Life[41]
- (W)– World Register of Marine Species (WoRMS)[42]
Phylogenie
[Bearbeiten | Quelltext bearbeiten]Adl et al. verzichten auf die Ausweisung höherer taxonomischer Ränge der Protisten. Die herkömmlich als Familie angesehene Gruppe Salpingoecidae wird von diesen Autoren mit den Monosigidae zur Gruppe (herkömmlich: Ordnung) der Craspedida zusammengeführt.[43] Die Taxonomie des NCBI ist diesem Vorschlag bisher (noch) nicht gefolgt und weist die Gattung Salpingoeca weiter einer Familie Salpingoecidae, und dieser einer Ordnung Craspedida zu.[39]
-
Vereinfachter phylogenetischer Baum mit der Gattung Salpngoeca
-
Phylogenie der Choanoflagellaten nach Carr et al. (2017). Die Gattung Salpingoeca ist danach nicht monophyletisch.[8]
Salpingoeca ampullacea
[Bearbeiten | Quelltext bearbeiten]Bei der Spezies S. ampullacea ist die Lorica (bzw. Theca, Schale) fast kugelförmig, mit einem geraden, zylindrischen Hals und einer deutlich verbreiterten die Öffnung (englisch opening). Die Länge der Lorica beträgt 8-11 µm. Die Lorica (Schale) hat keinen oder nur einen sehr kurzen, festen Stiel, mit dem sie am Substrat (meist Algenfäden) befestigt ist. Die Art Salpingoeca clarkii ist ähnlich, hat aber einen festen, langen Stiel und eine vasenförmige Lorica. Man kann daher erst bei starker Vergrößerung im Lichtmikroskop erkennen, ob es einen Stiel gibt und wie dieser aussieht, um die verschiedenen Arten voneinander zu unterscheiden. Die Zelle füllt den kugelförmigen Teil der Lorica vollständig aus. Es gibt eine einzelne Geßel (Flagellum), diese ist etwas 3-4 mal so lang wie die Zelle. Der Zellkern befindet sich im vorderen Drittel mit kugelförmigem Nukleolus. Es gibt eine kontraktile Vakuole im hinteren Drittel oder in der Körpermitte.[5]
Die Art kommt laut Martin Kreutz im Simmelried (bei Konstanz) vor, möglicherweise auch an anderen ähnlichen Standorten (in Mitteleuropa nördlich der Alpen).[5]
Im Jahr 1983 wurde eine von D. de C. Bicudo & C. E. de M. Bicudo neu beschriebene Salpingoeca-Art zunächst ebenfalls Salpingoeca ampullacea genannt. Dieser Name wurde jedoch zuerst von Friedrich von Stein (1878) vergeben. Die Autoren zogen daher 1984 diesen Namen zurück und benannten ihre neu entdeckte Art in Salpingoeca ampulloides um. Diese Änderung ist leider in vielen Datenbanken im Internet nicht nachvollzogen worden.[5]
Salpingoeca rosetta
[Bearbeiten | Quelltext bearbeiten]Salpingoeca rosetta ist eine seltene marine eukaryotische Art. Sie bildet zwei Arten von Kolonien, in denen einer Reihe von Zellen in eine gallertartige Matrix eingebettet ist: „konventionelle“ kettenförmige und (namensgebende) arbeitsteilige rosettenförmige. Die Art kkennt ein haploides und diploides Stadium mit sexueller und asexueller Vermehrung.[29][44][45] Es gibt verschiedene solitäre (Einzelzell-)Stadien und Kolonieformen.[29][27][45]
Salpingoeca helianthica
[Bearbeiten | Quelltext bearbeiten]
Eine 2024 an der Art Salpingoeca helianthica[17] (kurz Salhel) durchgeführte Studie von Forschern der Penn State University lieferte interessante Erkenntnisse zue Evolution des Nervensystems der Tiere. Es wurde gezeigt, dass die Shaker-Familie von Proteinen für die elektrische Signalübertragung im Nervensystem ihren evolutionären Ursprung lange vor dem gemeinsamen Vorfahren aller Tiere hat. Sie hat sich also nicht wie zuvor angenommen erst parallel zum Nervensystem entwickelt hat, sondern war bereits vor der Entstehung des Nervensystems vorhanden.[47]
Im Tierreich gibt es mehrere Unterfamilien oder Typen innerhalb der Shaker-Familie, die mit Kv1 bis Kv4 bezeichnet werden. Rippenquallen mit ihrem vergleichsweise einfachen Nervensystem besitzen nur einen Typ, nämlich Kv1. Dies hatte vermuten lassen, dass der gemeinsame Vorfahre der Tiere nur Kv1 besaß und sich andere Typen erst später entwickelten. Jegla et al. fanden 2024 jedoch in Salpingoeca helianthica drei Gene der Shaker-Familie (SheliKvT1.1 bis SheliKvT1.3), die eng mit den Typen Kv2, Kv3 und Kv4 verwandt sind und auch in Eizellen (Oozyten) der Krallenfrösche (Gattung Xenopus) erfolgreich exprimiert werden. Diese Erkenntnis deuten darauf hin, dass an der Basis des tierischen Stammbaums mehrere Subtypen vorhanden waren, darunter der in Rippenquallen vorkommende Typ Kv1, und die Kv2-4-ähnlichen Kanäle, die in Choanoflagellaten wie S. helianthica zu finden sind und die als die ältesten Typen gelten müssen, aber in den Rippenquallen offenbar verloren gingen.[47]
Ebenfalls im Jahr 2024 fanden Gao et al. heraus, dass einige einzellige Holozoa Sox-artige Gene besitzen. D. h. sie kodieren Proteine, die wie der Transkriptionsfaktor Sox-2 DNA binden.[A. 1] Unter diesen Holozoa befanden sich neben den Choanoflagellaten Mylnosiga fluctuans (Myflu)[46] und Salpingoeca helianthica (Salhel) auch Filasterea wie die beiden Pigoraptor-Spezies P. vietnamica (Pvie) und P- chileana (Pchi). Die Sox-HMG-Sequenzen von Pvie, Pchi, Myflu und Salhel bilden eine Schwesterklade zu den tierischen Sox-Genen. Bekannte Sox-ähnliche Sequenzen aus anderen Choanoflagellaten (und erst recht Filasterea) zeigen dagegen eine geringere Verwandtschaft und größere Abweichungen, befinden sich also außerhalb der Sox-Hauptklade. Dies deutet darauf hin, dass
- die Sox-Gene bereits vor dem letzten gemeinsamen Vorfahren der mehrzelligen Tiere (Metazoa) entstanden sind, und
- viele einzellige Holozoa ihre Sox-Gene entweder verloren haben, oder dass diese degeneriert sind.
Alle Aminosäuren, die für das sequenzspezifische Auslesen von Basen in modernen Sox-Proteinen entscheidend sind, sind auch in den Sox-Varianten von Pvie, Pchi, Myflu und Salhel konserviert. Dies ließ die Vermutung aufkommen, dass diese Sox-Varianten auch die gleichen DNA-Motive binden können wie ihre Gegenstücke in Säugetieren. Um diese Vermutung zu testen, wählten Gao et al. repräsentative Sox-Sequenzen von Einzellern aus. Unter diesen befanden sich insbesondere Pchi (als Filasterea-Mitglied) und Salhel (als Choanoflagellat). Es stellte sich schließlich heraus, dass diese Proteine eine Sequenzspezifität aufweisen, die sich nicht vom Sox2 von Mäusen unterscheidet.[18]
Bei Mäusen lassen sich pluripotente Stammzellen mit Hilfe der vier Yamanaka-Faktoren (Sox2, Oct4, Klf4, c-Myc, OSKM) erzeugen. Gao et al. gelang es, in diesem Prozess das mauseigene Sox2 durch das Sox-artige Protein S. helianthica erfolgreich zu ersetzen. Das Sox aus dieser Choanoflagellaten-Spezies ist also in der Lage, Pluripotenz in somatischen Zellen der Maus zu induzieren. Im Gegensatz dazu bindet der POU-artigen Transkriptionsfaktor (mit Okt4 alias POU5F1) dieser Choanoflagellaten andere, von den tierischen Homologen verschiedene, DNA-Motive; und kann keine Pluripotenz induzieren. Die Autoren stellen als Ergebnis die Hypothese auf, dass die Sox/POU-Partnerschaft schon früh in der Evolution der Tiere entstanden sein könnte und sich wahrscheinlich aus zuvor etablierten Sox-POU-DNA-Dimerisierungs- und Bindungsfähigkeiten durch Nutzbarmachen für eine neue Funktion (sog. „molekulare Exaptation“) entwickelt hat.[18]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Die Sox-Proteinfamilie teilt die HMG-Box genannten Proteindomänen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- M. Laval: Ultrastructure et mode de nutrition du Choanoflagellé Salpingoeca pelagica, sp. nov. comparaison avec les choanocytes des Spongiaires. In: Protistologica, Band 7, 1971, S. 325–336 (französisch).
- Daniel J. Richter, Parinaz Fozouni, Michael B. Eisen, Nicole King: Gene family innovation, conservation and loss on the animal stem lineage. In: sLife, 31. Mai 2018. Stand: 3. Juli 2018; doi:10.7554/eLife.34226.001 (englisch).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ H. James-Clark: On the Spongia Ciliatae as Infusoria Flagellata; or, observations on the structure, animality, and relationship of Leucosolenia botryoides, Bowerbank. In: Memoirs of the Boston Society of Natural History, Band 1, Nr. 3, 1868, S. 305-340. Ebenso veröffentlicht in: Proceedings of the Boston Society of Natural History, Band 11, 20. Juni 1866, S. 15; sowie in: American Journal of Science, November 1866; in: Annals and Magazine of Natural History, Januar 1867; in Annals and Magazine of Natural History, 4. Serie, Band 1, 1868, S. 133-142, 188–215, 250–264.
- ↑ a b c NIES: Salpingoeca Clark, 1868 … or James-Clark, 1867 …. The World of Protozoa, Rotifera, Nematoda and Oligochaeta.
- ↑ a b OBIS: Salpingoeca H.J.Clark, 1866.
- ↑ eoL: Salpingoeca amphoridium James-Clark 1867 (via Names:OBIS). Memento im Webarchiv vom 9. März 2023.
- ↑ a b c d e Martin Kreutz: Salpingoeca ampullacea (Stein, 1878). Real Micro Life.
- ↑ Wolfgang Bettighofer: Salpingoeca ampulloides.
- ↑ Wolfgang Bettighofer: Salpingoeca buetschlii.
- ↑ a b c d e f g h Martin Carr, Daniel J. Richter, Parinaz Fozouni, Timothy J. Smith, Alexandra Jeuck, Barry S. C. Leadbeater, Frank Nitsche: A six-gene phylogeny provides new insights into choanoflagellate evolution. In: Molecular Phylogenetics and Evolution, Band 107, Februar 2017, S. 166-178; doi:10.1016/j.ympev.2016.10.011 (englisch).
- ↑ Wolfgang Bettighofer: Salpingoeca clarkii.
- ↑ Martin Kreutz: Salpingoeca clarkii (Stein, 1878). Real Micro Life.
- ↑ Salpingoeca convallaria Stein. Interim Register of Marine and Nonmarine Genera (IRMNG).
- ↑ Wolfgang Bettighofer: Salpingoeca frequentissima.
- ↑ Martin Kreutz: Salpingoeca frequentissima (Zacharias) Lemmermann, 1913. Real Micro Life.
- ↑ Wolfgang Bettighofer: Salpingoeca fusiformis.
- ↑ eoL: Salpingoeca fusiformis.
- ↑ eoL: Salpingoeca gracilis.
- ↑ a b Wolfgang Bettighofer: Salpingoeca helianthica.
- ↑ a b c
Ya Gao, Daisylyn Senna Tan, Mathias Girbig, Haoqing Hu, Xiaomin Zhou, Qianwen Xie, Shi Wing Yeung, Kin Shing Lee, Sik Yin Ho, Vlad Cojocaru, Jian Yan, Georg K. A. Hochberg, Alex de Mendoza, Ralf Jauch: The emergence of Sox and POU transcription factors predates the origins of animal stem cells. In: Nature Communicatios, Band 15, Nr. 9868, 14. November 2024; doi:10.1038/s41467-024-54152-x, hdl:1810/376326 (englisch). Dazu:
- Der Ursprung der Stammzellen: Proteine zur Regulation tierischer Stammzellen sind viel älter als das Tierreich selbst. Auf: Max-Planck-Gesellschaft (MPG) vom 15. November 2024.
- The origin of stem cells: Proteins that regulate animal stem cells are much older than animals themselves. Auf: Max-Planck-Gesellschaft (MPG) vom 15. November 2024.
- Michelle Starr: Genes Older Than Animal Life Itself Were Inserted Into Mice. Here's What Happened. Auf: sciencealert vom 3. Dezember 2024.
- Researchers Recreate Mouse from Choanoflagellate Gene that Predates Animals. Auf: sci.news vom 19. November 2024.
- Scientists Create “Extraordinary” Mouse Using Gene Older Than Animal Life Itself. Auf: SciTechDaily vom 19. November 2024.
- ↑ eoL: Salpingoeca infusionum.
- ↑ David J. Patterson, Kari Nygaard, Gero Steinberg, Carol M. Turley: Heterotrophic flagellates and other protists associated with oceanic detritus throughout the water column in the mid North Atlantic. In: Journal of the Marine Biological Association of the United Kingdom. 73. Jahrgang, Nr. 1, 1993, Epub 11. Mai 2009, S. 67–95, doi:10.1017/S0025315400032653 (englisch).
- ↑ eoL: Salpingoeca longipes.
- ↑ eoL: Salpingoeca minuta.
- ↑ eoL: Salpingoeca napiformis. Memento im Webarchiv vom 9. März 2023.
- ↑ Wolfgang Bettighofer: Salpingoeca desaedeleeri.
- ↑ eoL: Salpingoeca pyxidium.
- ↑ Wolfgang Bettighofer: Salpingoeca ringens.
- ↑ a b Mark J. Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King: Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. In: Developmental Biology, Band 357, Nr. 1, September 2011, S. 73–82; doi:10.1016/j.ydbio.2011.06.003, PMC 3156392 (freier Volltext), PMID 21699890 (englisch).
- ↑ Stephen R. Fairclough, Zehua Chen, Eric Kramer, Qiandong Zeng, Sarah Young, Hugh M. Robertson, Emina Begovic, Daniel J. Richter, Carsten Russ, M. Jody Westbrook, Gerard Manning, B. Franz Lang, Brian Haas, Chad Nusbaum, Nicole King: Premetazoan genome evolution and the regulation of cell differentiation in the choanoflagellate Salpingoeca rosetta. In: Genome Biology, Band 14, Nr. 2, Februar 2013, S. R15; doi:10.1186/gb-2013-14-2-r15 PMC 4054682 (freier Volltext), PMID 23419129 (englisch).
- ↑ a b c Núria Ros-Rocher, Alberto Pérez-Posada, Michelle M. Leger, Iñaki Ruiz-Trillo: The origin of animals: an ancestralreconstruction of the unicellular-to-multicellular transition. In: Open Biology, Band 11, Nr. 2, 24. Februar 2021, S. 200359; doi:10.1098/rsob.200359, PMID 33622103 (englisch).
- ↑ Wolfgang Bettighofer: Salpingoeca ruttneri.
- ↑ eoL: Salpingoeca tuba.
- ↑ Wolfgang Bettighofer: Salpingoeca urceolata.
- ↑ eoL: Salpingoeca urceolata.
- ↑ Wolfgang Bettighofer: Salpingoeca vaginicola.
- ↑ Martin Kreutz: Salpingoeca vaginicola (F. Stein, 1878). Real Micro Life.
- ↑ Martin Kreutz: Salpingoeca ventriosa (Jeuck, Arndt & Nitsche, 2014). Real Micro Life.
- ↑ NCBI Taxonomy Browser: Barroeca monosierra Hake, Burkhardt, Richter & King, 2021 (species); homotypic synonym: Salpingoeca monosierra, Salpingoeca sp. PTW-2021a; includes: Choanoflagellata sp. NKing-2021a.
- ↑ eoL: Salpingoeca H. J. Clark 1866, Names.
- ↑ a b NCBI Taxonomy Browser: Salpingoeca.
- ↑ Wolfgang Bettighofer: Protisten.de – Tiny Organisms in Aquatic Habitats.
- ↑ Martin Kreutz: Search: "Salpingoeca". Real Micro Life - online since 09 Dec 2021.
- ↑ WoRMS: Salpingoeca H.J.Clark, 1866 (Genus).
- ↑ Sina M. Adl, Alastair G. B. Simpson, Christopher E. Lane, Julius Lukeš, David Bass, Samuel S. Bowser, Matthew W. Brown, Fabien Burki, Micah Dunthorn, Vladimir Hampl, Aaron Heiss, Mona Hoppenrath, Enrique Lara, Line le Gall, Denis H. Lynn, Hilary McManus, Edward A. D. Mitchell, Sharon E. Mozley-Stanridge, Laura W. Parfrey, Jan Pawlowski, Sonja Rueckert, Laura Shadwick, Conrad L. Schoch, Alexey Smirnov, Frederick W. Spiegel: The revised classification of eukaryotes. In: J. Eukaryot. Microbiol. 59. Jahrgang, Nr. 5, 2012, S. 429–93, doi:10.1111/j.1550-7408.2012.00644.x, PMID 23020233, PMC 3483872 (freier Volltext) – (englisch).
- ↑ Tera C. Levin, Nicole King N: Evidence for sex and recombination in the choanoflagellate Salpingoeca rosetta. In: Current Biology, Band 23, Nr. 21, November 2013, S. 2176–2180, doi:10.1016/j.cub.2013.08.061, PMC 3909816 (freier Volltext), PMID 24139741 (englisch).
- ↑ a b Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amöboid switch in the closest living relatives of animals. In: eLife, 15. Januar 2021, Stand: 19. Februar 2021; doi:10.7554/eLife.61037 (englisch).
- ↑ a b NCBI Taxonomy Browser: Mylnosiga fluctuans Carr, Richter and Nitsche 2017 (species).
- ↑ a b
Timothy Jegla, Benjamin T. Simonson, J. David SpaffordAuthors: A broad survey of choanoflagellates revises the evolutionary history of the Shaker family of voltage-gated K+ channels in animals. In: PNAS, Band 121, Nr. 30, 17. Juli 2024, S. e2407461121; doi:10.1073/pnas.2407461121 (englisch)? Dazu:
- Study Challenges Evolutionary Timeline: Nervous System Building Blocks Found in Ancient Single-Celled Organisms. Auf: SciTechDaily vom 17. August 2014. Quelle: Penn State University

![Phylogenie der Choanoflagellaten nach Carr et al. (2017). Die Gattung Salpingoeca ist danach nicht monophyletisch.[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a3/1-s2.0-S1055790316302743-gr2_lrg.jpg/756px-1-s2.0-S1055790316302743-gr2_lrg.jpg)



