Loste
Die Stoffgruppe der Loste umfasst eine Reihe chlorierter organischer schwefel- oder stickstoffhaltiger Verbindungen und ist vor allem aufgrund des Einsatzes einiger dieser Substanzen als chemische Waffen bekannt. Der häufig einfach als Lost oder Senfgas bezeichnete Schwefellost ist dabei der bekannteste Vertreter dieser Stoffgruppe.
Die Bezeichnung Lost geht auf die ersten Buchstaben der Nachnamen der beiden deutschen Chemiker zurück, die während des Ersten Weltkrieges im Jahr 1916 den Vorschlag zur Verwendung von Schwefellost als chemischen Kampfstoff machten: Wilhelm Lommel und Wilhelm Steinkopf, beide Mitarbeiter von Fritz Haber am Kaiser-Wilhelm-Institut für physikalische und Elektrochemie in Berlin-Dahlem.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Loste sind in reiner Form bei Raumtemperatur flüssig. N-Lost, hier HN-3, wurde meist als festes Hydrochlorid eingesetzt.
Im Ersten Weltkrieg wurden Loste als Kampfstoffe eingesetzt. Die Freisetzung erfolgte als Flüssig- oder Feststoff-Aerosol, bei Verschuss in Granaten durch deren Zerlegerladung, ansonsten in Flüssigform durch eine Sprühvorrichtung (Sprühangriff). Sowohl S-Lost als auch N-Lost wurden auf Grund der Kennzeichnung der damit gefüllten Munition als Gelbkreuzkampfstoffe bezeichnet.
Lost durchdringt poröses Material und manche Gummi- und Kunststoffarten. Durch Anreicherung mit Wachsen, Harzen oder Kunststoffen entsteht Zäh-Lost, das an Materialien haften bleibt und somit schwieriger zu entgiften ist (sog. sesshafte Kampfstoffe).
Schwefelloste (S-Lost)
[Bearbeiten | Quelltext bearbeiten]Bei den Schwefellosten handelt es sich um endständig chlorierte Thioether. Diese Gruppe umfasst neun Chemikalien:
| Chemikalie | Code | Trivialname | CAS-Nr. | PubChem | Struktur |
|---|---|---|---|---|---|
| Bis(2-chlorethyl)sulfid | H/HD | Lost, Senfgas | 505-60-2 | 10461 | |
| 1,2-Bis(2-chlorethylthio)ethan | Q | Sesqui-Yperit | 3563-36-8 | 19092 | |
| Bis(2-chlorethylthioethyl)ether | T | Oxol-Lost | 63918-89-8 | 45452 | |
| 2-Chlorethylchlormethylsulfid | 2625-76-5 | ||||
| Bis(2-chlorethylthio)methan | HK | 63869-13-6 | |||
| Bis-1,3-(2-chlorethylthio)-n-propan | 63905-10-2 | ||||
| Bis-1,4-(2-chlorethylthio)-n-butan | 142868-93-7 | ||||
| Bis-1,5-(2-chlorethylthio)-n-pentan | 142868-94-8 | ||||
| Bis(2-chlorethylthiomethyl)ether | 63918-90-1 |
Reines S-Lost ist geruch- und farblos; der typische knoblauchähnliche Geruch entsteht, da S-Lost im Allgemeinen aus praktischen Gründen nur in technischer Qualität synthetisiert wird und die hierin in Spuren vorhandenen Neben- und Zersetzungsprodukte geruchlich dem Duftstoff von Knoblauch (Allicin) ähneln. Weiterhin ist das technische Produkt meist mit kolloidal gelöstem Schwefel verunreinigt und erscheint deswegen milchig bis gelblich.[2]
Während des Ersten Weltkriegs wurde festgestellt, dass im Oxol-Verfahren gewonnener Rohlost giftiger als anders gewonnener Reinlost war. Die Ursache dafür waren geringe Mengen Oxol-Lost, das deutlich giftiger ist. Dies wurde erst nach Ende des Krieges nachgewiesen.
Neben dem normalen S-Lost wurde während des Ersten Weltkriegs auch das sogenannte Winterlost hergestellt. Um den Gefrierpunkt zu senken, gab man dem S-Lost z. B. Arsinöl hinzu oder vermischte es mit anderen Losten.
Als weitere Mischungen sind u. a. bekannt:
- HL (HD + Lewisit (L))
- HT (HD + T)
- HM (HT + Q + Phenylarsindichlorid (PD))
- HQ (H + Q + Arsinöl)
- HS (HD + HN)
- HV (H + Methacrylsäuremethylester)
- HDV (HD + Methacrylsäuremethylester)
Stickstoffloste (N-Loste)
[Bearbeiten | Quelltext bearbeiten]Der Gruppe der Stickstoffloste gehören drei tertiäre, zumindest zweifach terminal chlorierte Amine an:
| Chemikalie | Code | Trivialname | CAS-Nr. | PubChem | Struktur |
|---|---|---|---|---|---|
| Bis(2-chlorethyl)ethylamin | HN-1 | Ethyl-S | 538-07-8 | 10848 | 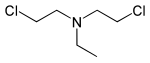
|
| Bis(2-chlorethyl)methylamin | HN-2 | Mechlorethamin, Chlormethin | 51-75-2 | 4033 | 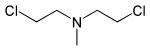
|
| Tris(2-chlorethyl)amin | HN-3 | Trichlormethin | 555-77-1 | 5561 | 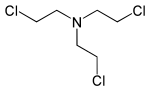
|
Das Stickstoff-Lost HN-1 wurde Anfang der 1930er Jahre als Warzenentferner entwickelt; erst später stellte sich seine militärische Nutzbarkeit heraus.
HN-2 wurde zunächst als Kampfstoff entwickelt. Später stellte man daraus ein Medikament zur Chemotherapie gegen Lymphknotenkrebs her (Chlormethin).[3]
Toxizität
[Bearbeiten | Quelltext bearbeiten]Hauptexpositionswege der Loste sind die perkutane oder die inhalatorische Aufnahme von Dämpfen (nur bei S-Lost). Lost ist ein starkes Hautgift und erwiesenermaßen krebserregend. Die Wirkung auf die Haut ist vergleichbar mit starken Verbrennungen oder Verätzungen. Es bilden sich große, stark schmerzende Blasen. Die Verletzungen heilen schlecht. Das Gewebe wird nachhaltig zerstört und die Zellteilung gehemmt. Großflächig betroffene Gliedmaßen müssen meistens amputiert werden. Werden die Dämpfe eingeatmet, so werden die Bronchien zerstört.
Die Haut kann durch sofortige Behandlung, z. B. Abwaschen der betroffenen Stellen mit Seifenlauge oder Chlorkalk-Aufschlämmung, entgiftet werden. Ein Abdecken der betroffenen Körperregionen, beispielsweise durch Kleidung oder Decken, ohne vorherige Entgiftung verschlimmert die Symptome zusätzlich.
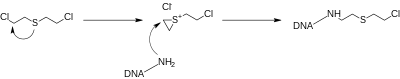
Die toxische Wirkung der Lost-Varianten kommt durch die Bildung hochreaktiver Verbindungen aufgrund eines intramolekularen SN2-Angriffs des Stickstoffs oder Schwefels auf das an das Chlor gebundene Kohlenstoffatom zustande (Nachbargruppeneffekt), in dessen Folge sich im Fall von N-Lost ein Aziridiniumion, im Fall von S-Lost ein Thiiraniumion bildet.
Diese verbinden sich mit Aminogruppen (R-NH2) der Desoxyribonukleinsäure (DNA); durch eine zweite – bei N-Losten auch eine dritte – Wiederholung der Anlagerung kann dies zu biochemisch nutzlosen oder toxischen Molekülen führen. Die veränderte DNA kann etwa den Programmierten Zelltod auslösen oder Krebs erzeugen.
Das Auge reagiert am empfindlichsten auf S-Lostdampf. Die Folge ist eine im glimpflichen Fall vorübergehende Erblindung, da das massive Lidödem eine aktive Augenöffnung verhindert. Die Augen sind bis zu einem gewissen Grad in der Lage, sich zu regenerieren. Daher bestehen oftmals gute Heilungschancen und Aussicht auf das Wiedererlangen der Sehkraft, allerdings kann das einige Monate dauern.[4][5]
Medizinische Nutzung von Lost-Derivaten
[Bearbeiten | Quelltext bearbeiten]Die Erfahrungen mit der die Zellteilung hemmenden Wirkung von Schwefellost führten dazu, dass nach dem Ersten Weltkrieg die ersten Zytostatika auf der Basis von Stickstofflost entwickelt und in der Krebstherapie eingesetzt wurden. So konnten während des Zweiten Weltkrieges Alfred Gilman, Sr. und Louis Goodman den Nachweis der Induktion von Remissionen auf das transplantierte Lymphosarkom der Maus durch N-Loste erbringen. Bei einer Studie von 1942 wurde ein 47-jähriger Krebspatient („J.D.“) erstmals mit einem N-Lost (HN-3) behandelt (dort u. a. als „Substanz X“ bezeichnet).[6][7][8] Weitere Studien erfolgten anschließend mit HN-2. Erst nach Ende des Zweiten Weltkrieges wurden die Ergebnisse dieser Studien veröffentlicht.[9]
Allerdings waren die originalen Kampfstoffe für die medizinische Verwendung noch viel zu giftig. Beispiele für erfolgreiche Krebsmedikamente auf Lost-Basis sind Bendamustin, Cyclophosphamid, Ifosfamid, Melphalan und Chlorambucil.
N-Lost-Derivate können neben der DNA (wie im Falle der Zytostatikagruppe der „Alkylanzien“) weitere biologische Targets alkylieren. An geeigneter Position an einem Wirkstoff angebracht, kann das Bis(2-chlorethyl)amino-Fragment deshalb als Linker benutzt werden, über den Liganden kovalent und irreversibel an biologische Targets wie etwa Rezeptoren binden können.
Beispiele hierfür sind der irreversibel bindende Opiat-Antagonist Chlornaltrexamin[10] (abgeleitet von Naltrexamin) und der Opiat-Agonist Chloroxymorphamin[11] (abgeleitet von Oxymorphamin). Durch die kovalente Bindung resultiert eine extrem lange Wirkungsdauer, die bis zu 6 Tage anhalten kann.
1964 wies Philip D. Lawley am Chester Beatty Research Institute (heute: Institute of Cancer Research, London) anhand von Experimenten mit Senfgas als Erster nach, dass nicht – wie bis dahin vermutet – Proteine, sondern die DNA das Hauptziel für krebserregende Chemikalien ist.[12]
Einsätze als chemische Waffe
[Bearbeiten | Quelltext bearbeiten]Nach Meldungen von Amnesty International wurde bei Darfur im Sudan bei mehreren Vorfällen mutmaßlich Loste (Senfgas, Lewisit oder Stickstofflost)[13] und nach Spekulationen mehrfach in den 2010er Jahren im Bürgerkrieg in Syrien gegen Zivilisten eingesetzt.[14]
Internationale Kontrollen
[Bearbeiten | Quelltext bearbeiten]Die Loste werden als Chemikalien der Liste 1 im internationalen Abrüstungsvertrages CWÜ von der hierfür zuständigen UN-Behörde, der Organisation für das Verbot chemischer Waffen (OPCW) mit Sitz in Den Haag, kontrolliert. Die Herstellung oder der Besitz sind verboten; ausgenommen sind Arbeiten, die ausschließlich dem Schutz vor diesen Substanzen dienen. In Deutschland muss jeder nicht-staatliche Umgang mit Losten vom Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA) genehmigt und der OPCW gemeldet werden.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Jochen Gartz: Chemische Kampfstoffe. der Tod kam aus Deutschland. Pieper und The Grüne Kraft, Löhrbach 2003, ISBN 3-922708-28-5.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Simon Jones: Yellow Cross: the advent of Mustard Gas in 1917 (englisch)
- Beschreibung der Kontrollen im internationalen Abrüstungsvertrag CWÜ
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Florian Schmaltz: Kampfstoff-Forschung im Nationalsozialismus: zur Kooperation von Kaiser-Wilhelm-Instituten, Militär und Industrie. Wallstein Verlag, 2005, ISBN 978-3-89244-880-8, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Bis(2-chlorethyl)sulfid im Lexikon der Biologie/Chemie. wissenschaft-online
- ↑ Mechlorethamine Hydrochloride (englisch)
- ↑ Effects of mustard gas. In: Medical Manual of Chemical Warfare (englisch).
- ↑ Blister Agent: Sulfur Mustard (H, HD, HS) ( vom 11. März 2009 im Internet Archive) (englisch).
- ↑ Alfred Gilman, Frederick S. Philips: The Biological Actions and Therapeutic Applications of the B-Chloroethyl Amines and Sulfides. In: Science. Band 103, Nr. 2675, 5. April 1946, S. 409–436, doi:10.1126/science.103.2675.409, PMID 17751251.
- ↑ Alfred Gilman: The initial clinical trial of nitrogen mustard. In: The American Journal of Surgery (= Symposium on Current Status of Chemotherapy of Solid Tumors). Band 105, Nr. 5, 1. Mai 1963, S. 574–578, doi:10.1016/0002-9610(63)90232-0.
- ↑ John E. Fenn, Robert Udelsman: First Use of Intravenous Chemotherapy Cancer Treatment: Rectifying the Record. In: Journal of the American College of Surgeons. Band 212, Nr. 3, 1. März 2011, S. 413–417, doi:10.1016/j.jamcollsurg.2010.10.018.
- ↑ Leon O. Jacobson et al.: NITROGEN MUSTARD THERAPY: Studies on the Effect of Methyl-Bis (Beta-Chloroethyl) Amine Hydrochloride on Neoplastic Diseases and Allied Disorders of the Hemopoietic System. In: Journal of the American Medical Association. Band 132, Nr. 5, 5. Oktober 1946, S. 263–271, doi:10.1001/jama.1946.02870400011003.
- ↑ P.S. Portoghese et al.: 6beta-[ N,N-Bis(2-chloroethyl)amino]-17-(cyclopropylmethyl)-4,5alpha-epoxy-3,14-dihydroxymorphinan (Chloranaltrexamine), a Potent Opioid Receptor Alkylating Agent with Ultralong Narcotic Antagonist Activity. In: J. Med. Chem. Band 21, Nr. 598, 1978.
- ↑ T.P. Caruso et al.: Chloroxymorphamine, and opioid receptor site-directed alkylating agent having narcotic agonist activity. In: Science. Band 204, Nr. 316, 1979.
- ↑ Stanley Venitt und David H. Phillips: Philip D. Lawley (1927–2011). In: Nature. Band 482, 2012, S. 36, doi:10.1038/482036a.
- ↑ Sudan: Credible evidence of the use of chemical weapons to kill and maim hundreds of civilians including children in Darfur revealed. Amnesty International, 29. September 2016.
- ↑ Mutmaßlicher Giftgasangriff in Syrien. tagesschau.de, 5. April 2017.