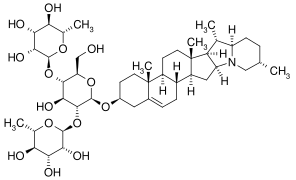
Solanum-Alkaloide
Die Solanum-Alkaloide sind eine chemische Stoffgruppe und bilden eine Untergruppe der Alkaloide. Strukturell sind sie den Steroidalkaloiden zuzuordnen. Den Namen tragen sie, da sie in Vertretern der Pflanzengattung der Nachtschatten (Solanum) zu finden sind.
Struktur und Vertreter
[Bearbeiten | Quelltext bearbeiten]Die Solanum-Alkaloide sind Glycoalkaloide, d. h. Glycoside mit einem Alkaloid als Aglycon. Außerdem gehören sie zur Gruppe der Steroidalkaloide, da die Aglycone von Steroiden abgeleitete Alkaloide sind.[1]
Es sind über 100 verschiedene Aglycone bekannt, die in Solanum-Alkaloiden auftreten. Diese lassen sich in fünf Strukturgruppen einteilen: Die beiden wichtigsten sind die Solaninidane (z. B. Solanidin, Leptinidin, Demissidin) und die Spirosolane (z. B. Solasodin und Tomatidin). Die anderen Gruppen sind die 22,26-Epiminocholestane (z. B. Solafloridin), die 22,26-Epimino-16,23-epoxycholestane (z. B. Solanocapsin) und die 3-Aminospirostane (z. B. Jurubidin).[2]
-
Solanidin
-
Solasodin
-
Tomatidin
-
Solanocapsin
Die überwiegende Mehrheit der Glycoside hat eine von drei verschiedenen Zuckerkomponenten: Solatriose, Chacotriose oder Lycotetraose.[3] Ausnahmen sind z. B. Solasodin-3-O-β-D-glucopyranosid aus Solanum umbelliferum[4] und das Jurubin[3], bei denen es sich um Glucoside handelt.
-
Solanin
-
Chaconin
-
Tomatin
-
Solasonin
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Verschiedene Arten der Gattung Solanum enthalten unterschiedliche Alkaloide. Der Gehalt schwankt stark, je nach Kultivar und, bei als Lebensmitteln verwendeten Pflanzen, je nach Lagerbedingungen. Die Pflanzen enthalten überwiegend Glycoside, die hydrolysierten freien Agylcone kommen nur in geringen Mengen vor.[1]
Kartoffel (Solanum tuberosum)
[Bearbeiten | Quelltext bearbeiten]Kartoffelpflanzen enthalten Solanin und Chaconin, die aus dem Aglycon Solanidin und der Zuckerkomponente Solatriose bzw. Chacotriose bestehen. Alle Pflanzenteile enthalten Alkaloide, v. a. aber die Sprossen und die unreife Schale.[1]
Tomate (Solanum lycopersicum)
[Bearbeiten | Quelltext bearbeiten]Tomatenpflanzen enthalten Tomatin (mit dem Aglycon Tomatidin) und Dehydrotomatin. Die Stängel, Blätter und Blüten enthalten viel Tomatin und weniger Dehydrotomatin. In unreifen Früchten ist die Verteilung umgekehrt. In reifen Früchten sind kaum Alkaloide enthalten.[1]
Aubergine (Solanum melongena)
[Bearbeiten | Quelltext bearbeiten]Auberginenpflanzen enthalten Solasonin und Solamargin (beide mit dem Aglycon Solasodin).[1]
Schwarzer Nachtschatten (Solanum nigrum)
[Bearbeiten | Quelltext bearbeiten]Der schwarze Nachtschatten enthält unter anderem Solamargin, Solasodin, Solanocapsin, Tomatidenol, Solanin und Solasonin.[5]

Biosynthese und biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Die Solanidin-Glucosyltransferase, die an der Biosynthese von Solanum-Alkaloiden beteiligt ist, glycosyliert Solanidin, aber auch Tomatidin und Soladodin, nicht jedoch andere Steroide wie Cholesterin oder Diosgenin.[6]
Solanum-Alkaloide werden in der Pflanze aus Cholesterin gebildet. Als Stickstoffquelle dienen Aminosäuren wie z. B. Arginin.
Die Bedeutung der Solanum-Alkaloide für die Pflanzen, von denen sie erzeugt werden, ist heute erforscht. Die giftigen Alkaloide dienen der Abwehr von Schädlingen und Krankheitserregern, aber auch zur Abwehr von Fressfeinden. Solanum-Alkaloide besitzen einen bitteren Geschmack, der ab etwa 11 mg pro 100 g Lebensmittel wahrnehmbar ist. Der Gehalt an Solanum-Alkaloiden in Lebensmitteln ist normalerweise unbedenklich. In beschädigten oder ungünstig gelagerten Kartoffeln können aber gesundheitsschädliche Konzentrationen erreicht werden.
Resorption und Stoffwechsel
[Bearbeiten | Quelltext bearbeiten]Solanum-Alkaloide werden nur zu einem geringen Anteil resorbiert. Die maximale Konzentration im Blut wird vier bis acht Stunden nach dem Verzehr erreicht. Als Halbwertszeit wurden für α-Chaconin 19, für α-Solanin 11 Stunden ermittelt. Die Ausscheidung erfolgt hauptsächlich unverändert über den Darm sowie über die Niere. Der Hauptmetabolit der Kartoffel-Alkaloide ist das Aglycon Solanidin. Dessen Konzentrationen im Plasma sind im Vergleich zu den Glycoalkaloiden geringer. Solanidin wird jedoch in der Leber gespeichert und deutlich langsamer ausgeschieden. Bei Stoffwechselbelastungen wie Hunger, Schwangerschaft oder Krankheit kann gespeichertes Solanidin vermutlich wieder freigesetzt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Solanin und Chaconin sind Inhibitoren verschiedener Cholinesterasen, z. B. der Plasma-Cholinesterase.[1] Mehrere Solanum-Alkaloide wirken fungizid.[7]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Die Solanum-Alkaloide sind giftig; dabei hängt die Wirkung stark von der Zuckerkomponente ab. Entfernung von einer oder mehreren Zuckereinheiten reduziert im Allgemeinen die Giftigkeit der Verbindungen. Mehrere gleichzeitig eingenommene Alkaloide wirken synergistisch, d. h. stärker als von der einzelnen Wirkung her zu erwarten. Einnahme von Glucose-6-phosphat oder Nicotin-Adenin-Dinucleosid reduziert die Giftwirkung.[8] Zum Teil wirken die Alkaloide teratogen, wobei die Wirkung der Glycoside deutlich stärker ist als die der freien Aglycone.[9]
Die Toxikologie von Solanin ist vergleichsweise gut erforscht, es verursacht Kopfschmerzen, Erbrechen, Fieber, Verwirrung, Unruhe und Halluzinationen. Kochen und Braten von Kartoffeln hat kaum Einfluss auf den Solanin-Gehalt.[1][8]
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Pharmakologische Effekte wurden für viele Solanum-Alkaloide beschrieben, insbesondere wirken viele der Verbindungen fungizid, antiviral oder entzündungshemmend. Zudem wurden für viele der Alkaloide (z. B. Tomatidin und Solasodin) Wirkungen gegen bestimmte Krebsarten beschrieben, z. B. Darm- und Leberkrebs.[8][10][11]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Solanum-Alkaloide wirken als Korrosionsinhibitoren und vermindern schädigende Einwirkungen von Säuren auf Stahl.[12]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Die Solanum-Alkaloide Solanin und Chaconin können nach Extraktion mit Pyridin nach Silylierung anschließend gaschromatographisch quantitativ bestimmt werden.[13]
Quellen
[Bearbeiten | Quelltext bearbeiten]- Habermehl, Hamman, Krebs: Naturstoffchemie. 2. Auflage, Springer-Verlag 2002, ISBN 978-3-540-11002-6
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Donald G. Barceloux: Potatoes, Tomatoes, and Solanine Toxicity (Solanum tuberosum L., Solanum lycopersicum L.). In: Disease-a-Month. Band 55, Nr. 6, Juni 2009, S. 391–402, doi:10.1016/j.disamonth.2009.03.009.
- ↑ Eintrag zu Solanum-Steroid-Alkaloide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Juli 2023.
- ↑ a b Eintrag zu Solanum-Steroid-Alkaloidglycoside. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Juli 2023.
- ↑ Youn C. Kim, Qing-Ming Che, A. A. Leslie Gunatilaka, David G. I. Kingston: Bioactive Steroidal Alkaloids from Solanum umbelliferum. In: Journal of Natural Products. Band 59, Nr. 3, 1. Januar 1996, S. 283–285, doi:10.1021/np960125a.
- ↑ Xufei Chen, Xufen Dai, Yinghai Liu, Yan Yang, Libang Yuan, Xirui He, Gu Gong: Solanum nigrum Linn.: An Insight into Current Research on Traditional Uses, Phytochemistry, and Pharmacology. In: Frontiers in Pharmacology. Band 13, 16. August 2022, doi:10.3389/fphar.2022.918071, PMID 36052142, PMC 9424827 (freier Volltext).
- ↑ Andrew Stapleton, Paul V. Allen, Mendel Friedman, William R. Belknap: Purification and characterization of solanidine glucosyltransferase from the potato (Solanum tuberosum). In: Journal of Agricultural and Food Chemistry. Band 39, Nr. 6, Juni 1991, S. 1187–1193, doi:10.1021/jf00006a040.
- ↑ Genjiro Kusano, Akira Takahashi, Kazuhiro Sugiyama, Shigeo Nozoe: Antifungal properties of solanum alkaloids. In: Chemical and Pharmaceutical Bulletin. Band 35, Nr. 12, 1987, S. 4862–4867, doi:10.1248/cpb.35.4862.
- ↑ a b c Mendel Friedman: Analysis of biologically active compounds in potatoes (Solanum tuberosum), tomatoes (Lycopersicon esculentum), and jimson weed (Datura stramonium) seeds. In: Journal of Chromatography A. Band 1054, Nr. 1-2, Oktober 2004, S. 143–155, doi:10.1016/j.chroma.2004.04.049.
- ↑ Mendel. Friedman, J. R. Rayburn, J. A. Bantle: Structural relationships and development toxicity of Solanum alkaloids in the frog embryo teratogenesis assay-Xenopus. In: Journal of Agricultural and Food Chemistry. Band 40, Nr. 9, September 1992, S. 1617–1624, doi:10.1021/jf00021a029.
- ↑ Julien A. Delbrouck, Michael Desgagné, Christian Comeau, Kamal Bouarab, François Malouin, Pierre-Luc Boudreault: The Therapeutic Value of Solanum Steroidal (Glyco)Alkaloids: A 10-Year Comprehensive Review. In: Molecules. Band 28, Nr. 13, 23. Juni 2023, S. 4957, doi:10.3390/molecules28134957, PMID 37446619, PMC 10343844 (freier Volltext).
- ↑ Srinivas Koduru, D.S. Grierson, M. van de Venter, A.J. Afolayan: Anticancer Activity of Steroid Alkaloids Isolated from Solanum aculeastrum . In: Pharmaceutical Biology. Band 45, Nr. 8, Januar 2007, S. 613–618, doi:10.1080/13880200701538690.
- ↑ Jihane SERBOUT, A. Bitari, Rachid Touzani, M Bouklah, Belkheir HAMMOUTI: An insight on the corrosion inhibition of mild steel in aggressive medium by Solanum Tuberosum extract. In: Arabian Journal of Medicinal and Aromatic Plants. Vol 8, 2. August 2022, S. 151–165 Pages, doi:10.48347/IMIST.PRSM/AJMAP-V8I2.30250.
- ↑ Christian Roosen-Runge, Erich Schneider: Zur Bestimmung der Solanum-Alkaloide Solanin und Chaconin. In: Zeitschrift für Lebensmittel-Untersuchung und Forschung. Band 164, Nr. 2, 1977, S. 96–97, doi:10.1007/BF01354310.