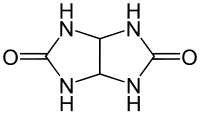
Glycoluril
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycoluril | ||||||||||||||||||
| Andere Namen |
Tetrahydroimidazo[4,5-d]imidazole-2,5(1H,3H)-dione | ||||||||||||||||||
| Summenformel | C4H6N4O2 | ||||||||||||||||||
| Kurzbeschreibung |
geruchloses weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 142,116 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
0,8 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
~300 °C[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Glycoluril ist ein bicyclisches Kondensationsprodukt aus einem Molekül Glyoxal und zwei Molekülen Harnstoff und fällt als geruchloses weißes Pulver an. Starke intermolekulare Wasserstoffbrücken bedingen den hohen Schmelzpunkt von ca. 300 °C, bei dem sich Glycoluril zersetzt. Glycoluril ist der Grundbaustein für die macrocyclischen, käfigartigen Cucurbiturile, die wie die ähnlich gebauten Cyclodextrine und Calixarene kleine Moleküle in ihren Hohlraum aufnehmen können.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Glycoluril kann durch Natriumamalgam-Reduktion von Allantoin erhalten werden. In industriellem Maßstab wird Glycoluril durch Reaktion von 40%igem wässrigen Glyoxal mit Harnstoff in ca. 90%iger Ausbeute hergestellt.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die vier amidartigen und daher aziden Wasserstoffatome des Glycolurils sind einer Reihe von chemischen Reaktionen zugänglich, wie z. B. der Substitution durch Halogene oder der Umsetzung mit Formaldehyd.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Glycoluril dient als Ausgangsstoff für Tetrachlor-[3] und Tetrabromglycoluril, die als Biozide in der Wasserbehandlung, zur Schwimmbaddesinfektion und als Verstärker für Schleimbekämpfungsmittel in der Papier- und Pappeherstellung eingesetzt werden.
Glycoluril wurde als Stickstoffdünger mit verzögerter N-Freisetzung diskutiert,[4] hat wegen zu hoher Kosten aber keine Verbreitung gefunden.
Glycoluril wird mit überschüssigem Formaldehyd zum Tetramethylolglycoluril umgesetzt, das verzögert Formaldehyd freisetzt und daher als Biozid in wasserbasierten Lacken, in Flüssigwaschmitteln und in Pflege- und Reinigungsmitteln (in Konzentrationen von 0,1 %) eingesetzt wird.[5] Außerdem findet es Verwendung als Vernetzer für hydroxygruppenhaltige Polymere, als industrielles Fungizid und als Beschleuniger in Zementen.
Aus Glycoluril entsteht durch Umsetzung mit Acetanhydrid Tetraacetylglycoluril (TAGU), das wegen zu langsamer Bioabbaubarkeit als Bleichaktivator für Natriumpercarbonat in festen Waschmittelzubereitungen keine weite Verbreitung gefunden hat.[6]
Die Reaktion mit Nitriersäure führt zu dem Sprengstoff Tetranitroglycoluril (TNGU, Sorguyl).[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt Glycoluril beim National Institute of Environmental Health Sciences, abgerufen am 29. Juli 2017 (PDF; 34 kB).
- ↑ a b Datenblatt Glycoluril bei Sigma-Aldrich, abgerufen am 3. April 2011 (PDF).
- ↑ Frank B. Slezak, Henry Bluestone, Thomas A. Magee, John H. Wotiz: Preparation of Substituted Glycolurils and Their N-Chlorinated Derivatives. In: The Journal of Organic Chemistry. Band 27, Nr. 6, 1962, S. 2181–2183, doi:10.1021/jo01053a069.
- ↑ T. Shimidzu: Glycoluril as a Slow Release Nitrogen Fertilizer. In: Soil Science and Plant Nutrition. Band 33, Nr. 2, 1987, S. 291–298, doi:10.1080/00380768.1987.10557574.
- ↑ Verwendung von Formaldehyd oder Formaldehyd-Abspaltern in Pflege- und Reinigungsmitteln in Privathaushalten (PDF; 53 kB), Vortrag auf der BfR-Fachveranstaltung „Neubewertung von Formaldehyd – Beitrag des BfR zum Verbraucherschutz“
- ↑ Uri Zoller: Handbook of detergents. Part E, Applications. CRC Press, Boca Raton, FL 2008, ISBN 978-1-4200-1816-5, Kapitel 16: Application of Surfactants in Environmental Remediation.
- ↑ J. K. Agrawal, R. D. Hodgson: Organic chemistry of explosives. John Wiley & Sons, Chichester 2007, ISBN 978-0-470-02967-1, S. 278.
