Streptococcus mutans
| Streptococcus mutans | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
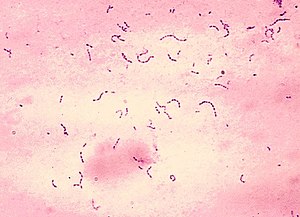
Streptococcus mutans (Gram-Färbung) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Streptococcus mutans | ||||||||||||
| Clarke 1924[1] |
Streptococcus mutans ist eine Bakterienart aus der Gattung der Streptokokken (Streptococcus). S. mutans ist der Leitorganismus der Zahnkaries und bei fast jedem Menschen im Speichel vorhanden. Die Höhe der Konzentration von S. mutans im Speichel korreliert eng mit dem Kariesrisiko.[2] Abseits von Karies können diese Bakterien auch an anderen Erkrankungen beteiligt sein. Es konnte für S. mutans eine Beteiligung an der infektiösen Endokarditis (Herzklappenentzündung) gezeigt werden.[3]
Beschreibung
[Bearbeiten | Quelltext bearbeiten]S. mutans hat etwa kugel- bis eiförmige Zellen („Kokken“), die zu zweit oder in Ketten angeordnet und nicht aktiv beweglich sind. Das Bakterium ist grampositiv, fakultativ anaerob, hat oxidativen und fermentativen Energiestoffwechsel und bildet keine Sporen. Auf Gelnährmedien mit komplexen Nährstoffen bildet S. mutans rundliche, konvexe (gewölbte) Kolonien mit granulierter (gekörnter) Oberfläche. Die meisten Stämme wirken α-hämolytisch (grünliche Verfärbung um die Bakterien herum auf einem bluthaltigen Nährboden).[4] Bei drei Stämmen wurde aber auch eine β-Hämolyse (vollständige Auflösung der Erythrozyten und Abbau des Hämoglobins) nachgewiesen.[5]
Pathophysiologie
[Bearbeiten | Quelltext bearbeiten]Streptococcus mutans gilt als wichtigster Verursacher der Karies. Der Erreger besitzt eine Reihe spezieller Eigenschaften (Virulenzfaktoren), die ihm eine Hauptrolle bei der Entstehung des bakteriellen Zahnbelags zuweisen:
- Glukanvermittelte Adhärenz: S. mutans bildet aus der im Speisebrei enthaltenen Saccharose, extrazelluläre Glucane, mit der die Bakterien in der Lage sind, sich an den Zahnschmelz anzuheften. Es wird also auf den Oberflächen der Zähne ein Biofilm gebildet. Die Bildung der Glucane wird durch Glucosyltransferasen (Enzyme zur Übertragung von Glucoseeinheiten) vermittelt. Die Aktivität der Glucosyltransferasen gilt als Messlatte für die Virulenz des Erregers.[6]
- Milchsäureproduktion: S. mutans baut im Zuge eines fermentativen Energiestoffwechsels Kohlenhydrate zu Milchsäure (Lactat) ab. Der daraus resultierende Abfall des pH-Werts führt zur Demineralisation der Zahnsubstanz.[6]
- Säuretoleranz: Durch das aktive Ausscheiden von Protonen ist S. mutans in der Lage, auch in stark saurem Milieu zu überleben.[6]
S. mutans in der Oralflora
[Bearbeiten | Quelltext bearbeiten]Der Nachweis von S. mutans an sich hat noch keinen Krankheitswert, da die Bakterien natürlicherweise im Mundraum vorkommen. Sie sind Teil der oralen Normalflora (oral – den Mund betreffend) und stellen einen bedeutenden Anteil aller Streptokokken der Mundhöhle.[7] Wenn jedoch ein kombiniert gutes Wachstum von S. mutans zusammen mit Hefen (Candida) stattfindet, wird die Biofilmbildung gefördert, weil es zu vermehrter Glukanbildung kommt.[7] Das bedeutet, dass die Mikroorganismen eine längere Verweildauer im Mund haben und sich der kariogene Effekt verstärkt, da gleichzeitig vermehrt Säure gebildet wird.[7] Diese kann vom Speichel nur begrenzt abgepuffert werden und sobald sie die Pufferkapazität übersteigt, sterben andere Bakterien ab die die gleiche ökologische Nische besetzen. Bakterien wie Streptococcus oralis, die Gegenspieler sind und das Wachstum begrenzen, sind dann reduziert. Wenn der Prozess fortdauert, die bakterielle Vielfalt zugunsten von S. mutans reduziert ist und der Biofilm nicht aufgebrochen wird, entsteht ein Steady state der Kariesbildung ermöglicht.[8] An das Leben in Biofilmen hat sich das Bakterium perfekt angepasst und kann sich dort um ein Vielfaches besser vermehren als dies im planktonischen Wachstum (Vermehren außerhalb des Biofilms) der Fall ist.[9]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Clarke, J. Kilian (1924). On the Bacterial Factor in the Ætiology of Dental Caries. British Journal of Experimental Pathology 5: 141–7. PMC 2047899 (freier Volltext).
- ↑ A Sharma et al. (2009): Dermatoglyphic interpretation of dental caries and its correlation to salivary bacteria interactions: An in vivo study In: JISPPD, Vol. 27, No. 1, S. 17–21 PMID 19414969 doi:10.4103/0970-4388.50811
- ↑ Ryota Nomura, Saaya Matayoshi, Masatoshi Otsugu, Takahiro Kitamura, Noboru Teramoto, Kazuhiko Nakano: Contribution of Severe Dental Caries Induced by Streptococcus mutans to the Pathogenicity of Infective Endocarditis. In: Infection and Immunity. Band 88, Nr. 7, 22. Juni 2020, ISSN 1098-5522, S. e00897–19, doi:10.1128/IAI.00897-19, PMID 32312765, PMC 7309618 (freier Volltext).
- ↑ Richard R. Facklam et al. (1977): Physiological Differentiation of Viridans Streptococci In: JCM, Vol. 5, No. 2, S. 184–201 PMID 845245
- ↑ Larry Wolff et al. (1978): Observation of Beta-Hemolysis Among Three Strains of Streptococcus mutans In: IAI, Vol. 19, No. 2, S. 745–748 PMID 24591
- ↑ a b c Friedrich Burkhardt: Mikrobiologische Diagnostik. Bakteriologie, Mykologie, Virologie, Parasitologie. Thieme, 2009, ISBN 978-3-13-743602-7, S. 323.
- ↑ a b c Khalid H. Metwalli, Shariq A. Khan, Bastiaan P. Krom, Mary Ann Jabra-Rizk: Streptococcus mutans, Candida albicans, and the Human Mouth: A Sticky Situation. In: PLoS Pathogens. Band 9, Nr. 10, 17. Oktober 2013, ISSN 1553-7366, S. e1003616, doi:10.1371/journal.ppat.1003616, PMID 24146611, PMC 3798555 (freier Volltext).
- ↑ J. Abranches, L. Zeng, J. K. Kajfasz, S. R. Palmer, B. Chakraborty, Z. T. Wen, V. P. Richards, L. J. Brady, J. A. Lemos: Biology of Oral Streptococci. In: Microbiology Spectrum. Band 6, Nr. 5, 7. September 2018, ISSN 2165-0497, doi:10.1128/microbiolspec.GPP3-0042-2018, PMID 30338752, PMC 6287261 (freier Volltext).
- ↑ Yung-Hua Li, Peter C. Y. Lau, Janet H. Lee, Richard P. Ellen, Dennis G. Cvitkovitch: Natural Genetic Transformation of Streptococcus mutans Growing in Biofilms. In: Journal of Bacteriology. Band 183, Nr. 3, Februar 2001, ISSN 0021-9193, S. 897–908, doi:10.1128/JB.183.3.897-908.2001, PMID 11208787, PMC 94956 (freier Volltext).