Ethosuximid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Ethosuximid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H11NO2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 141,17 g·mol−1 | ||||||||||||||||||
| Löslichkeit |
löslich in Ethanol (100 mg/ml)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ethosuximid ist ein Arzneistoff mit krampflösender Wirkung, der zur Behandlung von Epilepsien angewendet wird. Seine chemische Struktur ähnelt der des Phenytoins, das ebenfalls zur antiepileptischen Therapie eingesetzt wird.
Wirkmechanismus und Anwendungsgebiet
[Bearbeiten | Quelltext bearbeiten]Ethosuximid verringert die spannungsabhängigen Calciumströme über eine Hemmung der Calciumkanäle vom T-Typ im intralaminären Nucleus des Thalamus.
Es wird überwiegend zur Behandlung von generalisierten Absencen insbesondere des Kindesalters (Absence-Epilepsie des Kindesalters) eingesetzt. Diese Epilepsieform zeigt typische Anfallsmuster in Form von 3-Hz-Spike-Waves-Komplexen im Elektroenzephalogramm. Ethosuximid ist ein Mittel der ersten Wahl[3] und hat eine superadditive Wirkung zu Valproinsäure, wenn es mit dieser kombiniert wird. Ferner ist Ethosuximid angezeigt bei Myoklonien des Jugendlichen (Impulsiv-Petit-mal), wenn andere Arzneimittel nicht wirksam waren bzw. nicht vertragen wurden.
Die Elimination erfolgt großenteils über die Leber, die Halbwertszeit (HWZ) beträgt um die 48 bis 60 Stunden,[4] bei Kindern ungefähr 30 Stunden. Die gleichzeitig Einnahme von Valproinsäure kann die HWZ von Ethosuximid erhöhen durch kompetitive Hemmung der Metabolisierung, wohingegen die gleichzeitigen Einnahme von Carbamazepin eine höhere Plasmaclearance induziert.
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Dosisabhängig können Übelkeit, Erbrechen, Schluckauf, Müdigkeit, Kopfschmerzen, Depression, Bewegungsstörungen und Psychosen auftreten. Dosisunabhängig sind unterschiedliche Hautausschläge bis hin zum Stevens-Johnson-Syndrom und Blutbildveränderungen beschrieben.
Chemie
[Bearbeiten | Quelltext bearbeiten]Ethosuximid ist ein chiraler Arzneistoff mit einem Stereozentrum. Therapeutisch wird das Racemat, die 1:1-Mischung des (S)- und des (R)-Isomeren, eingesetzt.[5]
| Enantiomere von Ethosuximid | |
|---|---|
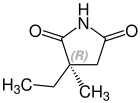 CAS-Nr. 39122-20-8 |
 CAS-Nr. 39122-19-5 |
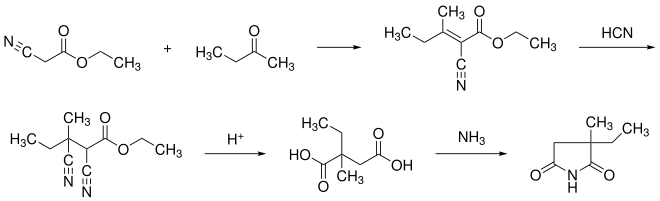
Die Synthese kann ausgehend von Cyanessigsäureethylester und Methylethylketon erfolgen. Diese kondensieren in einer Knoevenagel-Reaktion. An die entstandene Doppelbindung wird Blausäure addiert. Beide Nitril-Gruppen werden sauer zu Carbonsäuren hydrolisiert. Mit Ammoniak erfolgt der Ringschluss zum Succinimid.[6]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Petinimid (A, CH), Petnidan (D), Suxilep (D), Suxinutin (A)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Ethosuximide bei Sigma-Aldrich, abgerufen am 31. März 2011 (PDF).
- ↑ Eintrag ETHOSUXIMIDE CRS beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 21. Juli 2008.
- ↑ Ethosuximid scheint die beste Wahl zu sein, DAZ 23/2010.
- ↑ Ernst Mutschler, Gerd Geisslinger, Heyo K. Kroemer, Sabine Menzel, Peter Ruth: Mutschler Arzneimittelwirkungen. Pharmakologie − Klinische Pharmakologie − Toxikologie. 10. Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2012, ISBN 3-8047-2898-7. S. 290.
- ↑ Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 – Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 182.
- ↑ R. S. Vardanyan, V. J. Hruby: Synthesis of Essential Drugs. Elsevier, Amsterdam 2006, ISBN 978-0-444-52166-8, 9 - Antiepileptic Drugs, S. 125–133, doi:10.1016/b978-044452166-8/50009-1.