Telomer
| Übergeordnet |
|---|
| Chromosom |
| Untergeordnet |
| Proteinkomplexe |
| Gene Ontology |
| QuickGO |
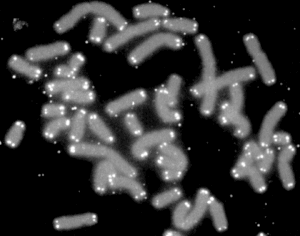
Die Telomere (gr. τέλος télos „Ende“ und μέρος méros „Teil“) sind die aus repetitiver DNA und assoziierten Proteinen bestehenden Enden der linearen Chromosomen eukaryotischer Organismen (Eukaryoten: Protisten, Pflanzen, Tiere inkl. dem Menschen). Die wiederholte Sequenz (Repeatsequenz) und die durch diese Wiederholung bedingte Länge sind in verschiedenen Organismen ähnlich, oft sogar gleich. Bei Wirbeltieren wiederholen sich „Hexanukleotide“, also sechs Nukleotide, mit der Sequenz 5'–TTAGGG–3' mehrere tausend Mal. Telomere sind dementsprechend mehrere Kilo-Basenpaare (kbp) lang. Telomere stabilisieren ihr Chromosom und schützen die DNA. Für diese Funktion ist auch die gefaltete Sekundärstruktur der Telomer-DNA wichtig. Telomere stehen in Zusammenhang mit Zellalterung und gelten als Biomarker für Alter.
Struktur der Telomere
[Bearbeiten | Quelltext bearbeiten]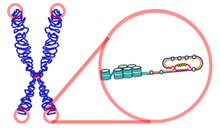
Die Chromosomen vieler Eukaryoten besitzen ein typisches, thymin- und guaninreiches Motiv, bei dem man davon ausgeht, dass es eine Quadrupelhelix ausbildet. Dabei paart sich zuerst der 3'-überlappende Strang mit sich selbst und bildet abnorme GG-Doppelbindungen. Dieser Doppelstrang paart sich erneut mit sich selbst und formt so die Quadrupelhelix, bei der die Guanine sogenannte Hoogsteen-Bindungen eingehen.[1][2] Die Sequenz der Telomer-DNA wird vom DNA-bindenden Proteinkomplex Shelterin erkannt und gebunden. Der Proteinkomplex ermöglicht der Zelle, das natürliche Chromosomenende von unterbrochenen DNA-Strängen zu unterscheiden. Zytologisch gehören die Telomere wegen ihrer dichten Verpackung zum Heterochromatin.[3]
Die von den Wirbeltieren bekannte Wiederholungseinheit 5'–TTAGGG–3' wurde auch bei den ursprünglichen Metazoen nachgewiesen: bei Schwämmen, Nesseltieren, Rippenquallen und Plattentieren. Deswegen stellt diese konservierte Sequenzeinheit das ursprüngliche Telomermotiv dar.[4] Dasselbe Telomermotiv zeigen auch die Chromosomen des Menschen.[5] Ebenso sind die Telomere bei den Insekten gut untersucht.[6]
Telomere bei der Replikation
[Bearbeiten | Quelltext bearbeiten]Organismen mit Telomerase
[Bearbeiten | Quelltext bearbeiten]
Mit jeder Zellteilung werden die Telomere kürzer, da die (normale) DNA-Polymerase am Folgestrang nicht mehr ansetzen kann. Die Telomerase gleicht die Verkürzung der DNA-Enden wieder aus. Dieses Enzym ist ein RNA-Protein-Komplex, der als spezialisierte Reverse Transkriptase funktioniert. Dazu fügt sie an das 3'-OH-Ende G-reiche Wiederholungseinheiten an, deren RNA-Vorlage sich in der Telomerase selbst befindet.[11] „Das funktioniert wie der Bau einer Brücke, die mit einer selbsttragenden Konstruktion vorangetrieben wird.“[12] Danach klappt der DNA-Leitstrang um und bildet mit sich selbst abnorme GG-Basenpaarungen. Von diesem Punkt aus können die RNA-Primase und die DNA-Polymerase den Folgestrang (auch diskontinuierlicher Rückwärtsstrang genannt) auffüllen.
Möglich ist aber auch ein Ansetzen der Telomerase am 3'-OH-Ende des Folgestrangs (siehe Abb.), woraufhin die Verlängerung der Telomere an diesem auch ohne Beteiligung des Leitstrangs erfolgt.
Aktiv ist die Telomerase prinzipiell bei einzelligen Eukaryoten (Protozoen). In höheren, mehrzelligen Organismen kommt nach dem Embryonalstadium das Enzym jedoch nur noch in ganz bestimmten Zellen zum Einsatz:
- in den Zellen der Keimbahn,
- in Zellen, die sich sehr häufig teilen müssen, wie den Stammzellen (z. B. im Knochenmark) und den Immunzellen,
- in bis zu 94 % aller proliferierenden Krebszellen.
Die Enzymaktivität der Telomerase lässt sich durch die TRAP-Methode feststellen.
Unterschreitet die Telomerlänge ein kritisches Minimum von circa 4 kbp, kann sich die Zelle nicht mehr teilen. Oft tritt dann der programmierte Zelltod (Apoptose) oder ein permanenter Wachstumsstopp ein (Seneszenz). Die hierdurch begrenzte Lebenszeit der Zelle wird als Mechanismus zur Tumorunterdrückung verstanden. Erfolgen trotz verkürzter Telomere weitere Zellteilungen, wie in manchen Krebszellen, verlieren die Chromosomen an Stabilität. Es hat sich allerdings bei Knock-out-Mäusen gezeigt, dass sie mehrere Generationen ohne Telomerase lebensfähig bleiben. Es wird angenommen, dass die Reparatur der Telomere auch über Rekombinationsereignisse vonstattengehen kann; geklärt ist dies bei Säugern noch nicht.
Organismen ohne Telomerase
[Bearbeiten | Quelltext bearbeiten]Die fünf langen Polytänchromosomen von Drosophila hydei (1n = 6) zeigten unter dem Elektronenmikroskop große Endstrukturen. Diese kompakten Regionen galten als „morphologische Manifestation der postulierten Telomere“.[13] Überraschend kam die Erkenntnis, dass die Modellfliege der Genetik gar nicht über eine Telomerase verfügt. Die Enden der Chromosomen von Drosophila melanogaster bestehen aus Wiederholungen spezialisierter Retrotransposons. Die Länge derartiger Telomere wird durch Transposition garantiert.[14][15][16][17] In den Telomeren der Polytänchromosomen von D. melanogaster sind drei Retrotransposon-Regionen zu unterscheiden, nämlich (1) cap, (2) HeT-A/TAHRE/TART und (3) repetitive TAS. Jede der drei Regionen bindet ihre eigenen Proteine; die drei Domänen überlappen sich nicht.[18] Die Telomere dieser Taufliege wurden auch in mitotischen Interphasekernen untersucht, und zwar im synzytialen Blastoderm, in dem die Teilungen synchron ablaufen.[19] Von besonderem Interesse waren die Telomere des Y-Chromosoms. Denn außer in der männlichen Keimbahn, ist das Drosophila-Y zur Gänze heterochromatisch.[20]
Neben der Taufliege besitzen auch Zuckmücken für die Verlängerung ihrer Telomere einen alternativen Mechanismus, nämlich ungleiche Rekombination.[21] Deswegen wurde vermutet, ein Vorfahr der Dipteren habe die Telomerase verloren.[22] Bei mehreren Arten von Käfern und Schnabelkerfen fand man ebenfalls Telomere, deren Wiederholungseinheiten von denen der Telomerase-Organismen abweichen.[23]
Mary-Lou Pardue erklärte, es sei letztlich gleichgültig, ob die Verlängerung der Telomere durch Telomerase oder durch Retrotransposition erfolge. Bei beiden Enzymmethoden sei eine Reverse Transkriptase im Spiel. Im Fall der Retroposon-Telomere wird die ganze RNA als Zwischenprodukt der Transposition kopiert. Die Telomerase arbeitet eleganter, weil sie von ihrer RNA-Matrize lediglich die telomerische Wiederholungseinheit kopiert.[24]
Bedeutung der Telomere
[Bearbeiten | Quelltext bearbeiten]Als Barbara McClintock sowie Hermann Joseph Muller gebrochene Chromosomen untersuchten, erkannten sie erstmals, wie wichtig die Enden linearer Chromosomen für deren Stabilität sind. Die beiden amerikanischen Nobelpreisträger sind die Urheber des Begriffes und Wortes Telomer (griechisch für End-Teil).[25][26][27][28] Neben den beiden Telomeren benötigt jedes Chromosom ein Zentromer sowie mindestens einen Startpunkt für die DNA-Replikation, um in einem Zellkern zu überleben.[29][30]
Telomere schützen beidseits lineare Chromosomen während des Zellzyklus und sind insofern für alle biologischen Vorgänge wichtig. Sie wurden mit dem Altern von Zellen sowie mit deren Immortalisierung und auch mit der Entstehung von Krebs in Zusammenhang gebracht.[31][32][33][34][35]
Einflüsse
[Bearbeiten | Quelltext bearbeiten]Der Einfluss von chronischem Stress auf die beschleunigte Verkürzung der Telomere wird über den Haushalt der Nachrichtenstoffe (Neurotransmitter) Dopamin und Serotonin vermittelt.[36] Moderate Veränderungen des Lebensstils können zu einer Verlangsamung der Verkürzung der Telomere führen.[37]
Neuere Forschung
[Bearbeiten | Quelltext bearbeiten]Bei einer Untersuchung des Erbguts des Raumfahrers Scott Kelly, der von 2015 bis 2016 für ein knappes Jahr im Weltall war, stellte man fest, dass Scotts Telomer-Enden im Weltall signifikant länger geworden waren, jedoch unmittelbar nach dessen Rückkehr zur Erde wieder ihre Ursprungslänge annahmen. Der Sinn und Zweck dieses Phänomens ist bislang unbekannt.[38]
Messung
[Bearbeiten | Quelltext bearbeiten]Die Längenmessung der Telomere wird mittels Polymerase-Ketten-Reaktion vorgenommen. Dabei wird aus einer Blutprobe die DNA extrahiert und Ergebnisse der Polymerase-Ketten-Reaktion der Telomere mit einer einmalig im Genom vorkommenden Gen-Stelle (Single-Copy-Gen) verglichen.
Telomeropathie
[Bearbeiten | Quelltext bearbeiten]Bei Mutationen der Gene für Proteine, die für den Schutz, die „Wartung“ und Reparatur der Telomere zuständig sind, kommt es zu deutlich verkürzten Telomeren. Dies betrifft vor allem den Komplex der Shelterine und den Telomerase-Komplex. Daraus resultiert ein deutlich verminderter Pool an Stammzellen mit geringerer regenerativer „Qualität“, die eine Gruppe chronischer Krankheiten auslösen, die als Telomer-Krankheiten oder Telomeropathien bezeichnet werden:
- Aplastische Anämie mit Knochenmarkversagen und Panzytopenie
- Formen des Myelodysplastischen Syndromes
- Idiopathische pulmonale Fibrose
- idiopathische Leberzirrhose
- Dyskeratosis congenita mit zahlreichen Subtypen und unterschiedlichen Mutationen von Genen, die alle Proteine codieren, die eine Funktion an den Telomeren haben. Die Funktion und Bedeutung der Telomere und ihrer Proteine wurde erst über die Entwicklung dieses Syndroms erkannt.
Die Telomeropathien sind genetisch sehr heterogen mit hoher Variabilität der Penetranz.
Bereits in den 1960er Jahren wurden Androgene zur Therapie des Knochenmarkversagens erfolgreich eingesetzt. Versuche in vitro konnten an menschlichen Lymphozyten und menschlichen CD34-positiven hämatopoetischen Stammzellen zeigen, dass Androgene die Genexpression für die reverse Telomerase-Transferase (TERT) und die enzymatische Aktivität der Telomerase steigern können. Dies kann bei Mäusen mit Telomer-Insuffizienz sogar zu einer hämatologischen Verbesserung und einer Verlängerung der Telomerlänge führen.
Eine erste prospektive Phase-1/2-Studie mit der Gabe des synthetischen Androgens Danazol (800 mg täglich für 24 Monate) musste wegen unerwartet starker Wirkung vorzeitig gestoppt werden, weil bei einer Zwischenanalyse bei allen zwölf bis dahin auswertbaren Patienten der primäre Endpunkt erreicht war, die Telomerschädigung nicht weiter zunahm. Bei elf Patienten waren nach 24 Monaten Therapie die Telomere sogar länger als zu Beginn (92 %) mit einer mittleren Verlängerung um 386 Basenpaare vorwiegend im ersten Behandlungsjahr. Bei 19 der 24 Patienten (79 %), die bis zum Stopp der Studie mindestens drei Monate behandelt worden waren, konnte eine hämatologische Verbesserung festgestellt werden. Während vor Studienbeginn 13 Patienten regelmäßige Bluttransfusionen benötigten, war dies bei Studienabbruch nur noch ein Patient.[39]
Diese Studie gibt Anlass zu einer größeren randomisierten kontrollierten Studie, jedoch kann aus dieser kleinen Studie mit wenigen Teilnehmer noch keine Therapieempfehlung für die Praxis abgeleitet werden, da vor allem Risiken, langfristige und unerwünschte Wirkungen nicht erfasst werden konnten.[40]
Telomere bei Bakterien
[Bearbeiten | Quelltext bearbeiten]Bakterien besitzen gewöhnlich ein ringförmiges Genom (Bakterienchromosom) und optional eines oder mehrere ringförmige Plasmide; selten kommen bei Bakterien auch größere DNA-Moleküle (Sekundärchromosomen) als Replikatinseinheiten (Replikons) vor. Lineare DNA-Moleküle sind für Bakterien untypisch; sie sind wahrscheinlich ein sekundäres Merkmal und stammen von ringförmigen Molekülen ab. Eine solche Evolution setzt spezielle Schutzmaßnahmen für die DNA-Enden (Telomere) gegen Abbau durch Nukleasen und (wie bei Eukaryoten) zur vollständigen Replikation dieser Telomere voraus. Diese Probleme sind im Laufe der Evolution auf mindestens vier unabhängige Arten gelöst worden:[41]
- in Eukaryoten (Protisten, Pflanzen, Pilzen und Tieren inkl. dem Menschen)
- in Actinobakterien (wiss. Actinomycetota) und Salmonellen (Plasmid BSSB1 in Salmonella enterica, zu Gammaproteobacteria)
- in der Gattung Borrelia (mit B. burgdorferi, zu Spirochäten, wiss. Spirochaetota)
- in der Gattung Agrobacterium (mit A. tumefaciens, zu Alphaproteobacteria)
- lineare DNA wurde auch in Cyanobakterien-Spezies gefunden (Gattung Crocosphaera mit C. subtropica, früher Cyanothece sp. ATCC 51142[42]).
Bei den Knöllchenbakterien (Rhizobiaceae) nennt man die Sekundärchromosomen auch Chromide, um sie von kleineren Plasmiden (Ti-Plasmid etc.) zu unterscheiden. Speziell bei Agrobacterium sind diese linear: ihre Telomere besitzen kovalent geschlossene Haarnadelschleifen (engl. hairpins), und eine sog. Protelomerase TelA wird durch das Gen telA kodiert.[41]
Belletristik
[Bearbeiten | Quelltext bearbeiten]1999 behandelte der amerikanische Schriftsteller John Darnton das Thema Telomere in seinem Roman Zwillingspark (The Experiment).[43]
Literatur
[Bearbeiten | Quelltext bearbeiten]- E. S. Epel, E. H. Blackburn u. a.: Accelerated telomere shortening in response to life stress. In: Proc Natl Acad Sci U S A. Band 101, Nr. 5014. Dezember 2004, S. 17323–17324.
- M. Mills, L. Lacroix u. a.: Unusual DNA conformations: Implications for telomeres. In: Current Medicinal Chemistry – Anti-Cancer Agents. Band 2, Nr. 5, September 2002, S. 627–644.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- [1] Nobelpreis 2009 an Elizabeth H Blackburn, Carol W Greider und Jack W Szostak.
- medicineprize2009.pdf Zusammenfassung von Rune Toftgård.
- Telomer im Spektrum Lexikon der Biologie
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Elizabeth H Blackburn, Joseph G. Gall: A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena. In: J Mol Biol 120 (1), 1978: 33–53.
- ↑ Jack Szostak, Elizabeth H Blackburn: Cloning yeast telomeres on linear plasmid vectors. In: Cell 29 (1), 1982: 245-255.
- ↑ Séverine Perrod, Susan M. Gasser: Long-range silencing and position effects at telomeres and centromeres: parallels and differences. In: Cell Mol Life Sci, Band 60, Nr. 11, November 2003, S. 2303–2318; doi:10.1007/s00018-003-3246-x, PMID 14625677 (englisch).
- ↑ Walther Traut, Monika Szczepanowski, Magda Vítková, Christian Opitz, František Marec, Jan Zrzavý: The telomere repeat motif of basal Metazoa. In: Chromosome Research 15, 2007: 371–382 doi:10.1007/s10577-007-1132-3.
- ↑ R K Moyzis, J M Buckingham, L S Cram, L L Deaven, M D Jones, J Meyne, R L Ratliff, J R Wu: A highly conserved repetitive DNA sequence, (TTAGGG)n, present at the telomeres of human chromosomes. In: Proc Natl Acad Sci USA 85 (18), 1988: 6622–6626.
- ↑ Magda Vítková, Jiří Král, Walther Traut, Jan Zrzavý, František Marec: The evolutionary origin of insect telomeric repeats, (TTAGG)n. In: Chromosome Research 13, 2005: 145–156.
- ↑ Gregg B Morin: The human telomere terminal transferase enzyme is a ribonucleoprotein that synthesizes TTAGGG repeats. In: Cell 59, 1989: 521–529.
- ↑ Charles Schumpert, Jacob Nelson, Eunsuk Kim, Jeffry L Dudycha, Rekha C Patel: Telomerase activity and telomere length in Daphnia. In: PLoS One 10 (5), 2015: e0127196. PMC 4427308 (freier Volltext)
- ↑ Stephan Jentsch, Heinz Tobler, Fritz Müller: New telomere formation during the process of chromatin diminution in Ascaris suum. In: Int J Dev Biol 46 (1), 2002: 143-148. ijdb.ehu.es Offener Artikel.
- ↑ Alan M Zahler, David M Prescott: DNA primase and the replication of the telomeres in Oxytricha nova. In: Nucleic Acids Research 17 (15), 1989: 6299–6317.
- ↑ Carol W Greider, Elizabeth H Blackburn: A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis. In: Nature 337 (6205), 1989: 331–337.
- ↑ Helmut Zacharias, Inge Kronberg: Telomere: Ende gut, alles gut. In: Biologie in unserer Zeit 6, 2009: 366–367 doi:10.1002/biuz.200990086.
- ↑ Hans D Berendes, Günther F Meyer: A specific chromosome element, the telomere of Drosophila polytene chromosomes. In: Chromosoma 25 (2), 1968: 184–197.
- ↑ Harald Biessmann, James M Mason, K Ferry, M d’Hulst, K Valgeirsdottir, K L Traverse, Mary-Lou Pardue: Addition of telomere-associated HeT DNA sequences „heals“ broken chromosome ends in Drosophila. In: Cell 61 (4), 1990: 663–673.
- ↑ Harald Biessmann, Larry E Champion, Mitch O’Hair, Karen Ikenaga, Babak Kasravi, James M Mason: Frequent transpositions of Drosophila melanogaster HeT-A transposable elements to receding chromosome ends. In: EMBO Journal 11 (12), 1992: 4459–4469. PMC 557021 (freier Volltext)
- ↑ Fang-Miin Sheen, Robert W Levis: Transposition of the LINE-like retrotransposon TART to Drosophila chromosome termini. In: Proc Natl Acad Sci USA 91, 1994: 12510–12514. PDF
- ↑ Mary-Lou Pardue: Drosophila telomeres: Another way to end it all. In: Elizabeth H Blackburn, Carol W Greider (Hrsg.): Telomeres. CSH Laboratory Press, Cold Spring Harbor, New York 1995: 339–370.
- ↑ Evgenia N Andreyeva, Elena S Belyaeva, Valerii F Semeshin, Galina V Pokholkova, Igor F Zhimulev: Three distinct chromatin domains in telomere ends of polytene chromosomes in Drosophila melanogaster Tel mutants. In: J Cell Science 118, 2005: 5465–5477. doi:10.1242/jcs.02654 PDF
- ↑ Natalia Wesolowska, Flavia L Amariei, Yikang S Rong: Clustering and protein dynamics of Drosophila melanogaster telomeres. In: Genetics 195 (2), 2013: 381–391. PMC 3781967 (freier Volltext).
- ↑ Sidney H Wang, Ruth Nan, Maria C Accardo, Monica Sentmanat, Patrizio Dimitri, Sarah C R Elgin: A distinct type of heterochromatin at the telomeric region of the Drosophila melanogaster Y chromosome. In: PLOS ONE 9 (1), 2014: e86451. doi:10.1371/journal.pone.0086451
- ↑ Lena Nielsen, Jan-Erik Edström: Complex telomere-associated repeat units in members of the genus Chironomus evolve from sequences similar to simple telomeric repeats. In: Molecular and Cellular Biology 13 (3), 1993: 1583–1589. PMC 359470 (freier Volltext)
- ↑ Harald Biessmann, James M Mason: Telomere maintenance without telomerase. In: Chromosoma 106, 1997: 63–69.
- ↑ James M Mason, Thomas A Randall, Radmila Capkova Frydrychova: Telomerase lost? In: Chromosoma 125 (1), 2016: 65–73. doi:10.1007/s00412-015-0528-7.
- ↑ Mary-Lou Pardue: Drosophila telomeres: Another way to end it all. In: Elizabeth H Blackburn, Carol W Greider (Hrsg.): Telomeres. CSH Laboratory Press, Cold Spring Harbor, New York 1995: 339–370. → „But only the portion of the RNA template encoding the telomeric repeat is copied in the case of telomerase, while the entire RNA transposition intermediate is copied in the case of the retroposons.“
- ↑ Hermann Joseph Muller: The remaking of chromosomes. In: The Collecting Net, Woods Hole 13, 1938: 181–195, 198.
- ↑ Barbara McClintock: The behaviour in successive nuclear divisions of chromosomes broken at meiosis. In: Proc Nat Acad Sci USA 25, 1939: 405–416. PDF. Dort S. 414: „a normal chromosome 9 [of Zea mays] with a large terminal knob on the short arm...“
- ↑ Hermann Joseph Muller: An analysis of the process of structural change in chromosomes of Drosophila. In: Journal of Genetics 40, 1940: 1–66 doi:10.1007/BF02982481; dort S. 21: „telomere“. erstes PDF; zweites PDF.
- ↑ Barbara McClintock: The stability of broken ends of chromosomes in Zea mays. In: Genetics 26, 1941, 234–282.
- ↑ Rigomar Rieger, Arnd Michaelis, Melvin M. Green: A glossary of genetics and cytogenetics: Classical and molecular. Springer: Heidelberg, Berlin, New York 1968, dort S. 428.
- ↑ A W Murray, Jack W Szostak: Construction of artificial chromosomes in yeast. In: Nature” 305 (5931), 1983: 189–193.
- ↑ Carol W. Greider: Telomeres, telomerase and senescence. In: BioEssays 12 (8), 1990: 357–402. doi:10.1002/bies.950120803.
- ↑ Carol W. Greider, Elizabeth H Blackburn: Telomeres, telomerase and cancer. In: Scientific American 274 (2), 1996: 92–97.
- ↑ Elizabeth H. Blackburn, Carol W. Greider, Jack W. Szostak: Telomeres and telomerase: The path from maize, Tetrahymena and yeast to human cancer and aging. In: Nature Medicine 12 (10), 2006: 1133–1138.
- ↑ Elizabeth H Blackburn, E S Epel, J Lin: Human telomere biology: A contributory and interactive factor in aging, disease risk, and protection. In: Science 350 (6265), 2015: 1193–1198. doi:10.1126/science.aab3389
- ↑ Carlos López-Otín, Maria A. Blasco, Linda Partridge, Manuel Serrano, Guido Kroemer: The Hallmarks of Aging. In: Cell. Band 153, Nr. 6, Juni 2013, S. 1194–1217, doi:10.1016/j.cell.2013.05.039, PMID 23746838, PMC 3836174 (freier Volltext) – (elsevier.com [abgerufen am 7. Mai 2019]).
- ↑ Martin Winkelheide: Genetik. Der soziale Status lässt sich an den Chromosomenenden ablesen. Deutschlandfunk. Forschung aktuell, 7. April 2014. Primärquelle: PNAS.
- ↑ Dean Ornish, Jue Lin, June M. Chan, Elissa Epel, Colleen Kemp: Effect of comprehensive lifestyle changes on telomerase activity and telomere length in men with biopsy-proven low-risk prostate cancer: 5-year follow-up of a descriptive pilot study. In: The Lancet Oncology. Band 14, Nr. 11, Oktober 2013, S. 1112–1120, doi:10.1016/S1470-2045(13)70366-8 (englisch).
- ↑ Julia Merlot: Scott Kelly auf der ISS: Ein Zwilling mutiert selten allein. In: Spiegel Online, 16. März 2018, abgerufen am 19. März 2018.
- ↑ Danielle M. Townsley, Bogdan Dumitriu, Delong Liu, Angélique Biancotto, Barbara Weinstein, Christina Chen, Nathan Hardy, Andrew D. Mihalek, Shilpa Lingala, Yun Ju Kim, Jianhua Yao, Elizabeth Jones, Bernadette R. Gochuico, Theo Heller, Colin O. Wu, Rodrigo T. Calado, Phillip Scheinberg, Neal S. Young: Danazol Treatment for Telomere Diseases. New England Journal of Medicine 2016; Band 374, Ausgabe 20 vom 19. März 2016, S. 1922–1931; doi:10.1056/NEJMoa1515319
- ↑ Peter M Lansdorp: Telomeres on Steroids - Tuning back the mitotic clock?. New England Journal of Medicine 2016; Band 374, Ausgabe 20 vom 19. März 2016, S. 1978–1980; doi:10.1056/NEJMe1602822
- ↑ a b Martha H. Ramírez-Bahena, Ludovic Vial, Florent Lassalle, Benjamin Diel, David Chapulliot, Vincent Daubin, Xavier Nesme, Daniel Muller: Single acquisition of protelomerase gave rise to speciation of a large and diverse clade within the Agrobacterium/Rhizobium supercluster characterized by the presence of a linear chromid. In: Molecular Phylogenetics and Evolution, Band 73, April 2014, S. 202-207; doi:10.1016/j.ympev.2014.01.005, PMID 24440816 (englisch). Zu A. viscosum siehe Fig. 1.
- ↑ LPSN: Species Crocosphaera subtropica Mareš and Johansen 2019.
- ↑ S. 244 ff.